信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70%Cu、25%Al、4%Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:
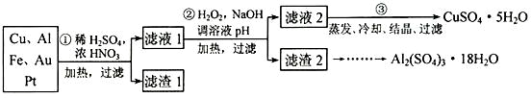
请回答下列问题:
(1)第①步 Cu与酸反应的离子方程式为__________________ ,得到滤渣 1的主要成分为_______________ 。
(2)第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+,用 H2O2做氧化剂的优点是____________________ 。
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中如何分离两种沉淀,写出反应的离子方程式______________ 。
(4)第③步蒸发所需玻璃仪器为__________________ 。

请回答下列问题:
(1)第①步 Cu与酸反应的离子方程式为
(2)第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+,用 H2O2做氧化剂的优点是
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中如何分离两种沉淀,写出反应的离子方程式
(4)第③步蒸发所需玻璃仪器为
更新时间:2019-03-04 23:54:30
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】铁及其化合物在工农业生产中应用广泛,部分含铁物质的分类与相应化合价的关系如图所示。
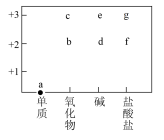
回答下列问题:
(1)在小烧杯中加入 蒸馏水,加热至沸腾后,向烧杯中加入几滴g的饱和溶液,继续煮沸即可制得e的胶体。胶体区别于溶液的最本质特征是
蒸馏水,加热至沸腾后,向烧杯中加入几滴g的饱和溶液,继续煮沸即可制得e的胶体。胶体区别于溶液的最本质特征是____ ;鉴别胶体和溶液的方法是_____ 。
(2)c固体的颜色为____ ,能否由a在氧气中点燃得到_____ (填“能”或“否”)。
(3)将f与稀盐酸混合,二者不反应,滴入 后,溶液很快变成黄色,该反应的离子方程式为
后,溶液很快变成黄色,该反应的离子方程式为______ ,下列物质中不能通过化合反应得到的是_____ (填字母)。
A.c B.d C.e D.f
(4)实验室检验g中铁元素的试剂是_____ ,下列可用于实验室制备d的装置有__ (填序号)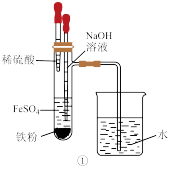


(5)高铁酸钾 是一种优良的自来水消毒剂。其中铁元素的化合价为
是一种优良的自来水消毒剂。其中铁元素的化合价为____ ,工业上用e与 在强碱性条件下反应制取
在强碱性条件下反应制取 ,其反应的离子方程式为
,其反应的离子方程式为_____ 。

回答下列问题:
(1)在小烧杯中加入
 蒸馏水,加热至沸腾后,向烧杯中加入几滴g的饱和溶液,继续煮沸即可制得e的胶体。胶体区别于溶液的最本质特征是
蒸馏水,加热至沸腾后,向烧杯中加入几滴g的饱和溶液,继续煮沸即可制得e的胶体。胶体区别于溶液的最本质特征是(2)c固体的颜色为
(3)将f与稀盐酸混合,二者不反应,滴入
 后,溶液很快变成黄色,该反应的离子方程式为
后,溶液很快变成黄色,该反应的离子方程式为A.c B.d C.e D.f
(4)实验室检验g中铁元素的试剂是



(5)高铁酸钾
 是一种优良的自来水消毒剂。其中铁元素的化合价为
是一种优良的自来水消毒剂。其中铁元素的化合价为 在强碱性条件下反应制取
在强碱性条件下反应制取 ,其反应的离子方程式为
,其反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】硫酸铜在工农业生产中用途广泛。工业上以孔雀石为原料制备CuSO4·xH2O晶体的流程如下图:

已知:①孔雀石主要成分是CuCO3·Cu(OH)2,不溶于水;含少量杂质FeO、Fe2O3、SiO2。
②SiO2不溶于水,不与硫酸反应。
回答下列问题:
(1)“滤渣1”的主要成分是___________ (填化学式)。
(2)“酸溶”时,CuCO3·Cu(OH)2与稀硫酸反应的离子方程式是___________ 。
(3)“滤液1”中含有的金属阳离子有___________ 。
(4)“滤渣2”的主要成分为Fe(OH)3。“氧化”时加入H2O2溶液目的是___________ ,反应的离子方程式是___________ 。
(5)从“滤液2”中获得CuSO4·xH2O晶体的操作依次为:加热浓缩、___________ 、过滤、洗涤、干燥。

已知:①孔雀石主要成分是CuCO3·Cu(OH)2,不溶于水;含少量杂质FeO、Fe2O3、SiO2。
②SiO2不溶于水,不与硫酸反应。
回答下列问题:
(1)“滤渣1”的主要成分是
(2)“酸溶”时,CuCO3·Cu(OH)2与稀硫酸反应的离子方程式是
(3)“滤液1”中含有的金属阳离子有
(4)“滤渣2”的主要成分为Fe(OH)3。“氧化”时加入H2O2溶液目的是
(5)从“滤液2”中获得CuSO4·xH2O晶体的操作依次为:加热浓缩、
您最近一年使用:0次
【推荐3】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如图所示.

(1)步骤Ⅱ所得滤渣中的物质是(写化学式)_____________ 。
(2)步骤II中的氧化还原反应的离子方程式为___________________________________ 。
(3)步骤Ⅳ还可以回收Na2SO4来制取Na2S。Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取,化学反应方程式为__________________________ 。
(4)已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图:

从滤液中得到Na2SO4的操作方法是_________________________________ 。
(5)在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 mol•L-1 Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.010 -4 mol•L-1时,Mn2+开始沉淀,则a=____________ 。[已知:H2S 的电离常数Ka1=1.310 -7,Ka2=7.010 -15;Ksp(MnS)=1.410 -15]

(1)步骤Ⅱ所得滤渣中的物质是(写化学式)
(2)步骤II中的氧化还原反应的离子方程式为
(3)步骤Ⅳ还可以回收Na2SO4来制取Na2S。Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取,化学反应方程式为
(4)已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图:

从滤液中得到Na2SO4的操作方法是
(5)在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 mol•L-1 Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.010 -4 mol•L-1时,Mn2+开始沉淀,则a=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某课外活动小组设计了以下实验测定Cu—Ag合金与浓硝酸的反应。其实验装置如图:

请回答下列问题:
(1)F仪器的名称是_______________ ,作用是____________________________ 。
(2)实验室用NH4Cl固体和饱和NaNO2溶液在加热条件下制备N2,该反应的化学方程式为____________________________ ;装置A中盛放的是酸性高锰酸钾溶液,作用是___________________________________________ 。
(3)进行实验。检查装置气密性后,在装置中添加相应的试剂,然后__________ (填操作步骤),再将B装置分液漏斗中的浓硝酸缓慢滴加到三颈烧瓶中。
(4)测定硝酸的物质的量。反应结束后,从装置D中所得500mL溶液中每次取出25.00mL溶液,加入2滴指示剂,用0.05 mol·L-1的NaOH溶液滴定,三次滴定所读数据如下表:
装置D中生成的硝酸为________ mol,则Cu-Ag合金与浓硝酸反应过程中生成的NO2在标准状况下的体积为__________ mL。
(5)测定NO的体积。在测定NO的体积时,若E中量气管中水的液面比干燥管的液面高,直接读数会使测定的气体体积_________ (填“偏大”或“偏小”),此时应将量气筒的位置_______ (填“下移”或“上移”),以保证量气筒中的液面与干燥管中的液面持平。

请回答下列问题:
(1)F仪器的名称是
(2)实验室用NH4Cl固体和饱和NaNO2溶液在加热条件下制备N2,该反应的化学方程式为
(3)进行实验。检查装置气密性后,在装置中添加相应的试剂,然后
(4)测定硝酸的物质的量。反应结束后,从装置D中所得500mL溶液中每次取出25.00mL溶液,加入2滴指示剂,用0.05 mol·L-1的NaOH溶液滴定,三次滴定所读数据如下表:
| 滴定前体积/mL | 滴定后体积/mL | |
| 第一次 | 0.33 | 20.32 |
| 第二次 | 1.25 | 23.26 |
| 第=.次 | 1.47 | 21.48 |
装置D中生成的硝酸为
(5)测定NO的体积。在测定NO的体积时,若E中量气管中水的液面比干燥管的液面高,直接读数会使测定的气体体积
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含 、
、 、
、 、
、 )生产CuCl的流程如图所示:
)生产CuCl的流程如图所示:
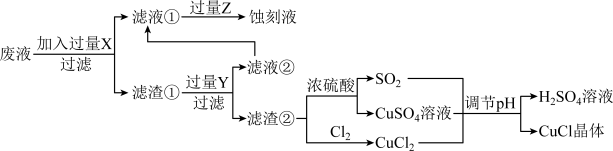
根据以上信息回答下列问题:
(1)生产过程中:X是______ 。(填化学式)
(2)写出生成CuCl的离子方程式______ 。
(3)析出的CuCl晶体不用水而用无水乙醇洗涤的原因是____ 。
(4)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是___________ 。
(5)CuCl的另一种制备原理是Cu2++Cu+2Cl-=2CuCl K=5.85×106,向0.01 mol∙L-1的CuCl2溶液中加入足量的铜,能否生成CuCl?(通过计算说明)_________ 。
(6)使用CuCl捕捉CO气体的反应为CuCl(s)+xCO(g) CuCl∙xCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有
CuCl∙xCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____ (填标号)。
A 降低温度 B 增大压强 C 延长反应时间 D 把CuCl分散到疏松多孔的分子筛中
(7)已知:CuCl Cu++Cl- K1; CuCl+Cl-
Cu++Cl- K1; CuCl+Cl- CuCl2- K2;则反应Cu++2Cl-
CuCl2- K2;则反应Cu++2Cl- CuCl2-的平衡常数K=
CuCl2-的平衡常数K=_______ (用K1、K2表示)。
 、
、 、
、 、
、 )生产CuCl的流程如图所示:
)生产CuCl的流程如图所示:
根据以上信息回答下列问题:
(1)生产过程中:X是
(2)写出生成CuCl的离子方程式
(3)析出的CuCl晶体不用水而用无水乙醇洗涤的原因是
(4)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是
(5)CuCl的另一种制备原理是Cu2++Cu+2Cl-=2CuCl K=5.85×106,向0.01 mol∙L-1的CuCl2溶液中加入足量的铜,能否生成CuCl?(通过计算说明)
(6)使用CuCl捕捉CO气体的反应为CuCl(s)+xCO(g)
 CuCl∙xCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有
CuCl∙xCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有A 降低温度 B 增大压强 C 延长反应时间 D 把CuCl分散到疏松多孔的分子筛中
(7)已知:CuCl
 Cu++Cl- K1; CuCl+Cl-
Cu++Cl- K1; CuCl+Cl- CuCl2- K2;则反应Cu++2Cl-
CuCl2- K2;则反应Cu++2Cl- CuCl2-的平衡常数K=
CuCl2-的平衡常数K=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学习探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
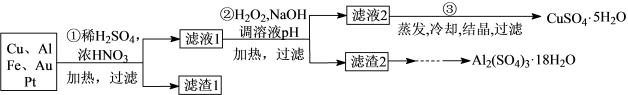
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_________ ;
得到滤渣I的主要成分为____________________ ;
(2)第②步加H2O2的作用是__________________ ;
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________ ;
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
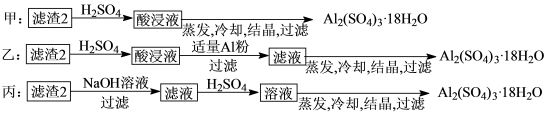
上述三种方案中,___ 方案不可行,原因是_____ ;从原子利用率角度考虑,___ 方案更合理。

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为
得到滤渣I的主要成分为
(2)第②步加H2O2的作用是
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
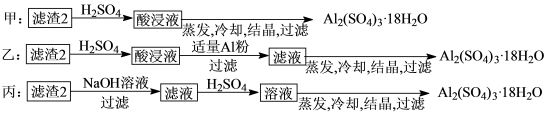
上述三种方案中,
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】观察下列实验装置图,试回答下列问题:
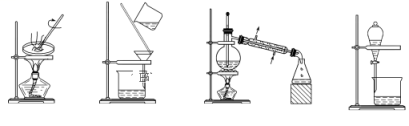
(1)图中③实验操作的名称是__________________ ;
(2)写出装置④中所用玻璃仪器的名称____________________ ,____________________ ;
(3)下列实验需要在哪套装置中进行(填序号):
a、从海水中提取蒸馏水:____________ ,
b、分离氯化钠和水:________________ ,
c、分离碳酸钙和水:________________ ,
d、分离植物油和水:________________ ;
(4)装置①中玻璃棒的作用是__________________________________ 。

① ② ③ ④
(1)图中③实验操作的名称是
(2)写出装置④中所用玻璃仪器的名称
(3)下列实验需要在哪套装置中进行(填序号):
a、从海水中提取蒸馏水:
b、分离氯化钠和水:
c、分离碳酸钙和水:
d、分离植物油和水:
(4)装置①中玻璃棒的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】为探索工业含铝、铁、铜合金废料的再利用,某同学设计的回收利用方案如图。

(1)合金预先粉碎的目的是____ ,步骤1的实验操作是____ ,合金中加入过量的NaOH溶液发生的离子反应方程式为____ 。
(2)实验室保存滤液D需加入少量的铁粉,其原因是____ (用离子方程式表示)。
(3)滤渣E转化为CuSO4溶液的过程中需加一种氧化剂,则试剂Y最好是____ 。
(4)若要从CuSO4溶液中得到胆矾晶体,还需要进行的实验操作步骤有;蒸发浓缩、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有____ 。
A.蒸发皿 B.烧杯 C.石棉网 D.玻璃棒 E.坩埚
(5)某研究性学习小组对所得的绿矾晶体(FeSO4•7H2O)热分解进行研究,将绿矾晶体装入图中的硬质玻璃管中,打开K1和K2,缓缓通入N2,加热。实验完毕后装置A中还残留红棕色固体。

①加热前缓缓通入N2的目的是____ 。
②C中品红溶液的作用是____ 。
③绿矾晶体分解还生成另一物质SO3,写出绿矾晶体受热分解的化学方程式____ 。

(1)合金预先粉碎的目的是
(2)实验室保存滤液D需加入少量的铁粉,其原因是
(3)滤渣E转化为CuSO4溶液的过程中需加一种氧化剂,则试剂Y最好是
| A.H2O2 | B.FeCl3 | C.HNO3 | D.KMnO4 |
A.蒸发皿 B.烧杯 C.石棉网 D.玻璃棒 E.坩埚
(5)某研究性学习小组对所得的绿矾晶体(FeSO4•7H2O)热分解进行研究,将绿矾晶体装入图中的硬质玻璃管中,打开K1和K2,缓缓通入N2,加热。实验完毕后装置A中还残留红棕色固体。

①加热前缓缓通入N2的目的是
②C中品红溶液的作用是
③绿矾晶体分解还生成另一物质SO3,写出绿矾晶体受热分解的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】乳酸亚铁固体 易溶于水,难溶于乙醇,常用于治疗缺铁性贫血,可由乳酸与
易溶于水,难溶于乙醇,常用于治疗缺铁性贫血,可由乳酸与 反应制得。
反应制得。
已知:乳酸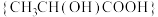 酸性强于碳酸,能被酸性高锰酸钾氧化。
酸性强于碳酸,能被酸性高锰酸钾氧化。
回答下列问题:
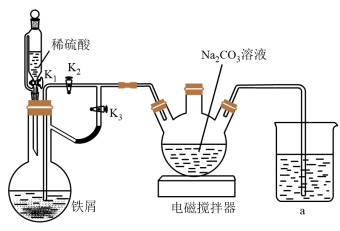
I.制备碳酸亚铁
①组装仪器,……
②先关闭 ,打开
,打开 、
、 。
。
③一段时间后,……
④抽滤,洗涤干燥。
(1)装置 可盛适量的水,其作用是
可盛适量的水,其作用是___________ 。
(2)用 溶液制备碳酸亚铁的离子方程式为
溶液制备碳酸亚铁的离子方程式为___________ 。
(3)补全操作步骤①组装仪器,___________ 。
(4)补全操作步骤③一段时间后,关闭活塞___________ ,打开活塞___________ 。
Ⅱ.制备乳酸亚铁晶体并测定纯度
(5)制备乳酸亚铁的化学方程式为___________ 。
(6)若用酸性 溶液测定乳酸亚铁样品中
溶液测定乳酸亚铁样品中 的量进而计算纯度时,发现结果总是大于100%,其原因是
的量进而计算纯度时,发现结果总是大于100%,其原因是___________ 。
 易溶于水,难溶于乙醇,常用于治疗缺铁性贫血,可由乳酸与
易溶于水,难溶于乙醇,常用于治疗缺铁性贫血,可由乳酸与 反应制得。
反应制得。已知:乳酸
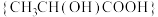 酸性强于碳酸,能被酸性高锰酸钾氧化。
酸性强于碳酸,能被酸性高锰酸钾氧化。回答下列问题:

I.制备碳酸亚铁
①组装仪器,……
②先关闭
 ,打开
,打开 、
、 。
。③一段时间后,……
④抽滤,洗涤干燥。
(1)装置
 可盛适量的水,其作用是
可盛适量的水,其作用是(2)用
 溶液制备碳酸亚铁的离子方程式为
溶液制备碳酸亚铁的离子方程式为(3)补全操作步骤①组装仪器,
(4)补全操作步骤③一段时间后,关闭活塞
Ⅱ.制备乳酸亚铁晶体并测定纯度
(5)制备乳酸亚铁的化学方程式为
(6)若用酸性
 溶液测定乳酸亚铁样品中
溶液测定乳酸亚铁样品中 的量进而计算纯度时,发现结果总是大于100%,其原因是
的量进而计算纯度时,发现结果总是大于100%,其原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的SiO2、Fe2O3杂质)生产铵明矾晶体NH4Al(SO4)2•12H2O,其工艺流程图如图:
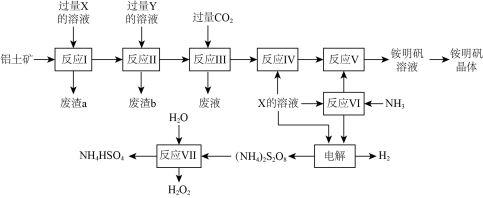
(1)废渣a、b的成分分别是___________ 、___________ (写名称)。
(2)流程图中X的化学式为___________ 。
(3)反应Ⅲ的离子方程式为___________ ;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)___________ 、冷却结晶、过滤、洗涤。
(4)反应Ⅶ的化学方程式为___________ ;NH4HSO4溶液中离子浓度由大到小顺序为___________ 。

(1)废渣a、b的成分分别是
(2)流程图中X的化学式为
(3)反应Ⅲ的离子方程式为
(4)反应Ⅶ的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
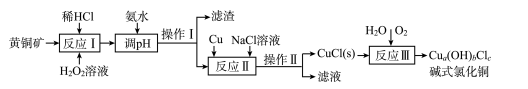
【推荐2】我国盛产黄铜矿(主要含CuFeS2及少量Fe2O3、SiO2),以黄铜矿为原料生产碱式氯化铜的工业流程如下。
已知:I.a、b、c均为整数
II.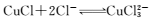
(1)CuFeS2中S的化合价为____ 。
(2)实验测得反应I中有SO42-生成,该反应中氧化剂与还原剂的物质的量之比为___ ;H2O2优于HNO3的原因是____ 。
(3)在调节pH时,为稳定浸出液的pH,需要用NH3·H2O- NH4Cl为缓冲溶液。已知 25℃时,向0. 02 mol/L的氨水中缓慢加入等浓度的NH4 Cl溶液,该过程中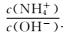
_____ (填“变大”、“变小”或“不变”);若最后所得溶液呈中性,则该体系中离子浓度的大小顺序是____ 。
(4)操作I和操作Ⅱ与生活中的下列操作____ 具有相似的化学原理。
A.用淘米筛沥水 B.泡茶 C.海水晒盐 D.用漏斗分装液体 E.煎药
(5)反应Ⅱ中NaCl浓度过大,碱式氯化铜产率较低,其原因是____ 。
(6)为测定制得的碱式氯化铜的组成,某实验小组进行下列实验:称取一定量的碱式氯化铜,用少量稀HNCl溶解后配成100. 00 mL溶液A;取25. 00 mL溶液A,加入足量AgNO。溶液,得到AgCl(M一143.5g/mol)固体1.435 g;另取25. 00 ml.溶液A,用浓度为0.40 mol/L的Na2H2Y标准溶液滴定Cu2+(Cu2++H2Y2-=CuY2-+2H+),终点时,消耗标液50. 00 mL。则该碱式氯化铜的化学式为____ ;反应Ⅲ的化学反应方程式为____________

已知:I.a、b、c均为整数
II.
(1)CuFeS2中S的化合价为
(2)实验测得反应I中有SO42-生成,该反应中氧化剂与还原剂的物质的量之比为
(3)在调节pH时,为稳定浸出液的pH,需要用NH3·H2O- NH4Cl为缓冲溶液。已知 25℃时,向0. 02 mol/L的氨水中缓慢加入等浓度的NH4 Cl溶液,该过程中
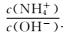
(4)操作I和操作Ⅱ与生活中的下列操作
A.用淘米筛沥水 B.泡茶 C.海水晒盐 D.用漏斗分装液体 E.煎药
(5)反应Ⅱ中NaCl浓度过大,碱式氯化铜产率较低,其原因是
(6)为测定制得的碱式氯化铜的组成,某实验小组进行下列实验:称取一定量的碱式氯化铜,用少量稀HNCl溶解后配成100. 00 mL溶液A;取25. 00 mL溶液A,加入足量AgNO。溶液,得到AgCl(M一143.5g/mol)固体1.435 g;另取25. 00 ml.溶液A,用浓度为0.40 mol/L的Na2H2Y标准溶液滴定Cu2+(Cu2++H2Y2-=CuY2-+2H+),终点时,消耗标液50. 00 mL。则该碱式氯化铜的化学式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产C1O2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③C1O2的制取。工艺流程如下图:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)粗食盐水中含有Ca2+、Mg2+、 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________________________ (填化学式)。
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成C1O2。反应Ⅲ的化学方程式为______________ 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知ClO2+I-+H+==I2+Cl-+H2O未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知: )
)
①准确量取10.00 mL ClO2溶液的玻璃仪器是__________________ 。
②上述步骤3中滴定终点的现象是__________________________ 。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果_________ (填“偏高”、“偏低”或“无影响”)
④根据上述步骤可计算出原C1O2溶液的浓度为_________ mol·L-1(用含字母的代数式表示)。

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)粗食盐水中含有Ca2+、Mg2+、
 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成C1O2。反应Ⅲ的化学方程式为
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知ClO2+I-+H+==I2+Cl-+H2O未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:
 )
)①准确量取10.00 mL ClO2溶液的玻璃仪器是
②上述步骤3中滴定终点的现象是
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果
④根据上述步骤可计算出原C1O2溶液的浓度为
您最近一年使用:0次



