肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=−32.9 kJ·mol−1;反应Ⅱ:N2H4(g)+H2(g)=2NH3(g) ΔH2=−41.8kJ·mol−1

下列说法不正确的是

下列说法不正确的是
| A.图所示过程①是放热反应 |
| B.反应Ⅱ的能量过程示意图如图所示 |
| C.断开3 molN2H4(g)的化学键吸收的能量大于形成1molN2(g)和4molNH3(g)的化学键释放的能量 |
| D.200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g) ΔH=+50.7 kJ·mol−1 |
2019·浙江杭州·一模 查看更多[13]
广西南宁沛鸿民族中学2023-2024学年高二上学期10月月考化学试题湖南省南雅中学2023-2024学年高二上学期第一次月考化学试题湖南省宁乡市四校联考2022-2023学年高二上学期10月月考化学试题福建省三明市第二中学2022-2023学年高二上学期开学适应性练习化学试题福建省宁化第一中学2021-2022学年高二上学期开学考试化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过综合 章末素养综合检测吉林省长春汽车经济技术开发区第六中学2019-2020学年高一下学期期末考试化学试题(已下线)第01章 化学反应与能量(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)(已下线)专题6.1 化学能与热能(练)——2020年高考化学一轮复习讲练测山东省临沂市罗庄区2019-2020学年高二上学期期末考试化学试题四川省成都外国语学校2019-2020学年高二上学期期中考试化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编【全国百强校】浙江省杭州市第二中学2019届高三第二学期选考模拟卷化学试题
更新时间:2019-04-13 17:44:11
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
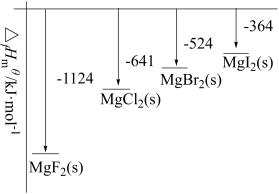
【推荐1】在标准状态下,将指定单质生成1mol物质的反应焓称为该化合物的生成焓,符号为 。由题图所给的数据可得,下列说法正确的是
。由题图所给的数据可得,下列说法正确的是
 。由题图所给的数据可得,下列说法正确的是
。由题图所给的数据可得,下列说法正确的是
| A.生成MgF2时放出热量最多,故化合时反应速率最快 |
B.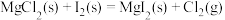 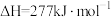 |
C.由图可知,断开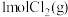 中的化学键所吸收的能量大于断开 中的化学键所吸收的能量大于断开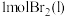 中的化学键所吸收的能量 中的化学键所吸收的能量 |
D.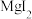 的热稳定性比 的热稳定性比 高 高 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】两种制备硫酸的途径(反应条件略)如图。下列说法正确的是


A.S和过量 反应可直接生成 反应可直接生成 |
B.含0.5 mol  的稀溶液与足量 的稀溶液与足量 溶液反应,放出的热量即为中和热 溶液反应,放出的热量即为中和热 |
C. 能使紫色石蕊试液先变红后褪色 能使紫色石蕊试液先变红后褪色 |
D.若 ,则 ,则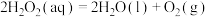 为放热反应 为放热反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列变化中释放能量的是
| A.1s22s22p63s1→1s22s22p6 | B.N≡N(g)→N(g)+N(g) |
C.2p 2p 2p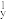 2p 2p →2p →2p 2p 2p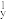 2p 2p | D.2H(g)→H-H(g) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】已知断裂1 mol H2(g)中的H—H键需吸收436 kJ能量,断裂1 mol O2中的共价键需吸收496 kJ能量,且氢气在氧气中燃烧的能量变化如图所示。下列说法正确的是


A.H2O(l)=H2(g)+ O2(g) ΔH=+242 kJ⋅mol-1 O2(g) ΔH=+242 kJ⋅mol-1 |
| B.2H2(g)+O2(g)=2H2O(l) ΔH<-484 kJ⋅mol-1 |
| C.形成1 mol H2O(g)中的化学键,需吸收926 kJ能量 |
| D.2H2(g)+O2(g)=2H2O(g) ΔH=-1852 kJ⋅mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】化学与生产、生活、科技紧密联系。下列说法正确的是
| A.金属材料砷化镓可用于制造太阳能电池 |
B.研发新型催化剂将 分解为C和 分解为C和 ,该过程为放热反应 ,该过程为放热反应 |
| C.“84”消毒液、加热均能有效杀灭病毒 |
| D.食盐可用作食品膨松剂 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】参照反应 的能量—反应历程的示意图,下列叙述中不正确的是
的能量—反应历程的示意图,下列叙述中不正确的是
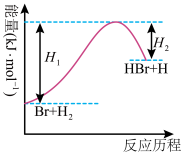
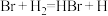 的能量—反应历程的示意图,下列叙述中不正确的是
的能量—反应历程的示意图,下列叙述中不正确的是
| A.升高温度可增大正反应速率,降低逆反应速率 |
| B.正反应为吸热反应 |
| C.加入催化剂,该化学反应的反应热不变 |
| D.反应物总能量低于生成物总能量 |
您最近一年使用:0次

 CO2(g)
CO2(g)
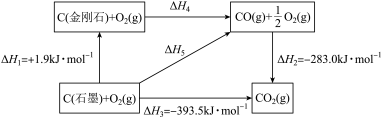

 (石墨,s)、
(石墨,s)、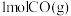 分别完全燃烧,石墨放出的热量多
分别完全燃烧,石墨放出的热量多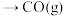 的过程是放热反应,不需要加热
的过程是放热反应,不需要加热 的
的