砷和镍是重要的材料和化工领域用途广泛。请回答下列问题:
(1)基态As原子中,价电子的电子云轮廓图形状为___ 。与砷同周期的主族元素的基态原子中,电负性最大的为____ (填元素符号)。
(2)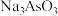 可用于碘的微量分析。
可用于碘的微量分析。
①Na+的焰色反应呈黄色,很多金属元素能产生焰色反应的微观原因为_______ 。
②其中阴离子的VSEPR模型为_____ ,与其互为等电子体的分子为_____ (只写一种分子式即可)。
(3)M(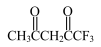 )可用于合成Ni2+的配体,M中C原子的杂化形式为
)可用于合成Ni2+的配体,M中C原子的杂化形式为______ ,σ键和π键的数目之比为_____ 。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为______ 。区分晶体Ni和非晶体Ni的最可靠的科学方法为_______ 。
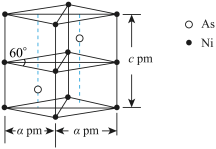
(5)某砷镍合金的晶胞如图所示,设阿伏加 德罗常数的值为 ,该晶体的密度ρ=
,该晶体的密度ρ=____ g·cm-3。
(1)基态As原子中,价电子的电子云轮廓图形状为
(2)
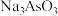 可用于碘的微量分析。
可用于碘的微量分析。①Na+的焰色反应呈黄色,很多金属元素能产生焰色反应的微观原因为
②其中阴离子的VSEPR模型为
(3)M(
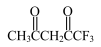 )可用于合成Ni2+的配体,M中C原子的杂化形式为
)可用于合成Ni2+的配体,M中C原子的杂化形式为(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为
(5)某砷镍合金的晶胞如图所示,设阿伏加 德罗常数的值为
 ,该晶体的密度ρ=
,该晶体的密度ρ=
更新时间:2019-06-03 19:20:49
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2—离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2。

请回答下列问题:
(1)A、B、C、D四种元素中,电负性最大的是___ (填元素符号)。
(2)B的氢化物的沸点远高于A的氢化物的主要原因是___ 。
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为____ 。
(4)E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有___ 。
(5)最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为___ ;该晶体的化学式为___ 。

请回答下列问题:
(1)A、B、C、D四种元素中,电负性最大的是
(2)B的氢化物的沸点远高于A的氢化物的主要原因是
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为
(4)E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有
(5)最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
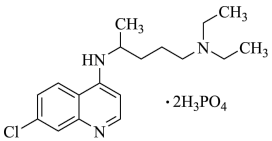
【推荐2】磷酸氯喹在细胞水平上能有效抑制新型冠状病毒( )的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
(1)基态P原子中,电子占据的最高能级符号为___________ 。
(2)磷酸氯喹中N原子的杂化方式为___________ , 沸点比
沸点比 的沸点高,其原因是
的沸点高,其原因是___________ 。
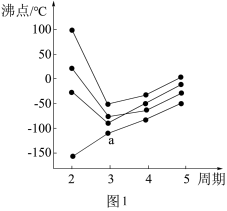
(3)如图1所示,每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________ (用化学式表示)。
(4) 在高温高压下所形成的晶体其晶胞如图2所示。则该晶体的类型属于
在高温高压下所形成的晶体其晶胞如图2所示。则该晶体的类型属于___________ 晶体。

(5)图3为 晶胞,
晶胞, 晶体中
晶体中 距离最近且相等的
距离最近且相等的 有
有___________ 个,若晶胞边长为 ,则该晶体的密度为
,则该晶体的密度为___________  。(用
。(用 表示阿伏加德罗常数)
表示阿伏加德罗常数)
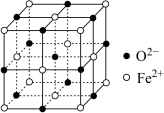
图3
 )的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
(1)基态P原子中,电子占据的最高能级符号为
(2)磷酸氯喹中N原子的杂化方式为
 沸点比
沸点比 的沸点高,其原因是
的沸点高,其原因是(3)如图1所示,每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

(4)
 在高温高压下所形成的晶体其晶胞如图2所示。则该晶体的类型属于
在高温高压下所形成的晶体其晶胞如图2所示。则该晶体的类型属于
(5)图3为
 晶胞,
晶胞, 晶体中
晶体中 距离最近且相等的
距离最近且相等的 有
有 ,则该晶体的密度为
,则该晶体的密度为 。(用
。(用 表示阿伏加德罗常数)
表示阿伏加德罗常数)
图3
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】W、Q、R、X、Y、Z六种元素的原子序数逐渐增大。已知W原子1s轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn。请回答下列问题:
(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是___________________ ,该分子中含有____ 个 键。
键。
(2)Z原子的核外电子排布式为__________ ;向Z的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中Z的离子与NH3之间的化学键为_________ 。
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于____ 晶体;W、Q、X三种元素之间可以形成多种化合物,其中邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,理由是______ 。邻甲基苯甲醛分子中碳原子轨道的杂化类型为___ 。1 mol 苯甲醛分子中σ键为__ mol。
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。

该晶体中阳离子和阴离子个数比为____ ,晶体中每个Xn-被 ____ 个等距离的C+离子包围。
(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是
 键。
键。(2)Z原子的核外电子排布式为
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。

该晶体中阳离子和阴离子个数比为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的电负性由小到大的顺序为_______ (用元素符号表示)。
(2)B单质的熔点比C单质熔点_______ ,B的氯化物的熔点比C的氯化物的熔点_______ (填高或低)。理由_______ 。
(3) 形成某种化合物的晶胞结构如图所示,该化合物的化学式为
形成某种化合物的晶胞结构如图所示,该化合物的化学式为_______ 。_______ 。
(1)A、B、C、D的电负性由小到大的顺序为
(2)B单质的熔点比C单质熔点
(3)
 形成某种化合物的晶胞结构如图所示,该化合物的化学式为
形成某种化合物的晶胞结构如图所示,该化合物的化学式为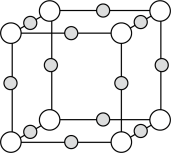
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物II。

(1)1mol化合物I含有___________ mol σ键。
(2)基态硫原子价层电子排布式为___________ 。
(3)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(4)汞的原子序数为80,位于元素周期表第___ 周期第IIB族。
(5)化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有___ 。
A.在I中S原子采取sp3杂化 B.在II中S元素的电负性最大
C.在III中C-C-C键角是180° D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。

①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是___________ 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为___________ ;该晶胞中粒子个数比Hg:Ge:Sb =___________ 。
③设X的最简式的式量为Mr,则X晶体的密度为_____ g/cm3(设NA为阿伏加德罗常数的值)。

(1)1mol化合物I含有
(2)基态硫原子价层电子排布式为
(3)H2S、CH4、H2O的沸点由高到低顺序为
(4)汞的原子序数为80,位于元素周期表第
(5)化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化 B.在II中S元素的电负性最大
C.在III中C-C-C键角是180° D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。

①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为
③设X的最简式的式量为Mr,则X晶体的密度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】有机化合物A可由葡萄糖发酵得到,在医药和食品领域中有广泛应用。研究有机化合物A的分子结构、性质如下:
(1)确定A的分子式:取9克样品A完全燃烧,仅得到CO2和水的质量分别为13.2g和5.4g。经元素分析得到化合物A的实验式,通过_______ 法(填仪器分析方法)可以测得A的相对分子质量为90,则A的分子式为_______ 。
(2)确定A的分子结构(已知: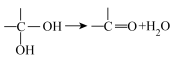 )。使用现代分析仪器对A的分子结构进行测定,结果如图:
)。使用现代分析仪器对A的分子结构进行测定,结果如图:
A中官能团名称为_______ 。
(3)研究A的结构和性质的关系。
①根据A的结构推测,有机化合物A不能发生的反应有_______ (填序号)。
A.取代反应 B.加聚反应 C.消去反应 D.酯化反应
②A通过反应②可以得到六元环状物B,B的结构简式为_______ 。
③已知:电离常数Ka(A)=1.38×10-4,Ka(丙酸)=1.38×10-5,分析数据可知A的酸性强于丙酸,请从电负性角度解释原因_______ 。
(4)A通过反应③得到的高聚物D可用作手术缝合线,能直接在人体内降解吸收。A发生缩聚反应的化学方程式是_______ 。

(1)确定A的分子式:取9克样品A完全燃烧,仅得到CO2和水的质量分别为13.2g和5.4g。经元素分析得到化合物A的实验式,通过
(2)确定A的分子结构(已知:
 )。使用现代分析仪器对A的分子结构进行测定,结果如图:
)。使用现代分析仪器对A的分子结构进行测定,结果如图:| 谱图 | |
| 红外光谱 | 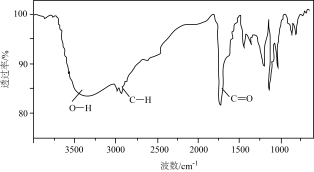 |
| 核磁共 振氢谱 |  |
(3)研究A的结构和性质的关系。
①根据A的结构推测,有机化合物A不能发生的反应有
A.取代反应 B.加聚反应 C.消去反应 D.酯化反应
②A通过反应②可以得到六元环状物B,B的结构简式为
③已知:电离常数Ka(A)=1.38×10-4,Ka(丙酸)=1.38×10-5,分析数据可知A的酸性强于丙酸,请从电负性角度解释原因
(4)A通过反应③得到的高聚物D可用作手术缝合线,能直接在人体内降解吸收。A发生缩聚反应的化学方程式是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用,其化合物也有着广泛的应用。
(1)基态B原子的价电子排布图为_____________________ ,其第一电离能比Be__________ (填“大”或“小”)。
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。配离子[BH4]-的中心原子的杂化方式为________ ,写出与其互为等电子体的一种阳离子和一种分子的化学式:_________________ 。
(3)三氯化硼的沸点为12.5℃,而氯化镁的沸点高于1200℃,原因是____________________________________ 。
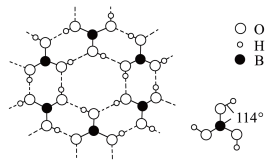
(4)硼酸晶体是片状结构,下图表示的是其中一层的结构。每一层内存在的作用力有______________ ;硼酸晶体在冷水中溶解度很小,但在热水中较大,原因是 _____________________________________________ 。
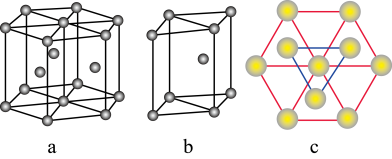
(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为__________________ ;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏加 德罗常数为NA,则镁的摩尔质量计算式为________________ 。
(1)基态B原子的价电子排布图为
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。配离子[BH4]-的中心原子的杂化方式为
(3)三氯化硼的沸点为12.5℃,而氯化镁的沸点高于1200℃,原因是

(4)硼酸晶体是片状结构,下图表示的是其中一层的结构。每一层内存在的作用力有

(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】中国海军航母建设正在有计划、有步骤向前推进。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为_______________________ .
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为______ 杂化,在有机物中C原子间可以形成双键,而硅烷中Si原子间难以形成双键的原因是_____________ .

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________ (填元素符号)
②根据价层电子对互斥理论,预测ClO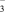 的空间构型为
的空间构型为___________ 形,写出一个ClO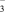 的等电子体的化学符号
的等电子体的化学符号___________ .
(4)海底金属软泥是在洋海底蕴藏着大量的资源,含有硅、铁、锰、锌等。某种磁性氮化铁的晶胞结构如图所示,该化合物的化学式为________________ ,若晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为________ g·cm−3(用含a、c和NA的式子表示)
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
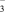 的空间构型为
的空间构型为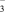 的等电子体的化学符号
的等电子体的化学符号(4)海底金属软泥是在洋海底蕴藏着大量的资源,含有硅、铁、锰、锌等。某种磁性氮化铁的晶胞结构如图所示,该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”与大环主体分子苯芳烃有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图1所示)可用于Ⅲ 族元素形成的阳离子萃取,如
族元素形成的阳离子萃取,如 、
、 。基态二价钪离子(
。基态二价钪离子( )核外电子排布式为
)核外电子排布式为___________ 。
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中氧原子的杂化类型为___________ ,羟基间较强的相互作用为___________ 。
(3)不同大小的杯芳烃能识别某些离子,如 等。根据等电子体原理,
等。根据等电子体原理, 的空间构型为
的空间构型为___________ 。
(4)已知 分子结构如图2所示,
分子结构如图2所示, 晶胞示意图如图3所示(小黑点代表
晶胞示意图如图3所示(小黑点代表 分子)。
分子)。
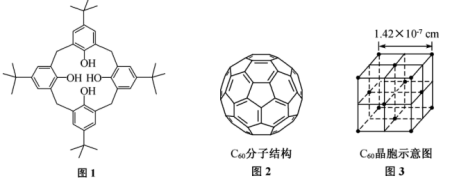
一个 分子中含有
分子中含有 键个数为
键个数为___________ ,与每个 分子距离最近且相等的
分子距离最近且相等的 分子有
分子有___________ 个, 晶体的密度为
晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
(1)对叔丁基杯[4]芳烃(如图1所示)可用于Ⅲ
 族元素形成的阳离子萃取,如
族元素形成的阳离子萃取,如 、
、 。基态二价钪离子(
。基态二价钪离子( )核外电子排布式为
)核外电子排布式为(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中氧原子的杂化类型为
(3)不同大小的杯芳烃能识别某些离子,如
 等。根据等电子体原理,
等。根据等电子体原理, 的空间构型为
的空间构型为(4)已知
 分子结构如图2所示,
分子结构如图2所示, 晶胞示意图如图3所示(小黑点代表
晶胞示意图如图3所示(小黑点代表 分子)。
分子)。
一个
 分子中含有
分子中含有 键个数为
键个数为 分子距离最近且相等的
分子距离最近且相等的 分子有
分子有 晶体的密度为
晶体的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】氮族元素N、P、As等元素在农药、化肥等领域有广泛应用。回答下列问题:
(1)基态磷原子中,电子占据的最高能层符号为___________ 。
(2)基态As原子的核外电子排布式为___________ 。
(3)氮元素的简单气态氢化物为 ,其沸点比
,其沸点比 的
的___________ (填“高”或“低”),理由是___________ 。
(4)氮元素的常见含氧酸根为NO ,其空间构型为
,其空间构型为___________ ,其中N的杂化方式为___________ 。NO 和
和 可形成配离子
可形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为___________ (用元素符号表示),1mol该配离子中含有的 键数目为
键数目为___________ NA。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的晶胞结构如图所示。

①A、B点的原子坐标如图所示,则C点的原子坐标为___________ 。
②磷化铝的晶胞参数 (1pm=10-12m),其密度为
(1pm=10-12m),其密度为___________ g/cm3(列出计算式即可,NA表示阿伏加德罗常数的值)。
(1)基态磷原子中,电子占据的最高能层符号为
(2)基态As原子的核外电子排布式为
(3)氮元素的简单气态氢化物为
 ,其沸点比
,其沸点比 的
的(4)氮元素的常见含氧酸根为NO
 ,其空间构型为
,其空间构型为 和
和 可形成配离子
可形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为 键数目为
键数目为(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的晶胞结构如图所示。

①A、B点的原子坐标如图所示,则C点的原子坐标为
②磷化铝的晶胞参数
 (1pm=10-12m),其密度为
(1pm=10-12m),其密度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】 是新能源汽车动力电池的重要原材料,当前有多种提锂工艺能从盐湖卤水(主要含
是新能源汽车动力电池的重要原材料,当前有多种提锂工艺能从盐湖卤水(主要含 、
、 、
、 、
、 、
、 、
、 )中提纯分离锂元素。
)中提纯分离锂元素。
已知:当一个反应的K大于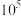 时,可以认为该反应进行完全
时,可以认为该反应进行完全
Ⅰ.沉淀法提锂
(1)向盐湖卤水中加入磷酸盐,然后用NaOH溶液调节pH,可以分步得到 、
、 、
、 、
、 沉淀。
沉淀。
①调节pH过程中, 将转化为
将转化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
②实验过程中若要使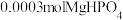 转化完全,溶液的pH至少要调节至
转化完全,溶液的pH至少要调节至___________ 。(设溶液的体积为1L)。
Ⅱ.吸附法提锂
锂锰氧化合物离子筛是一种常用的提取锂离子的无机材料,提锂机理分为氧化还原吸附及离子交换吸附。
(2)氧化还原吸附
①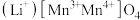 是一种提锂效果非常优异的无机材料,其晶胞结构如图所示,其中“●”表示元素
是一种提锂效果非常优异的无机材料,其晶胞结构如图所示,其中“●”表示元素___________ (填元素符号)

②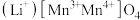 吸附锂的机理分两步进行:
吸附锂的机理分两步进行:
第一步酸性条件下脱锂,获得(□)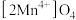 ,“□”是晶体中的空位,反应如下:
,“□”是晶体中的空位,反应如下: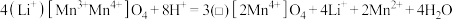
第二步取出(口)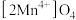 并洗净后投入碱性含锂溶液中,吸附
并洗净后投入碱性含锂溶液中,吸附 后恢复为
后恢复为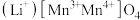 并有气体放出,请书写第二步反应的离子方程式
并有气体放出,请书写第二步反应的离子方程式___________ 。
③该吸附剂的另一优点是选择性高,吸附 而几乎不能吸附溶液中的
而几乎不能吸附溶液中的 、
、 ,其可能的原因是
,其可能的原因是___________ 。
(3)离子交换吸附
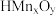 是离子交换吸附材料,其吸附交换原理为
是离子交换吸附材料,其吸附交换原理为 ,用等量的
,用等量的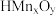 吸附相同体积溶液中的
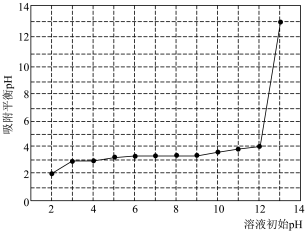
吸附相同体积溶液中的 ,溶液起始的pH与吸附平衡后的pH关系如图所示,要使该材料能吸附溶液中的
,溶液起始的pH与吸附平衡后的pH关系如图所示,要使该材料能吸附溶液中的 ,控制溶液起始pH必须大于
,控制溶液起始pH必须大于___________ 。请确定溶液起始吸附最佳的pH并说明理由___________ 。
 是新能源汽车动力电池的重要原材料,当前有多种提锂工艺能从盐湖卤水(主要含
是新能源汽车动力电池的重要原材料,当前有多种提锂工艺能从盐湖卤水(主要含 、
、 、
、 、
、 、
、 、
、 )中提纯分离锂元素。
)中提纯分离锂元素。已知:当一个反应的K大于
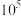 时,可以认为该反应进行完全
时,可以认为该反应进行完全Ⅰ.沉淀法提锂
(1)向盐湖卤水中加入磷酸盐,然后用NaOH溶液调节pH,可以分步得到
 、
、 、
、 、
、 沉淀。
沉淀。①调节pH过程中,
 将转化为
将转化为 ,该反应的离子方程式为
,该反应的离子方程式为②实验过程中若要使
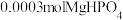 转化完全,溶液的pH至少要调节至
转化完全,溶液的pH至少要调节至Ⅱ.吸附法提锂
锂锰氧化合物离子筛是一种常用的提取锂离子的无机材料,提锂机理分为氧化还原吸附及离子交换吸附。
(2)氧化还原吸附
①
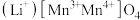 是一种提锂效果非常优异的无机材料,其晶胞结构如图所示,其中“●”表示元素
是一种提锂效果非常优异的无机材料,其晶胞结构如图所示,其中“●”表示元素
②
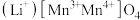 吸附锂的机理分两步进行:
吸附锂的机理分两步进行:第一步酸性条件下脱锂,获得(□)
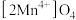 ,“□”是晶体中的空位,反应如下:
,“□”是晶体中的空位,反应如下: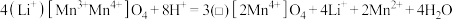
第二步取出(口)
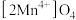 并洗净后投入碱性含锂溶液中,吸附
并洗净后投入碱性含锂溶液中,吸附 后恢复为
后恢复为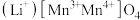 并有气体放出,请书写第二步反应的离子方程式
并有气体放出,请书写第二步反应的离子方程式③该吸附剂的另一优点是选择性高,吸附
 而几乎不能吸附溶液中的
而几乎不能吸附溶液中的 、
、 ,其可能的原因是
,其可能的原因是(3)离子交换吸附
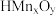 是离子交换吸附材料,其吸附交换原理为
是离子交换吸附材料,其吸附交换原理为 ,用等量的
,用等量的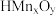 吸附相同体积溶液中的
吸附相同体积溶液中的 ,溶液起始的pH与吸附平衡后的pH关系如图所示,要使该材料能吸附溶液中的
,溶液起始的pH与吸附平衡后的pH关系如图所示,要使该材料能吸附溶液中的 ,控制溶液起始pH必须大于
,控制溶液起始pH必须大于
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铁、钴(Co)属于第四周期第VIII族元素,含铁、钴化合物具有诸多用途。回答下列问题:
(1)基态Co原子价层电子的电子排布图(轨道表达式)为________________ 。
(2)Co的配合物[Co(NH3)5Cl]SO4是一种重要的化合物。
①SO42-的空间立体构型为___________ ,其中S原子的杂化轨道类型是___________ ,写出一种与SO42-互为等电子体的分子的化学式:______________ 。
②[Co(NH3)5Cl]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_______________ 。
③[Co(NH3)5Cl]SO4中,存在___________ (填字母)
a.离子键 b.金属键 c.配位键 d.非极性键 e.极性键
(3)铁氰化钾{K3 [Fe(CN)6]}溶液是检验Fe2+常用的试剂。
①1mol [Fe(CN)6]3-含 键的数目为
键的数目为__________ 。
②CN-能与多种离子形成配合物,碳原子提供孤电子对,而不是氮原子,其原因是____________ 。
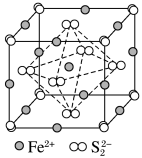
③FeS2晶体的晶胞如图所示。晶胞边长为a nm、FeS2相对分子质量为M,阿伏伽德罗常数的值为NA,其晶体密度的计算表达式为______ g•cm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为_________ nm。
(1)基态Co原子价层电子的电子排布图(轨道表达式)为
(2)Co的配合物[Co(NH3)5Cl]SO4是一种重要的化合物。
①SO42-的空间立体构型为
②[Co(NH3)5Cl]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为
③[Co(NH3)5Cl]SO4中,存在
a.离子键 b.金属键 c.配位键 d.非极性键 e.极性键
(3)铁氰化钾{K3 [Fe(CN)6]}溶液是检验Fe2+常用的试剂。
①1mol [Fe(CN)6]3-含
 键的数目为
键的数目为②CN-能与多种离子形成配合物,碳原子提供孤电子对,而不是氮原子,其原因是
③FeS2晶体的晶胞如图所示。晶胞边长为a nm、FeS2相对分子质量为M,阿伏伽德罗常数的值为NA,其晶体密度的计算表达式为

您最近一年使用:0次



