某工厂化验室为测定某黄铁矿(主要成分是FeS2)的纯度,取1.00 g矿石样品(所含杂质不挥发且不与氧气反应),在氧气流中充分灼烧,完全反应后,冷却,称量固体残留物,质量为0.75g。
(1)该黄铁矿中FeS2的质量分数为多少?
(2)该工厂用这种黄铁矿制硫酸,在FeS2燃烧过程中损失2%,由SO2氧化成SO3时,SO2的利用率为80%,吸收塔中SO3完全吸收。若煅烧10 .0t上述黄铁矿,则可制得98%的硫酸多少吨?
(1)该黄铁矿中FeS2的质量分数为多少?
(2)该工厂用这种黄铁矿制硫酸,在FeS2燃烧过程中损失2%,由SO2氧化成SO3时,SO2的利用率为80%,吸收塔中SO3完全吸收。若煅烧10 .0t上述黄铁矿,则可制得98%的硫酸多少吨?
11-12高一上·浙江宁波·期中 查看更多[1]
(已下线)2011-2012学年浙江省余姚中学高一上学期期中化学(理)试卷(化学实验班)
更新时间:2011-11-28 05:43:26
|
相似题推荐
计算题
|
适中
(0.65)
名校
【推荐1】(1)FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1﹕1﹕1时,实际参加反应的FeS与HNO3的物质的量之比为____________ 。
(2)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为____________ mol。
(3)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是___________ mL。
(4)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:

Co(OH)3溶解还原反应的离子方程式为_______________________________ ,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为______________ 。
(2)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为
(3)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
(4)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:

Co(OH)3溶解还原反应的离子方程式为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。

(1)两个方案中,符合当前生产中绿色化学理念的是方案___________ 。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为________________ 。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a g的晶体进行脱水实验,获得无水固体为(a-1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00 mol·L-1的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。通过计算测知该晶体的化学式是_____________________ 。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3= 2 CuCl ↓+ 3 Na2SO4 + CO2↑,测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:Fe 3++CuCl=Fe 2++Cu2++Cl-,Ce4++ Fe 2+= Fe 3++ Ce3+
计算上述样品中CuCl的质量分数。(写出计算过程)_____________________

(1)两个方案中,符合当前生产中绿色化学理念的是方案
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a g的晶体进行脱水实验,获得无水固体为(a-1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00 mol·L-1的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。通过计算测知该晶体的化学式是
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3= 2 CuCl ↓+ 3 Na2SO4 + CO2↑,测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:Fe 3++CuCl=Fe 2++Cu2++Cl-,Ce4++ Fe 2+= Fe 3++ Ce3+
计算上述样品中CuCl的质量分数。(写出计算过程)
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】金属钛用途广泛。从海水中提取Mg和 ,并联合用以钛铁矿(主要含
,并联合用以钛铁矿(主要含 和
和 、
、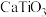 、
、 等杂质)为原料冶炼钛单质,其主要工艺流程如下:
等杂质)为原料冶炼钛单质,其主要工艺流程如下: 的形式存在于溶液中,
的形式存在于溶液中, 易水解为偏钛酸
易水解为偏钛酸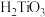 ,
,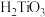 可写作
可写作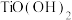 。
。
(1)试剂①通常选煅烧的贝壳粉而不用 的原因是
的原因是_____ 。
(2)试剂②为_____ 。
(3)“沉降分离”出的滤渣成分有_____ 。
(4)已知绿矾的溶解度随温度变化的曲线如图所示,从溶液Ⅰ获得绿矾的操作方法为_____ 、_____ ,过滤、洗涤、干燥。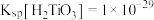 ,若要让
,若要让 水解完全(离子浓度小于
水解完全(离子浓度小于 ),应控制
),应控制 不低于
不低于_____ 。
(6)反应①除生成 外还生成一种可燃性气体,该反应的化学方程式为
外还生成一种可燃性气体,该反应的化学方程式为_____ ,“高温氯化”反应理论计算结果显示,在200℃条件下达到平衡时, 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于200℃,其原因是
,但实际生产中反应温度却远高于200℃,其原因是_____ (写一种)。
(7)该工艺流程中可以循环使用的物质有_____ 。
 ,并联合用以钛铁矿(主要含
,并联合用以钛铁矿(主要含 和
和 、
、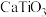 、
、 等杂质)为原料冶炼钛单质,其主要工艺流程如下:
等杂质)为原料冶炼钛单质,其主要工艺流程如下: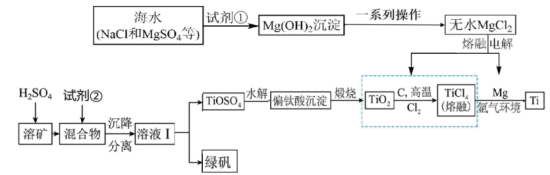
 的形式存在于溶液中,
的形式存在于溶液中, 易水解为偏钛酸
易水解为偏钛酸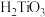 ,
,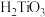 可写作
可写作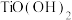 。
。(1)试剂①通常选煅烧的贝壳粉而不用
 的原因是
的原因是(2)试剂②为
(3)“沉降分离”出的滤渣成分有
(4)已知绿矾的溶解度随温度变化的曲线如图所示,从溶液Ⅰ获得绿矾的操作方法为
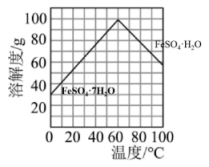
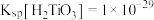 ,若要让
,若要让 水解完全(离子浓度小于
水解完全(离子浓度小于 ),应控制
),应控制 不低于
不低于(6)反应①除生成
 外还生成一种可燃性气体,该反应的化学方程式为
外还生成一种可燃性气体,该反应的化学方程式为 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于200℃,其原因是
,但实际生产中反应温度却远高于200℃,其原因是(7)该工艺流程中可以循环使用的物质有
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】水有硬水和软水之分,水的硬度主要由Ca2+和Mg2+引起。水的硬度的表示方法是:将水中的Ca2+和Mg2+都看作是Ca2+,然后将其质量折算成CaO的质量。通常把1升水中含有10毫克CaO称为1度。水中的Ca2+和Mg2+可用一定浓度的Y溶液进行滴定,Y跟Ca2+和Mg2+都以等物质的量完全反应。
(1)现取某地区的地下水样品25.0毫升,用0.0100mol·L-1Y溶液滴定,完全反应时消耗Y溶液25.0毫升。该地下水的硬度为___________ 度。
(2)如果每次分析时取该水样都是25.0毫升,为了便于计算,要求每消耗1.00毫升Y溶液即相当于水的硬度为1度。则Y溶液的物质的量的浓度为___________ mol·L-1(同时请写出计算过程)
(1)现取某地区的地下水样品25.0毫升,用0.0100mol·L-1Y溶液滴定,完全反应时消耗Y溶液25.0毫升。该地下水的硬度为
(2)如果每次分析时取该水样都是25.0毫升,为了便于计算,要求每消耗1.00毫升Y溶液即相当于水的硬度为1度。则Y溶液的物质的量的浓度为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】计算
(1)15.6g Na2X中含有0.4mol Na+,则X的相对原子质量为_______ 。
(2)标准状况下,44.8L氯气通入足量NaOH溶液中,转移的电子数目为_______ 。
(3)标准状况下,甲烷和一氧化碳的混合气体共8.96 L,其质量为7.6 g,则混合气体中甲烷的物质的量为_______ 。
(4)测定Na2CO3样品(含氯化钠杂质)中Na2CO3的质量分数:称取m g样品放入烧杯内加水溶解,加入过量的氯化钙溶液充分反应,过滤、洗涤、干燥,称量沉淀的质量为n g。则样品中Na2CO3的质量分数为_______ 。
(1)15.6g Na2X中含有0.4mol Na+,则X的相对原子质量为
(2)标准状况下,44.8L氯气通入足量NaOH溶液中,转移的电子数目为
(3)标准状况下,甲烷和一氧化碳的混合气体共8.96 L,其质量为7.6 g,则混合气体中甲烷的物质的量为
(4)测定Na2CO3样品(含氯化钠杂质)中Na2CO3的质量分数:称取m g样品放入烧杯内加水溶解,加入过量的氯化钙溶液充分反应,过滤、洗涤、干燥,称量沉淀的质量为n g。则样品中Na2CO3的质量分数为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】白玉的化学式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、Si、H的氧化物表示)。
(1)取8.l0g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为______ 。
(2)另取4.05g白玉粉末加入l mol/L的盐酸l00mL中充分溶解,最终得不溶氧化物2. 40g.过滤,将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(标准状况下).则
①p=_________ ;
②白玉的化学式(用氧化物的形式)表示为________ 。
(1)取8.l0g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为
(2)另取4.05g白玉粉末加入l mol/L的盐酸l00mL中充分溶解,最终得不溶氧化物2. 40g.过滤,将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(标准状况下).则
①p=
②白玉的化学式(用氧化物的形式)表示为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐1】NaClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某污水中含CN-a mg/L,现用NaClO2将CN-氧化,只生成两种无毒气体.写出该反应的离子方程式_________ 。处理100m3这种污水,至少需要NaClO2 ______ mol。
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】现代炼锌的方法可分为火法和湿法两大类。火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100℃~1300℃,使锌蒸馏出来(设空气中N2、O2的体积分数分别为0.80、0.20),主要反应为:焙烧炉中:2ZnS(s)+3O2(g) →2ZnO(s)+2SO2(g)①,鼓风炉中:2C(s)+O2(g) →2CO②,鼓风炉中: ZnO(s)+CO(g)  Zn(g)+CO2(g)③。
Zn(g)+CO2(g)③。
(1)已知闪锌矿中含硫的质量分数为16.0%,而所含杂质不含硫,则闪锌矿中硫化锌的质量分数为__ 。现代工业生产多采用联合生产,可将闪锌矿中的硫用于生产硫酸。现有此闪锌矿100 t,在理论上可生产出98.0%的硫酸___ t。
(2)焙烧炉产生的炉气中SO2的体积分数不超过__ %(保留小数点后一位小数,下同)。
(3)鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
则鼓风炉中CO总的转化率为___ ;若生产中CO总的利用率为95.0%,列式计算每生产1molZn,至少需要补充焦炭多少克___ ?
(4)若ZnS全部转化为Zn,焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,试列式计算每生产1mol Zn,应向焙烧炉和鼓风炉中鼓入新鲜空气共多少升(S.T.P)____ ?
 Zn(g)+CO2(g)③。
Zn(g)+CO2(g)③。(1)已知闪锌矿中含硫的质量分数为16.0%,而所含杂质不含硫,则闪锌矿中硫化锌的质量分数为
(2)焙烧炉产生的炉气中SO2的体积分数不超过
(3)鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
| 时间/min | CO | Zn | CO2 |
| 0 | 0.11 | 0 | 0 |
| 2 | 0.10 | 0.01 | 0.01 |
| 3 | 0.01 | 0.10 | 0.10 |
| 4 | 0.01 | 0.10 | 0.10 |
(4)若ZnS全部转化为Zn,焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,试列式计算每生产1mol Zn,应向焙烧炉和鼓风炉中鼓入新鲜空气共多少升(S.T.P)
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】某兴趣小组同学取用80.00 g的MgCl2溶液(含镁元素质量分数为15.00%),将其小心蒸干得49.25 g固体(其成分表示为Mgx(OH)yClz•nH2O),为研究其组成进行了如下两实验:
实验一:将所得固体全部溶于100 mL 1.50 mol·L-1的硝酸中,再加水稀释至500 mL,测得溶液的c(H+)=0.1mol·L-1;
实验二:取实验一稀释后的溶液50 mL向其中加入足量的AgNO3溶液得沉淀12.915 g。
①对于上述两个实验的安排,说法正确的是 ;(填字母序号)
A.均要做,否则无法计算 B.均不要做,数据已经足够 C.只要做实验一即可
②试通过计算确定固体的化学式。(要求有计算过程)
实验一:将所得固体全部溶于100 mL 1.50 mol·L-1的硝酸中,再加水稀释至500 mL,测得溶液的c(H+)=0.1mol·L-1;
实验二:取实验一稀释后的溶液50 mL向其中加入足量的AgNO3溶液得沉淀12.915 g。
①对于上述两个实验的安排,说法正确的是 ;(填字母序号)
A.均要做,否则无法计算 B.均不要做,数据已经足够 C.只要做实验一即可
②试通过计算确定固体的化学式。(要求有计算过程)
您最近一年使用:0次



