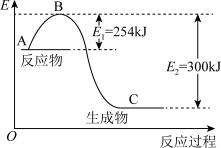
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1molSO3(g)的ΔH=-99kJ·mol-1。请回答下列问题:
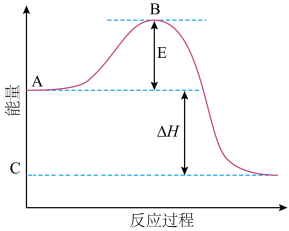
(1)图中A、C分别表示____ ,___ ,E的大小对该反应的反应热__ (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点___ (填“升高”或“降低”),ΔH___ (填“变大”“变小”或“不变”)。
(2)图中ΔH=____ kJ·mol-1。
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)与适量H2(g)反应,生成NH3(g),放出92.2kJ热量:_____ 。
②1molCu(s)与适量O2(g)反应,生成CuO(s),放出157kJ热量:_____ 。
③在25℃、101kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是_____ 。

(1)图中A、C分别表示
(2)图中ΔH=
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)与适量H2(g)反应,生成NH3(g),放出92.2kJ热量:
②1molCu(s)与适量O2(g)反应,生成CuO(s),放出157kJ热量:
③在25℃、101kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是
更新时间:2019-10-09 12:29:07
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】2NO(g)+O2(g) 2NO2(g)的反应历程由两步基元反应组成,相关信息如下(E为活化能,v为反应速率,k为速率常数):
2NO2(g)的反应历程由两步基元反应组成,相关信息如下(E为活化能,v为反应速率,k为速率常数):
2NO(g)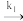 N2O2(g) E1=82kJ/mol v=k1c2(NO)
N2O2(g) E1=82kJ/mol v=k1c2(NO)
N2O2(g)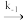 2NO(g) E-1=205kJ/mol v=k-1c(N2O2)
2NO(g) E-1=205kJ/mol v=k-1c(N2O2)
N2O2(g)+O2(g) 2NO2(g) E2=82kJ/mol v=k2c(N2O2)·c(O2)
2NO2(g) E2=82kJ/mol v=k2c(N2O2)·c(O2)
2NO2(g)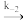 N2O2(g)+O2(g) E-2=72kJ/mol v=k-2c2(NO2)
N2O2(g)+O2(g) E-2=72kJ/mol v=k-2c2(NO2)
则2NO(g) N2O2(g) △H1=
N2O2(g) △H1=______ kJ·mol-1,其平衡常数K与上述速率常数k1、k-1的关系式为K=______ 。2NO(g)+O2(g) 2NO2(g) △H=
2NO2(g) △H=______ kJ·mol-1.
 2NO2(g)的反应历程由两步基元反应组成,相关信息如下(E为活化能,v为反应速率,k为速率常数):
2NO2(g)的反应历程由两步基元反应组成,相关信息如下(E为活化能,v为反应速率,k为速率常数):2NO(g)
 N2O2(g) E1=82kJ/mol v=k1c2(NO)
N2O2(g) E1=82kJ/mol v=k1c2(NO)N2O2(g)
 2NO(g) E-1=205kJ/mol v=k-1c(N2O2)
2NO(g) E-1=205kJ/mol v=k-1c(N2O2)N2O2(g)+O2(g)
 2NO2(g) E2=82kJ/mol v=k2c(N2O2)·c(O2)
2NO2(g) E2=82kJ/mol v=k2c(N2O2)·c(O2)2NO2(g)
 N2O2(g)+O2(g) E-2=72kJ/mol v=k-2c2(NO2)
N2O2(g)+O2(g) E-2=72kJ/mol v=k-2c2(NO2)则2NO(g)
 N2O2(g) △H1=
N2O2(g) △H1= 2NO2(g) △H=
2NO2(g) △H=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______ 。
(2)若已知下列数据:
试根据表中及图中数据计算N—H的键能:___ kJ·mol-1。
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
请回答下列问题:
ΔH3与ΔH1、ΔH2之间的关系是ΔH3=___ 。
(4)试比较下列两组△H的大小(填“>”、“<”或“=”)
①H2(g)+ O2(g)=H2O(g) △H1 H2(g)+
O2(g)=H2O(g) △H1 H2(g)+ O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
则△H1____ △H2
②S(s)+O2(g)=SO2(g) △H3
Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g) △H4
则△H3______ △H4
(1)如图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:

(2)若已知下列数据:
| 化学键 | H—H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
请回答下列问题:
ΔH3与ΔH1、ΔH2之间的关系是ΔH3=
(4)试比较下列两组△H的大小(填“>”、“<”或“=”)
①H2(g)+
 O2(g)=H2O(g) △H1 H2(g)+
O2(g)=H2O(g) △H1 H2(g)+ O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2则△H1
②S(s)+O2(g)=SO2(g) △H3
Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g) △H4
则△H3
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】I.按要求完成下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_______ △H2(填“>”“<”或“=”)。
(2)有机物M经过太阳光光照可转化成N,转化过程如下:
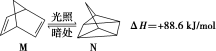
则M、N相比,较稳定的是_______ 。
(3)已知N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
则N2H4(g)与NO2(g)完全反应生成N2(g)和H2O(g)的热化学方程式为_______ 。
II.利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(4)从实验装置上看,图中尚缺少的一种玻璃仪器是_______ 。
(5)倒入NaOH溶液的正确操作是_______ (从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)实验数据如表:
近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=_______ (取小数点后一位)。
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1
(2)有机物M经过太阳光光照可转化成N,转化过程如下:

则M、N相比,较稳定的是
(3)已知N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
则N2H4(g)与NO2(g)完全反应生成N2(g)和H2O(g)的热化学方程式为
II.利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(4)从实验装置上看,图中尚缺少的一种玻璃仪器是
(5)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)实验数据如表:
| 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 |
近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。
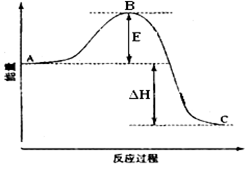
已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:
(1)图中E的大小对该反应的反应热________ (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点___________ (填“升高”还是“降低”)。
(2)完成SO2氧化为SO3的热化学方程式______________________________________ 。

已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:
(1)图中E的大小对该反应的反应热
(2)完成SO2氧化为SO3的热化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某学生为探究锌与盐酸反应过程中的速率变化,在 时,向100 mL 2 mol·L-1盐酸中加入过量的锌粉,测得氢气体积(已换算成标准状况)累计值如下:
时,向100 mL 2 mol·L-1盐酸中加入过量的锌粉,测得氢气体积(已换算成标准状况)累计值如下:
(1)①在2~3 min时间段内,用盐酸的浓度变化表示的反应速率为_______ .
②在0~5min内,反应速率最大的时间段是___ (填 “1~2 min”、“2~3 min”或“3~4 min”)。
(2)若完全反应后放出15.2 kJ的热量,则反应Zn(s) + 2HCl(aq)=ZnCl2(aq) + H2(g)的△H=____
(3)为了减缓反应速率但不减少产生气体的量,可向反应物中分别加入等体积的下列液体,你认为可行的是_______ (填字母)。
a. 蒸馏水 b. Na2CO3溶液 c. NaNO3溶液
(4)为了加快反应速率但不减少产生气体的量,某同学向反应物中加入了少量CuSO4固体,该同学操作____ (填 “合理”或“不合理”),理由是_______
 时,向100 mL 2 mol·L-1盐酸中加入过量的锌粉,测得氢气体积(已换算成标准状况)累计值如下:
时,向100 mL 2 mol·L-1盐酸中加入过量的锌粉,测得氢气体积(已换算成标准状况)累计值如下:| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
②在0~5min内,反应速率最大的时间段是
(2)若完全反应后放出15.2 kJ的热量,则反应Zn(s) + 2HCl(aq)=ZnCl2(aq) + H2(g)的△H=
(3)为了减缓反应速率但不减少产生气体的量,可向反应物中分别加入等体积的下列液体,你认为可行的是
a. 蒸馏水 b. Na2CO3溶液 c. NaNO3溶液
(4)为了加快反应速率但不减少产生气体的量,某同学向反应物中加入了少量CuSO4固体,该同学操作
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)=H2O2(l)的ΔH__ 0(填“>”、“<”或“=”)。
(2)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s)ΔH<0达到化学平衡。下列有关叙述正确的是
MHx+2y(s)ΔH<0达到化学平衡。下列有关叙述正确的是___ 。
a.容器内气体压强保持不变
b.吸收ymolH2只需1molMHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(1)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)=H2O2(l)的ΔH
(2)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)
 MHx+2y(s)ΔH<0达到化学平衡。下列有关叙述正确的是
MHx+2y(s)ΔH<0达到化学平衡。下列有关叙述正确的是a.容器内气体压强保持不变
b.吸收ymolH2只需1molMHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】按要求回答下列问题:
(1)已知:1gH2完全燃烧生成液态水的热量为142.9kJ,请写出氢气燃烧热 的热化学方程式_______ 。
(2)H2CO3的电离方程式是_______ 。
(3)硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应的化学方程式是_______ 。
(4)FeCl3水解的离子方程式是_______ 。
(5)写出NaHCO3溶液中的物料守恒式_______ 。
(6)写出氢氧燃料电池(电解质为碱性溶液)的正极电极方程式是_______ 。
(1)已知:1gH2完全燃烧生成液态水的热量为142.9kJ,请写出氢气
(2)H2CO3的电离方程式是
(3)硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应的化学方程式是
(4)FeCl3水解的离子方程式是
(5)写出NaHCO3溶液中的物料守恒式
(6)写出氢氧燃料电池(电解质为碱性溶液)的正极电极方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
②C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
③C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.5kJ/mol
请回答:
(1)上述反应中属于放热反应的是_____ (填序号,下同),属于吸热反应的是_______ 。
(2)2gH2完全燃烧生成液态水,放出的热量为_______ 。
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)与适量O2(g)反应生成NO(g),需吸收68kJ的热量,该反应的热化学方程式为_____ 。
②在25℃、101kpa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_______ 。
①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
②C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
③C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.5kJ/mol
请回答:
(1)上述反应中属于放热反应的是
(2)2gH2完全燃烧生成液态水,放出的热量为
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)与适量O2(g)反应生成NO(g),需吸收68kJ的热量,该反应的热化学方程式为
②在25℃、101kpa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】现在和将来的社会,对能源和材料的需求是越来越大,我们学习化学就为了认识物质,创造物质,开发新能源,发展人类的新未来。请回答以下问题:
(1)理想的新能源应具有资源丰富、可以再生、对环境无污染等特点,下列属于理想的新能源的是________ 。
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
(2)已知:CO的燃烧热为283kJ/mol,则表示CO燃烧热的热化学方程式为:________ 。
(3)已知反应CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+198kJ•mol-1,在298K时断开(形成)1mol化学键要吸收(放出)的能量数据为:
则根据反应热的计算,x=________ 。
(4)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用Rh做催化剂时该反应的过程示意图如图:
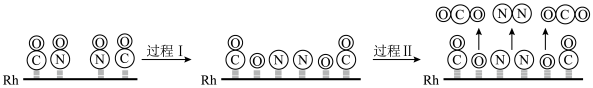
①过程I为过程_______ (填“吸热”或“放热”。过程II生成的化学键有________ (填“极性键”、“非极性键”或“极性键”和“非极性键”)。
②已知过程I的焓变为akJ/mol,过程II的焓变为bkJ/mol,则该反应的热化学方程式为________ 。
(5)火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=2NO2(g) △H1=+66.4kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H2=-534kJ•mol-1
请写出N2H4(l)与NO2反应的热化学方程式________ 。
(1)理想的新能源应具有资源丰富、可以再生、对环境无污染等特点,下列属于理想的新能源的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
(2)已知:CO的燃烧热为283kJ/mol,则表示CO燃烧热的热化学方程式为:
(3)已知反应CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+198kJ•mol-1,在298K时断开(形成)1mol化学键要吸收(放出)的能量数据为:
| 化学键 | H-H | O-H | C-H | C≡O |
| E/(kJ•mol-1) | 436 | x | 413 | 1076 |
(4)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用Rh做催化剂时该反应的过程示意图如图:

①过程I为过程
②已知过程I的焓变为akJ/mol,过程II的焓变为bkJ/mol,则该反应的热化学方程式为
(5)火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=2NO2(g) △H1=+66.4kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H2=-534kJ•mol-1
请写出N2H4(l)与NO2反应的热化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
I.将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
(1)能使化学反应速率加快的措施有________ (填序号)。
①升高反应温度②增加C的物质的量③密闭定容容器中充入CO(g)
II.工业上用CO生产燃料甲醇,一定条件下发生反应CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。

(2)图1是表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=__________________ ;
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。请结合图象解释催化剂加快化学反应速率的原因_______________________________ ,该反应消耗1molCO时,______ (填“放出”或“吸收”)__________ KJ热量。
I.将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g)
 CO(g)+H2(g)
CO(g)+H2(g)(1)能使化学反应速率加快的措施有
①升高反应温度②增加C的物质的量③密闭定容容器中充入CO(g)
II.工业上用CO生产燃料甲醇,一定条件下发生反应CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。
(2)图1是表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。请结合图象解释催化剂加快化学反应速率的原因
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】一定条件下,A与B反应可生成C和D,其能量变化如图:
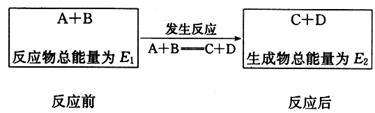
(1)下列有关反应A+B C+D的说法正确的是
C+D的说法正确的是_______ (填字母)。
(2)若E1<E2,则反应热ΔH_______ 0(填“>”“<”或“=”)。

(1)下列有关反应A+B
 C+D的说法正确的是
C+D的说法正确的是| A.反应前后原子的种类和数目一定不变 |
| B.该反应若有热量变化,则一定是氧化还原反应 |
| C.若该反应为放热反应,则不需要加热反应就一定能自发进行 |
| D.反应物的总质量及总能量与生成物的总质量、总能量均相等 |
(2)若E1<E2,则反应热ΔH
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】为了研究 反应的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降,乙处液面上升。试回答下列问题:
反应的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降,乙处液面上升。试回答下列问题:
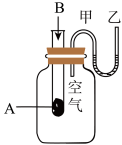
(1)物质通过进行化学反应将_______ 转化成_______ 释放出来。
(2)A和B的总能量比C和D的总能量_______ (填“高”或“低”)。
(3)该反应为_______ (填“放热”或“吸热”)反应。
(4)反应物化学键断裂吸收的能量_______ (填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:_______ 。
 反应的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降,乙处液面上升。试回答下列问题:
反应的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降,乙处液面上升。试回答下列问题:
(1)物质通过进行化学反应将
(2)A和B的总能量比C和D的总能量
(3)该反应为
(4)反应物化学键断裂吸收的能量
(5)写出一个符合题中条件的化学方程式:
您最近一年使用:0次



