高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
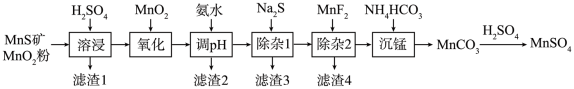
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________ 。

相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
更新时间:2019-09-07 21:27:57
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:
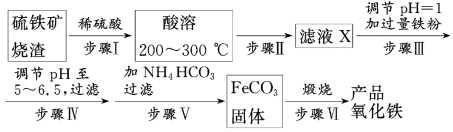
试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为________ (填化学式)。
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有________ ;步骤Ⅳ中应选用________ 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 B.氢氧化钠溶液
C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是___________________________ 。
(4)步骤Ⅴ的反应温度一般需控制在35 ℃以下,其目的是___________________________ 。
(5)步骤Ⅵ中发生反应的化学方程式为______________________________ 。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取a g样品,充分“酸溶”“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体b g。
①写出加入足量的H2O2发生反应的离子方程式:
________________________________________________________________________ ;
②测得该样品中Fe元素的质量分数为____________ 。

试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有
A.稀硝酸 B.氢氧化钠溶液
C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是
(4)步骤Ⅴ的反应温度一般需控制在35 ℃以下,其目的是
(5)步骤Ⅵ中发生反应的化学方程式为
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取a g样品,充分“酸溶”“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体b g。
①写出加入足量的H2O2发生反应的离子方程式:
②测得该样品中Fe元素的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在.
(1)33As与P位为同一主族,磷的原子结构示意图为________ ,砷在周期表中的位置______________ .
(2)根据元素周期律,下列说法正确的是(填字母序号)______________ .
a.酸性:H2SO4>H3PO4>H3AsO4b.原子半径:S>P>As
c.非金属性:S>P>Asd.还原性:AsH3>PH3>H2S
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成 ,导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为________________________________________ .
(4)去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:
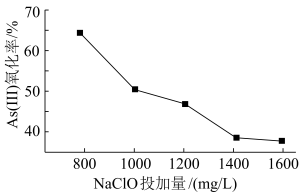
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是____________________________ .
(5)强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的.
已知:一定条件下,As(Ⅴ)的存在形式如下表所示:
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是__________________________________________ .
(1)33As与P位为同一主族,磷的原子结构示意图为
(2)根据元素周期律,下列说法正确的是(填字母序号)
a.酸性:H2SO4>H3PO4>H3AsO4b.原子半径:S>P>As
c.非金属性:S>P>Asd.还原性:AsH3>PH3>H2S
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成
 ,导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为(4)去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:

已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是
(5)强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的.
已知:一定条件下,As(Ⅴ)的存在形式如下表所示:
| pH | <2 | 2~7 | 7~11 | 11~14 |
| 存在形式 | H3AsO4 |  |  |  、 、 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4。其反应的离子方程式:Fe(OH)3+ClO-+OH-→FeO42-+H2O+Cl-(未配平)。配平上述离子方程式,用单线桥法标出电子转移方向和数目。___
___Fe(OH)3+___ClO-+___OH-→___FeO42-+___H2O+___Cl-
该反应中,还原剂是___ ,被还原的元素是___ 。
(2)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)+Q。
2Fe(s)+3CO2(g)+Q。
已知该反应在不同温度下的平衡常数如表。
该反应的平衡常数表达式为___ ,Q__ 0(填“>”、“<”或“=”)。
(3)在容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡,该时间范围内反应的平均反应速率v(CO2)=___ ,CO的平衡转化率为____ 。
(4)欲提高CO的平衡转化率,可采取的措施是___ 。
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
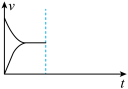
(5)现在恒压密闭容器中通入1molH2和1molCO2发生反应:CO(g)+H2O(g) CO2(g)+H2(g)+41kJ。当反应达到平衡后,在其他条件不变时,再通入1molH2和1molCO2的混合气体,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
CO2(g)+H2(g)+41kJ。当反应达到平衡后,在其他条件不变时,再通入1molH2和1molCO2的混合气体,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。___
(1)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4。其反应的离子方程式:Fe(OH)3+ClO-+OH-→FeO42-+H2O+Cl-(未配平)。配平上述离子方程式,用单线桥法标出电子转移方向和数目。
___Fe(OH)3+___ClO-+___OH-→___FeO42-+___H2O+___Cl-
该反应中,还原剂是
(2)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)+Q。
2Fe(s)+3CO2(g)+Q。已知该反应在不同温度下的平衡常数如表。
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
该反应的平衡常数表达式为
(3)在容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡,该时间范围内反应的平均反应速率v(CO2)=
(4)欲提高CO的平衡转化率,可采取的措施是
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
(5)现在恒压密闭容器中通入1molH2和1molCO2发生反应:CO(g)+H2O(g)
 CO2(g)+H2(g)+41kJ。当反应达到平衡后,在其他条件不变时,再通入1molH2和1molCO2的混合气体,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
CO2(g)+H2(g)+41kJ。当反应达到平衡后,在其他条件不变时,再通入1molH2和1molCO2的混合气体,请在图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】从低品位铜镍矿(含有Fe2O3、FeO、MgO、CuO等杂质)资源中提取镍和铜的一种工艺流程如下:
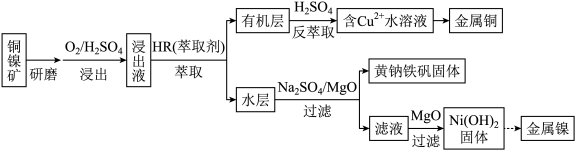
(1)上述流程中,加快反应速率的措施是_______ 。
(2)萃取时发生反应:Cu2+ + 2HR CuR2 + 2H+(HR、CuR2在有机层,Cu2+、H+等在水层)。解释反萃取时H2SO4的作用:
CuR2 + 2H+(HR、CuR2在有机层,Cu2+、H+等在水层)。解释反萃取时H2SO4的作用:_______ 。
(3)黄钠铁矾[NaFe3(OH)6(SO4)2]比Fe(OH)3更易形成沉淀。反应终点pH与Fe3+、Ni2+沉淀率的关系如下表。
① 生成黄钠铁矾的离子方程式是_______ 。
② 沉淀Fe3+时最适宜选用的反应终点pH是_______ 。
(4)第二次使用MgO调节pH使Ni2+沉淀完全,宜将pH调节至_______ (填序号)(已知Ksp[Ni(OH)2 ] = 2.1×10-15)。
a.6~7 b.9~10 c.11~12

(1)上述流程中,加快反应速率的措施是
(2)萃取时发生反应:Cu2+ + 2HR
 CuR2 + 2H+(HR、CuR2在有机层,Cu2+、H+等在水层)。解释反萃取时H2SO4的作用:
CuR2 + 2H+(HR、CuR2在有机层,Cu2+、H+等在水层)。解释反萃取时H2SO4的作用:(3)黄钠铁矾[NaFe3(OH)6(SO4)2]比Fe(OH)3更易形成沉淀。反应终点pH与Fe3+、Ni2+沉淀率的关系如下表。
| 反应终点pH | 沉淀率/% | |
| Fe3+ | Ni2+ | |
| 1.5 | 94.04 | 0.19 |
| 2.5 | 99.21 | 0.56 |
| 3.8 | 99.91 | 3.31 |
② 沉淀Fe3+时最适宜选用的反应终点pH是
(4)第二次使用MgO调节pH使Ni2+沉淀完全,宜将pH调节至
a.6~7 b.9~10 c.11~12
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】铜在自然界中常以多种形态存在,现以孔雀石矿石[成分为Cu2(OH)2CO3、CuFeS2、SiO2、Fe2O3等]为原料生产主产品胆矾和副产品铁红的工艺流程如图:
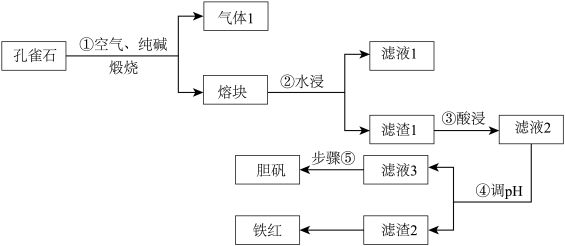
(1)气体1的成分除H2O(g)外,还有_______________ ,步骤①中发生氧化还原反应的化学方程式为 ___________________________________________________ ,滤液1的主要成分的用途之一为________________________________________ 。
(2)目前工业生产中步骤③酸浸的百分率为70%,为进一步提高酸浸的百分率可采取的措施有__________ (答出两点)。
(3)步骤④调pH所用试剂为_____________ 。
(4)室温下滤液3的pH=4,Ksp[Fe(OH) 3]=4×10-38,则滤液3中c(Fe3+)=____________ 。
(5)步骤⑤操作为___________________________________________________________ .。
(6)假设使用孔雀石质量为m kg,步骤③酸浸的百分率为70%,经滤渣2所得铁红的质量为n kg,则孔雀石矿石中铁元素的含量为______________________ 。

(1)气体1的成分除H2O(g)外,还有
(2)目前工业生产中步骤③酸浸的百分率为70%,为进一步提高酸浸的百分率可采取的措施有
(3)步骤④调pH所用试剂为
(4)室温下滤液3的pH=4,Ksp[Fe(OH) 3]=4×10-38,则滤液3中c(Fe3+)=
(5)步骤⑤操作为
(6)假设使用孔雀石质量为m kg,步骤③酸浸的百分率为70%,经滤渣2所得铁红的质量为n kg,则孔雀石矿石中铁元素的含量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】某硫化锌精矿的主要成分为 (还含一定量
(还含一定量 ),以其为原料制备七水合硫酸锌(
),以其为原料制备七水合硫酸锌( )与铁红的工艺流程如图所示:
)与铁红的工艺流程如图所示:

已知:①焙砂的成分是ZnO和FeO
②相关金属离子形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)“焙烧”中ZnS发生反应的化学方程式为___________ 。“净化制酸”所得的产品可用于后续的___________ 操作。
(2)“浸出”后加入 发生反应的离子方程式为
发生反应的离子方程式为___________ ,调pH的范围是___________ 。
(3)“滤渣”的化学式是___________ ,由“滤液”得到 的操作是蒸发浓缩、
的操作是蒸发浓缩、___________ 、过滤洗涤。
(4)用以上流程制备的七水合硫酸锌样品配制 溶液,需用托盘天平称取样品
溶液,需用托盘天平称取样品___________ g,溶解操作后须用到的玻璃仪器有玻璃棒、胶头滴管、___________ 。
 (还含一定量
(还含一定量 ),以其为原料制备七水合硫酸锌(
),以其为原料制备七水合硫酸锌( )与铁红的工艺流程如图所示:
)与铁红的工艺流程如图所示:
已知:①焙砂的成分是ZnO和FeO
②相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 |  |  |  |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 |
(1)“焙烧”中ZnS发生反应的化学方程式为
(2)“浸出”后加入
 发生反应的离子方程式为
发生反应的离子方程式为(3)“滤渣”的化学式是
 的操作是蒸发浓缩、
的操作是蒸发浓缩、(4)用以上流程制备的七水合硫酸锌样品配制
 溶液,需用托盘天平称取样品
溶液,需用托盘天平称取样品
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】同学们用如下实验探究 、
、 的性质。请回答下列问题:
的性质。请回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L 的溶液。在
的溶液。在 溶液中需加入少量铁屑,其目的是
溶液中需加入少量铁屑,其目的是_______ 。
(2)甲同学取2 mL 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为_______ 。
(3)乙同学认为甲同学的实验不够严谨,该同学在2 mL 溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是
溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是_______ 。
(4)丙同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 溶液混合,加入1 mL淀粉溶液,溶液变蓝色,发生反应的离子方程式为
溶液混合,加入1 mL淀粉溶液,溶液变蓝色,发生反应的离子方程式为_______ 。
(5)丁同学向盛有 溶液的试管中加入几滴酸化的
溶液的试管中加入几滴酸化的 溶液,溶液变成棕黄色,发生反应的离子方程式为
溶液,溶液变成棕黄色,发生反应的离子方程式为_______ 。
(6) 溶液中加入NaOH溶液得到
溶液中加入NaOH溶液得到 沉淀,写出产物
沉淀,写出产物 被
被 氧化时发生的化学反应方程式
氧化时发生的化学反应方程式_______ ,语言叙述其产物在整个过程中颜色的变化过程_______ 。
 、
、 的性质。请回答下列问题:
的性质。请回答下列问题:(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L
 的溶液。在
的溶液。在 溶液中需加入少量铁屑,其目的是
溶液中需加入少量铁屑,其目的是(2)甲同学取2 mL
 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为(3)乙同学认为甲同学的实验不够严谨,该同学在2 mL
 溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是
溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是(4)丙同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1
 溶液混合,加入1 mL淀粉溶液,溶液变蓝色,发生反应的离子方程式为
溶液混合,加入1 mL淀粉溶液,溶液变蓝色,发生反应的离子方程式为(5)丁同学向盛有
 溶液的试管中加入几滴酸化的
溶液的试管中加入几滴酸化的 溶液,溶液变成棕黄色,发生反应的离子方程式为
溶液,溶液变成棕黄色,发生反应的离子方程式为(6)
 溶液中加入NaOH溶液得到
溶液中加入NaOH溶液得到 沉淀,写出产物
沉淀,写出产物 被
被 氧化时发生的化学反应方程式
氧化时发生的化学反应方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某研究人员按图所示流程进行“燃煤烟气的脱硫研究”。实验中, 和
和 混合气体连续通入,水和铁在起始时一次性加入。
混合气体连续通入,水和铁在起始时一次性加入。
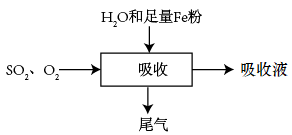
(1)吸收时,温度不宜过高的原因是___________ 。
(2)实验中,对吸收液的pH进行跟踪检测,测得pH随时间的变化曲线如下图所示(A点为纯水的pH)。(已知: 对
对 和
和 混合气体的吸收有催化作用)
混合气体的吸收有催化作用)
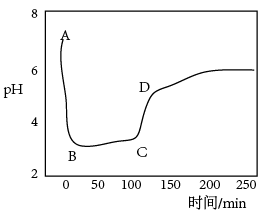
①AB段,pH下降的主要原因是___________ 。
②CD段,吸收液的pH迅速增大的原因可能是___________ 。
(3)利用反应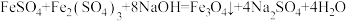 可以制备
可以制备 晶体。请补充完整以
晶体。请补充完整以 溶液为原料制备
溶液为原料制备 的实验方案:取40mL 1
的实验方案:取40mL 1
 溶液,
溶液,___________ ,静置、过滤、洗涤、干燥。(实验中须选用的试剂:稀硫酸、双氧水、1 NaOH溶液、1
NaOH溶液、1
 溶液)
溶液)
(4)通过下列方法测定产品纯度:准确称取0.2400g (含少量
(含少量 ,无其他杂质)样品,加过量稀硫酸完全溶解,再加入Zn粉至溶液黄色褪去,向溶液中逐滴加入0.1000
,无其他杂质)样品,加过量稀硫酸完全溶解,再加入Zn粉至溶液黄色褪去,向溶液中逐滴加入0.1000
 溶液,发生反应
溶液,发生反应 ,当反应恰好完全进行时,消耗
,当反应恰好完全进行时,消耗 溶液31.00mL。计算样品中
溶液31.00mL。计算样品中 的质量分数
的质量分数___________ (写出计算过程)。
 和
和 混合气体连续通入,水和铁在起始时一次性加入。
混合气体连续通入,水和铁在起始时一次性加入。
(1)吸收时,温度不宜过高的原因是
(2)实验中,对吸收液的pH进行跟踪检测,测得pH随时间的变化曲线如下图所示(A点为纯水的pH)。(已知:
 对
对 和
和 混合气体的吸收有催化作用)
混合气体的吸收有催化作用)
①AB段,pH下降的主要原因是
②CD段,吸收液的pH迅速增大的原因可能是
(3)利用反应
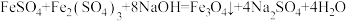 可以制备
可以制备 晶体。请补充完整以
晶体。请补充完整以 溶液为原料制备
溶液为原料制备 的实验方案:取40mL 1
的实验方案:取40mL 1
 溶液,
溶液, NaOH溶液、1
NaOH溶液、1
 溶液)
溶液)(4)通过下列方法测定产品纯度:准确称取0.2400g
 (含少量
(含少量 ,无其他杂质)样品,加过量稀硫酸完全溶解,再加入Zn粉至溶液黄色褪去,向溶液中逐滴加入0.1000
,无其他杂质)样品,加过量稀硫酸完全溶解,再加入Zn粉至溶液黄色褪去,向溶液中逐滴加入0.1000
 溶液,发生反应
溶液,发生反应 ,当反应恰好完全进行时,消耗
,当反应恰好完全进行时,消耗 溶液31.00mL。计算样品中
溶液31.00mL。计算样品中 的质量分数
的质量分数
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】锌是第四“常见”的金属,仅次于铁、铝及铜,在现代工业中对于电池的制造有不可磨灭的贡献,下列是以硫化锌精矿为原料制备单质锌的工业流程。
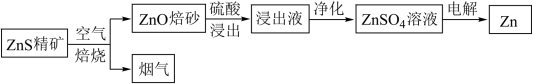
Ⅰ.(1)浸出液以硫酸锌为主,还含有 Fe3+、Fe2+、A13+、Cl-等杂质,会影响锌的电解,必须除去。净化过程如下:
①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,离子方程式为___ 。
②将浸出液的pH调节为5.5左右,使 Fe3+、A13+形成沉淀而除去,可选用的最佳试剂为___ (填字母)
A.NaOH B.NH3·H2O C.Zn(OH)2 D.H2SO4
③用Ag2SO4可除去Cl-,发生反应的离子方程式为______ 。
④电解过程中析出锌的电极反应式为___ 。
Ⅱ.烟气中的SO2可与软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的悬浊液反应制备MnSO4·H2O。
(2)已知:Ksp[Al(OH)3] =1×10-33,Ksp[Fe(OH)3] =3×10-39,pH =7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(欲使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为___ 。
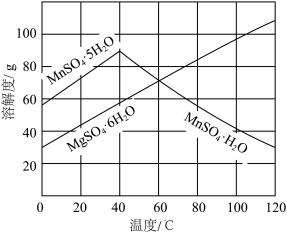
(3)由图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为___ 。
(4)锌锰碱性电池的总反应式为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,正极反应式为:_____ 。

Ⅰ.(1)浸出液以硫酸锌为主,还含有 Fe3+、Fe2+、A13+、Cl-等杂质,会影响锌的电解,必须除去。净化过程如下:
①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,离子方程式为
②将浸出液的pH调节为5.5左右,使 Fe3+、A13+形成沉淀而除去,可选用的最佳试剂为
A.NaOH B.NH3·H2O C.Zn(OH)2 D.H2SO4
③用Ag2SO4可除去Cl-,发生反应的离子方程式为
④电解过程中析出锌的电极反应式为
Ⅱ.烟气中的SO2可与软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的悬浊液反应制备MnSO4·H2O。
(2)已知:Ksp[Al(OH)3] =1×10-33,Ksp[Fe(OH)3] =3×10-39,pH =7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(欲使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为
(3)由图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为

(4)锌锰碱性电池的总反应式为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,正极反应式为:
您最近一年使用:0次



