I。草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生反应:
【实验1】甲同学用8.00 mL 0.001 mol/L KMnO4溶液与5.00 mL 0.01 mol/L H2C2O4溶液反应,研究不同条件对化学反应速率的影响。改变的条件如下:
(1)写出草酸(H2C2O4)与高锰酸钾溶液在酸性条件下反应的离子方程式________ 。
(2)上述进行实验Ⅰ、Ⅲ的目的是探究__________ 对化学反应速率的影响。
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
(3)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是_______ 的影响。
(4)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是____ (填字母)。
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
Ⅱ.用如图所示的装置进行中和热的测定实验,分别取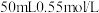 的
的 溶液、
溶液、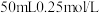 的硫酸进行实验,回答下列问题:
的硫酸进行实验,回答下列问题:
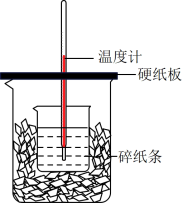
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________ ,除此之外,装置中的一个明显错误是__________ 。
(2)近似认为 的NaOH溶液和
的NaOH溶液和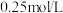 的硫酸溶液的密度都是
的硫酸溶液的密度都是 ,中和后生成溶液的比热容
,中和后生成溶液的比热容 ,通过以下数据计算中和热△H=
,通过以下数据计算中和热△H=__________ (结果保留小数点后一位)。
(3)上述实验数值结果与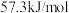 有偏差,产生偏差的原因可能是(填字母)
有偏差,产生偏差的原因可能是(填字母)_____ 。
a.实验装置保温、隔热效果差
b.用温度计测定 溶液起始温度后直接测定H2SO4溶液的温度
溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把 溶液倒入盛有硫酸的小烧杯中
溶液倒入盛有硫酸的小烧杯中
d.将以上四实验测量温度均纳入计算平均值
【实验1】甲同学用8.00 mL 0.001 mol/L KMnO4溶液与5.00 mL 0.01 mol/L H2C2O4溶液反应,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | KMnO4溶液 /mL | H2C2O4溶液 /mL | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL蒸馏水 |
(2)上述进行实验Ⅰ、Ⅲ的目的是探究
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
(3)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是
(4)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
Ⅱ.用如图所示的装置进行中和热的测定实验,分别取
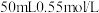 的
的 溶液、
溶液、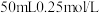 的硫酸进行实验,回答下列问题:
的硫酸进行实验,回答下列问题:
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是
(2)近似认为
 的NaOH溶液和
的NaOH溶液和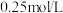 的硫酸溶液的密度都是
的硫酸溶液的密度都是 ,中和后生成溶液的比热容
,中和后生成溶液的比热容 ,通过以下数据计算中和热△H=
,通过以下数据计算中和热△H=| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 |
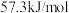 有偏差,产生偏差的原因可能是(填字母)
有偏差,产生偏差的原因可能是(填字母)a.实验装置保温、隔热效果差
b.用温度计测定
 溶液起始温度后直接测定H2SO4溶液的温度
溶液起始温度后直接测定H2SO4溶液的温度c.分多次把
 溶液倒入盛有硫酸的小烧杯中
溶液倒入盛有硫酸的小烧杯中d.将以上四实验测量温度均纳入计算平均值
更新时间:2019-10-30 15:04:27
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】用50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:_______ (填仪器名称),图中是否有不妥之处,如果有请指出:_______ (如果没有,此空不填)。
(2)大烧杯上如不盖硬纸板,求得的中和热ΔH将_______ (填“偏大”“偏小”或“无影响”)。
(3)如果用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热_______ (填“相等”或“不相等”),简述理由:_______ 。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将_______ (填“偏大”、“偏小”或“无影响”)。
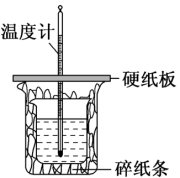
(2)大烧杯上如不盖硬纸板,求得的中和热ΔH将
(3)如果用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某学生用0.10 mol·L-1标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
(1)盐酸的物质的量浓度为_____ 。
(2)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是_____ (填“偏高”或“偏低”或“无影响”)。
(3)下列有关实验的说法正确的是______ 。
A.在测定中和反应的反应热实验中,至少要读两次温度
B.可用pH试纸测定新制氯水中的pH
C.中和滴定实验中,洗净后的锥形瓶不需要干燥
D.向CH3COONa溶液中滴入石蕊试液,溶液变蓝
E.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS)
(4)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比9∶11混合,则混合液的pH=_________ 。
| 实验序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.54 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.36 |
(2)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是
(3)下列有关实验的说法正确的是
A.在测定中和反应的反应热实验中,至少要读两次温度
B.可用pH试纸测定新制氯水中的pH
C.中和滴定实验中,洗净后的锥形瓶不需要干燥
D.向CH3COONa溶液中滴入石蕊试液,溶液变蓝
E.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS)
(4)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比9∶11混合,则混合液的pH=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
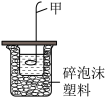
【推荐3】某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。
Ⅰ.实验步骤
①量取50 mL0.25 mol/LH2SO4溶液,倒入小烧杯中,测量温度;
②量取50 mL0.55 mol/LNaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,测量混合液的最高温度。
Ⅱ.实验数据如下:
请回答下列问题:
(1)仪器甲的名称为_______ ,进行该实验还缺少的仪器为_______ (填仪器名称)。仪器甲不能用铁制材料的原因是_______ 。
(2)已知在稀溶液中,强酸和强碱发生中和反应生成 时,放出57.3kJ热量,该反应的热化学方程式为
时,放出57.3kJ热量,该反应的热化学方程式为_______ 。
(3)碎泡沫塑料的作用为_______ ,使用的NaOH溶液稍微过量的原因是_______ 。
(4)设实验所用的酸、碱溶液的密度均为1 g/mL,且酸、碱溶液和中和后的溶液的比热容c=4.18 J/(g∙℃)。计算实验测出的中和反应的反应热△H =_______ kJ/mol。[提示: ]
]
(5)若用相同浓度的氨水代替NaOH溶液,则会导致测得的△H_______ (填“偏高”或“偏低”,下同);若用0.28 mol/LBa(OH)2溶液代替NaOH溶液,则会导致测得的△H _______ 。

Ⅰ.实验步骤
①量取50 mL0.25 mol/LH2SO4溶液,倒入小烧杯中,测量温度;
②量取50 mL0.55 mol/LNaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,测量混合液的最高温度。
Ⅱ.实验数据如下:
| 实验序号 | 起始温度T1/℃ | 终止温度T2/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | ||
| 1 | 25.0 | 25.2 | 28.5 | |
| 2 | 24.9 | 25.1 | 28.4 | |
| 3 | 25.5 | 26.5 | 31.8 | |
(1)仪器甲的名称为
(2)已知在稀溶液中,强酸和强碱发生中和反应生成
 时,放出57.3kJ热量,该反应的热化学方程式为
时,放出57.3kJ热量,该反应的热化学方程式为(3)碎泡沫塑料的作用为
(4)设实验所用的酸、碱溶液的密度均为1 g/mL,且酸、碱溶液和中和后的溶液的比热容c=4.18 J/(g∙℃)。计算实验测出的中和反应的反应热△H =
 ]
](5)若用相同浓度的氨水代替NaOH溶液,则会导致测得的△H
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】H2O2是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某化学小组为探究H2O2的性质做了实验:
(1)图表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据。用10mL H2O2制取150mL O2所需的时间(s)几乎不反应
H2O2分解的化学方程式为:_______ 研究小组在设计方案时,考虑了_______ 、_______ 、_______ 因素对过氧化氢分解速率的影响。
(2)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图所示的实验。请回答相关问题:

①可通过观察_______ ,比较得出结论。
②有同学提出将0.1 mol·L-1FeCl3溶液改为0.05 mol·L-1Fe2(SO4)3更为合理,其理由是_______ 。
(3)已知FeCl3溶液中主要含有H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想。
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+。
猜想 2:真正催化分解H2O2的是_______ 。
完成表格验证猜想:
(1)图表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据。用10mL H2O2制取150mL O2所需的时间(s)几乎不反应
| 浓度/时间/s/反应条件 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
| 不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 加热 | 360 | 480 | 540 | 720 |
| MnO2、加热 | 10 | 25 | 60 | 120 |
(2)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图所示的实验。请回答相关问题:

①可通过观察
②有同学提出将0.1 mol·L-1FeCl3溶液改为0.05 mol·L-1Fe2(SO4)3更为合理,其理由是
(3)已知FeCl3溶液中主要含有H2O、Fe3+和 Cl-三种微粒,甲同学又做了两种猜想。
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+。
猜想 2:真正催化分解H2O2的是
完成表格验证猜想:
| 所需试剂 | 操作及现象 | 结论 |
| Cl-对H2O2分解无催化作用 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】(1)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量的硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
①硫酸铜溶液可加快氢气生成速率的原因是___________ 。
②要加快上述实验中气体产生的速率,还可采取的措施有___________ (答两种)。
③为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
在此实验设计中,其中:V5=___________ ,V10=___________ 。
(2)把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应: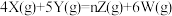 。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为
。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为 ,请回答下列问题:
,请回答下列问题:
①化学反应方程式中n=___________ 。
②2min末时Y的浓度为___________ 。
③2min末,恢复到反应前温度,体系内压强是反应前压强的___________ 倍。
①硫酸铜溶液可加快氢气生成速率的原因是
②要加快上述实验中气体产生的速率,还可采取的措施有
③为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
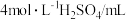 | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
(2)把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:
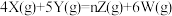 。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为
。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为 ,请回答下列问题:
,请回答下列问题:①化学反应方程式中n=
②2min末时Y的浓度为
③2min末,恢复到反应前温度,体系内压强是反应前压强的
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】KI溶液在酸性条件下能与氧气反应。现有以下实验记录,回答下列问题:
(1)该反应的离子方程式为____________ 。
(2)该实验的目的是探究_______ 对反应速率的影响。
(3)实验试剂除了 溶液、
溶液、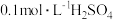 溶液外,还需要的指示剂是
溶液外,还需要的指示剂是________ 。实验仪器除了试管、试剂瓶、胶头滴管、温度计外,还需要的仪器是___________ 。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是________ (填字母)。
A 温度 B 指示剂的浓度 C 试剂的用量(体积) D 试剂添加的顺序
(5)若要进行酸性强弱对反应速率的影响的探究实验,你会采取的措施是_______ 。
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(2)该实验的目的是探究
(3)实验试剂除了
 溶液、
溶液、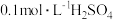 溶液外,还需要的指示剂是
溶液外,还需要的指示剂是(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是
A 温度 B 指示剂的浓度 C 试剂的用量(体积) D 试剂添加的顺序
(5)若要进行酸性强弱对反应速率的影响的探究实验,你会采取的措施是
您最近一年使用:0次



