兴趣小组用莫尔盐[化学式为(NH4)xFe(SO4)2·6H2O(Fe为+2价)]测定KMnO4溶液的物质的量浓度的过程如下:
①称取19.6g莫尔盐配成100mL溶液。
②量取10.00mLKMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积20.00mL,所发生反应的离子方程式如下:4H++5Fe2++MnO4-=5Fe3++Mn2++4H2O请回答下列问题:
(1)(NH4)xFe(SO4)2·6H2O中x=___ ,c(Fe2+)=___ 。
(2)第①步实验中所需的玻璃仪器除量筒、烧杯、胶头滴管外还有___ ;
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移、定容操作。下列图对应的操作规范的是___ 。
a.称量 b.溶解
b.溶解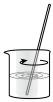 c.转移
c.转移 d.定容
d.定容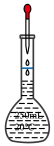
(3)计算KMnO4溶液的物质的量浓度,写出计算过程。___
①称取19.6g莫尔盐配成100mL溶液。
②量取10.00mLKMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积20.00mL,所发生反应的离子方程式如下:4H++5Fe2++MnO4-=5Fe3++Mn2++4H2O请回答下列问题:
(1)(NH4)xFe(SO4)2·6H2O中x=
(2)第①步实验中所需的玻璃仪器除量筒、烧杯、胶头滴管外还有
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移、定容操作。下列图对应的操作规范的是
a.称量
 b.溶解
b.溶解 c.转移
c.转移 d.定容
d.定容
(3)计算KMnO4溶液的物质的量浓度,写出计算过程。
更新时间:2019-12-02 12:35:35
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】CCTV 在“新闻30分”中介绍:王者归“铼”,我国发现超级铼矿,飞机上天全靠它。铼的稳定硫化物有ReS2,稳定的氧化物有 Re2O7。工业上,常从冶炼铜的废液中提取铼,其简易工艺流程如图(部分副产物省略,铼在废液中以ReO4-形式存在):
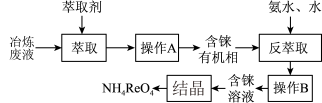
回答下列问题:
(1)铼不溶于盐酸,可溶于稀硝酸生成高铼酸。高铼酸组成与高氯酸相似,写出反应的化学方程式:______ 。
(2)操作 A的名称是_____ 。 “萃取”中萃取剂应具有的性质:_______ (填代号)。
①萃取剂难溶于水
②萃取剂的密度大于水
③ReO4-在萃取剂中的溶解度大于在水中的溶解度
④萃取剂不和 ReO4-发生反应
(3)在“反萃取”中,加入氨水、水的目的是_____ 。
(4)在高温下高铼酸铵分解生成 Re2O7,用氢气还原 Re2O7,制备高纯度铼粉。
①写出高铼酸铵分解生成 Re2O7的化学方程式_______ 。
②工业上,利用氢气还原 Re2O7制备铼,根据生成铼的量计算氢气量,实际消耗 H2量大于理论计算量,其原因是______ 。
(5)工业上,高温灼烧含 ReS2的矿粉,可以制备 Re2O7。以含 ReS2的矿石原料生产 48.4tRe2O7, 理论上转移_____ mol电子。

回答下列问题:
(1)铼不溶于盐酸,可溶于稀硝酸生成高铼酸。高铼酸组成与高氯酸相似,写出反应的化学方程式:
(2)操作 A的名称是
①萃取剂难溶于水
②萃取剂的密度大于水
③ReO4-在萃取剂中的溶解度大于在水中的溶解度
④萃取剂不和 ReO4-发生反应
(3)在“反萃取”中,加入氨水、水的目的是
(4)在高温下高铼酸铵分解生成 Re2O7,用氢气还原 Re2O7,制备高纯度铼粉。
①写出高铼酸铵分解生成 Re2O7的化学方程式
②工业上,利用氢气还原 Re2O7制备铼,根据生成铼的量计算氢气量,实际消耗 H2量大于理论计算量,其原因是
(5)工业上,高温灼烧含 ReS2的矿粉,可以制备 Re2O7。以含 ReS2的矿石原料生产 48.4tRe2O7, 理论上转移
您最近一年使用:0次
【推荐2】草酸亚铁晶体( FeC2O4·2H2O)是一种淡黄色粉末,可用作照相显影剂。某课外小组利用如下实验装置对草酸亚铁晶体分解产物进行探究,并设计实验测定草酸亚铁晶体样品纯度。
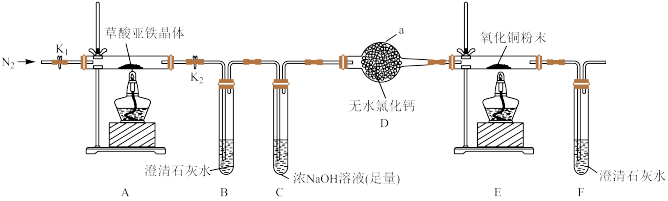
回答下列问题:
(1)仪器a的名称为_____ ;装置B中澄清石灰水变浑浊,说明气体分解产物中含有_____ ;
(2)实验前先通一段时间N2目的是________ ;装置C中浓NaOH溶液的作用是______ ;
(3)证明草酸亚铁晶体分解产物中含有CO的实验现象是______ ;
(4)充分反应后,将装置A硬质玻璃管中的残留固体溶于足量的稀硫酸中,无气泡产生,滴加几滴KSCN溶液,溶液不变红,说明固体分解产物是______ (填化学式);根据上述实验现象写出草酸亚铁晶体分解的化学方程式_______ ;
(5)所给实验装置存在明显的设计缺陷,该缺陷是______ ;
(6)草酸亚铁晶体样品纯度的测定:准确称取12. 000 g某草酸亚铁晶体样品,在一定条件下溶于稍过量的硫酸中,配成250 mL溶液。取25.00 mL上述溶液,用0.100 mol/L KMnO4标准溶液滴定,达到滴定终点时, 消耗35.00 mL KMnO4标准溶液,滴定反应为:FeC2O4·2H2O + KMnO4+ H2SO4→Fe2(SO4)3+CO2↑+ MnSO4 + K2SO4 + H2O(未配平)。则该草酸亚铁晶体样品的纯度为________ (已知该草酸亚铁晶体样品中不含其他与高锰酸钾反应的还原性杂质)。

回答下列问题:
(1)仪器a的名称为
(2)实验前先通一段时间N2目的是
(3)证明草酸亚铁晶体分解产物中含有CO的实验现象是
(4)充分反应后,将装置A硬质玻璃管中的残留固体溶于足量的稀硫酸中,无气泡产生,滴加几滴KSCN溶液,溶液不变红,说明固体分解产物是
(5)所给实验装置存在明显的设计缺陷,该缺陷是
(6)草酸亚铁晶体样品纯度的测定:准确称取12. 000 g某草酸亚铁晶体样品,在一定条件下溶于稍过量的硫酸中,配成250 mL溶液。取25.00 mL上述溶液,用0.100 mol/L KMnO4标准溶液滴定,达到滴定终点时, 消耗35.00 mL KMnO4标准溶液,滴定反应为:FeC2O4·2H2O + KMnO4+ H2SO4→Fe2(SO4)3+CO2↑+ MnSO4 + K2SO4 + H2O(未配平)。则该草酸亚铁晶体样品的纯度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】氧化铬(Cr2O3)可用作着色剂、催化剂、印刷纸币的油墨等。以含铬废料(含FeCr2O4、MgO、SiO2、Al2O3等)为原料制备氧化铬的一种流程如图所示。

已知:烧渣的成分为Na2CrO4、NaAlO2、Na2SiO3、Fe2O3、MgO;Ksp[Fe(OH)3]=4×10-38、Ksp[Al(OH)3]=1×10-33、Ksp[Mg(OH)2]=2×10-11,溶液中离子浓度≤10-5mol·L-1时认为该离子沉淀完全。
回答下列问题:
(1)“研磨”的目的为___________ ;“焙烧”过程发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为___________ 。
(2)若滤液1中金属离子的浓度均为0.2mol·L-1,则“调pH”的最小值为___________ 。(保留两位有效数字)。
(3)“除镁”工序控制温度不能过高,且不能在陶瓷容器中进行的原因为___________ 。
(4)“转化”时加入适量H2SO4的作用为___________ 。
(5)部分物质的溶解度曲线如图所示。

①“系列操作”具体指___________ ,将所得滤液降温结晶、过滤、乙醚洗涤。
②降温结晶时控制的适宜温度为___________ (填选项字母)。
A.0~10℃ B.10~20℃ C.50~70℃ D.80℃以上
③用乙醚洗涤而不用乙醇洗涤的原因为___________ 。
(6)“煅烧”反应生成N2和水蒸气,该反应的化学方程式为___________ 。

已知:烧渣的成分为Na2CrO4、NaAlO2、Na2SiO3、Fe2O3、MgO;Ksp[Fe(OH)3]=4×10-38、Ksp[Al(OH)3]=1×10-33、Ksp[Mg(OH)2]=2×10-11,溶液中离子浓度≤10-5mol·L-1时认为该离子沉淀完全。
回答下列问题:
(1)“研磨”的目的为
(2)若滤液1中金属离子的浓度均为0.2mol·L-1,则“调pH”的最小值为
(3)“除镁”工序控制温度不能过高,且不能在陶瓷容器中进行的原因为
(4)“转化”时加入适量H2SO4的作用为
(5)部分物质的溶解度曲线如图所示。

①“系列操作”具体指
②降温结晶时控制的适宜温度为
A.0~10℃ B.10~20℃ C.50~70℃ D.80℃以上
③用乙醚洗涤而不用乙醇洗涤的原因为
(6)“煅烧”反应生成N2和水蒸气,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】某化学兴趣小组为研究Na2CO3和NaHCO3的性质,完成了如下实验。
【实验一】溶解性比较。
(1)室温下,Na2CO3的溶解度大于NaHCO3的实验证据是___________ 。
(2)根据两试管中的温度变化情况,可得出的结论是___________ 。
【实验二】配制0.05mol·L-1Na2CO3溶液和0.05mol·L-1NaHCO3溶液。
(3)若要配制500mL上述Na2CO3溶液,需用托盘天平称量Na2CO3固体___________ g。
(4)配制上述Na2CO3溶液时需要用到的玻璃仪器有烧杯、玻璃棒和___________ 。
(5)下列情况中,会使所配溶液浓度偏高的是___________ (填字母)。
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
【实验三】测量下述实验过程的pH变化,实验操作及实验现象如下表所示。
【资料查阅】pH越小,OH-的物质的量浓度越小,溶液碱性越弱。
(6)当烧杯②中加入2mLNa2CO3溶液或烧杯③中加入2mLNaHCO3溶液时,两烧杯中产生白色沉淀的质量相等,其理由是___________ ,烧杯③中反应的离子方程式为___________ 。
【实验一】溶解性比较。
| 实验操作 | 实验现象 | |
| Na2CO3 | NaHCO3 | |
| 在两支试管中加入1gNa2CO3或1gNaHCO3,再加入5mL水,振荡;将温度计分别插入其中 | 温度由17.6℃变为23.2℃;放置至室温时,试管内无固体 | 温度由17.6℃变为17.2℃;放置至室温时,试管内有少量固体残留 |
(2)根据两试管中的温度变化情况,可得出的结论是
【实验二】配制0.05mol·L-1Na2CO3溶液和0.05mol·L-1NaHCO3溶液。
(3)若要配制500mL上述Na2CO3溶液,需用托盘天平称量Na2CO3固体
(4)配制上述Na2CO3溶液时需要用到的玻璃仪器有烧杯、玻璃棒和
(5)下列情况中,会使所配溶液浓度偏高的是
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
【实验三】测量下述实验过程的pH变化,实验操作及实验现象如下表所示。
【资料查阅】pH越小,OH-的物质的量浓度越小,溶液碱性越弱。
| 实验操作 | 实验现象 |
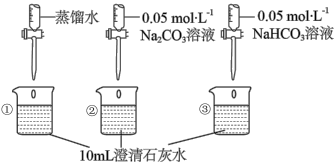 | I.②和③中均产生白色沉淀。 II.  |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】配制一定物质的量浓度的溶液是化学实验室的基本实验操作之一。请回答下列问题:
(1)配制0.5 mol/L的硫酸溶液450 mL,需用量筒量取质量分数98%、密度1.84 g/cm3的浓硫酸的体积为_____ mL,如果实验室有20 mL、50 mL、100 mL 量筒,应最好选用_____ mL量筒。
(2)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的两种玻璃仪器是________________ 。
(3)请说出本实验中玻璃棒的作用:____________ 。
(4)下面操作造成所配稀硫酸溶液浓度偏高的是___________ (填序号)。
A.浓硫酸稀释后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量浓硫酸后洗涤量筒并将洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
(1)配制0.5 mol/L的硫酸溶液450 mL,需用量筒量取质量分数98%、密度1.84 g/cm3的浓硫酸的体积为
(2)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的两种玻璃仪器是
(3)请说出本实验中玻璃棒的作用:
(4)下面操作造成所配稀硫酸溶液浓度偏高的是
A.浓硫酸稀释后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量浓硫酸后洗涤量筒并将洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为___________ ⑧ ⑤__________ 。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有 _______________________________ 。
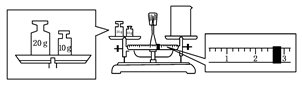
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为_________ g,要完成本实验该同学应称出_________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是________ 。
(4)在配制过程中,下列操作会引起浓度偏低的是________ 。
①没有洗涤烧杯和玻璃棒且未将洗涤液注入容量瓶
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为

(3)使用容量瓶前必须进行的一步操作是
(4)在配制过程中,下列操作会引起浓度偏低的是
①没有洗涤烧杯和玻璃棒且未将洗涤液注入容量瓶
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
您最近一年使用:0次



