氯化铜晶体(CuCl2•2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

请参照下表给出的数据填空。
(1)操作I加入X的目的是_________________________ 。
(2)下列物质都可以作为X,最适合本实验的X物质可以是(填选项)_________ 。
A.KMnO4 B.H2O2 C.NaClO D.Cl2
(3)操作Ⅱ的Y试剂为(填化学式)_________ ,并调节溶液的pH在_________ 范围。
(4)操作Ⅲ的程序依次为蒸发浓缩、冷却结晶、过滤、自然干燥、得到CuCl2•2H2O晶体。
(5)实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示):________________ 。

请参照下表给出的数据填空。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Cu2+ Fe2+ Fe3+ | 4.7 7.0 1.9 | 6.7 9.0 3.2 |
(2)下列物质都可以作为X,最适合本实验的X物质可以是(填选项)
A.KMnO4 B.H2O2 C.NaClO D.Cl2
(3)操作Ⅱ的Y试剂为(填化学式)
(4)操作Ⅲ的程序依次为蒸发浓缩、冷却结晶、过滤、自然干燥、得到CuCl2•2H2O晶体。
(5)实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示):
更新时间:2019-12-13 19:05:46
|
相似题推荐
【推荐1】废旧无汞碱性锌锰电池可用于制造隐形战机的机身涂料MnxZn(1-x)Fe2O4,该电池工作反应原理为Zn+2MnO2+2H2O 2MnO(OH)+Zn(OH)2。某化学小组利用废电池制涂料的工艺如下:
2MnO(OH)+Zn(OH)2。某化学小组利用废电池制涂料的工艺如下:
A.浸取:将去除表面塑料的旧电池加入水中浸取并过滤,滤液经操作a得KOH固体;
B.溶液:滤渣中加入过量稀硫酸和足量双氧水,至不再出现气泡时,过滤;
C.测成分:测步骤B中滤液成分,然后加入铁粉;
D.氧化:加入双氧水氧化;
E.调pH:滴加氨水调pH,经结晶处理得MnxZn(1-x)Fe2O4。
(1)浸取时的操作有______ 。
A.拆解、粉碎旧电池 B.降低温度 C.搅拌 D.加压
(2)操作a为________ 。
(3)溶渣时生成Mn2+的主要离子方程式为______________________________ 。
(4)若步骤C测得滤液中金属离子组成为:c(Mn2+) +c(Zn2+) =0.8mol/L, c(Fe2+ ) = 0. 1 mol/L。若滤液体积为lm3,要合成MnxZn(1-x)Fe2O4,需加入Fe粉质量为___________ kg(忽略体积变化)。
(5)氧化时,因为分解所需双氧水的量比理论值大得多。其原因可能是①温度过高;②______ 。
(6)最后一步结晶时,处理不当易生成MnFe2O4和ZnFe2O4。要制得MnxZn(1-x)Fe2O4,最后一步结晶时需注意______________________ 。
(7)某小组构想用ZnSO4、MnSO4溶液为原料,以Fe作电极用电解法经过一系列步骤制得MnxZn(1-x)Fe2O4,则开始电解时阳极反应式为___________________________________ 。
 2MnO(OH)+Zn(OH)2。某化学小组利用废电池制涂料的工艺如下:
2MnO(OH)+Zn(OH)2。某化学小组利用废电池制涂料的工艺如下:A.浸取:将去除表面塑料的旧电池加入水中浸取并过滤,滤液经操作a得KOH固体;
B.溶液:滤渣中加入过量稀硫酸和足量双氧水,至不再出现气泡时,过滤;
C.测成分:测步骤B中滤液成分,然后加入铁粉;
D.氧化:加入双氧水氧化;
E.调pH:滴加氨水调pH,经结晶处理得MnxZn(1-x)Fe2O4。
(1)浸取时的操作有
A.拆解、粉碎旧电池 B.降低温度 C.搅拌 D.加压
(2)操作a为
(3)溶渣时生成Mn2+的主要离子方程式为
(4)若步骤C测得滤液中金属离子组成为:c(Mn2+) +c(Zn2+) =0.8mol/L, c(Fe2+ ) = 0. 1 mol/L。若滤液体积为lm3,要合成MnxZn(1-x)Fe2O4,需加入Fe粉质量为
(5)氧化时,因为分解所需双氧水的量比理论值大得多。其原因可能是①温度过高;②
(6)最后一步结晶时,处理不当易生成MnFe2O4和ZnFe2O4。要制得MnxZn(1-x)Fe2O4,最后一步结晶时需注意
(7)某小组构想用ZnSO4、MnSO4溶液为原料,以Fe作电极用电解法经过一系列步骤制得MnxZn(1-x)Fe2O4,则开始电解时阳极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】硼化铬(CrB)可用作耐磨、抗高温氧化涂层和核反应堆中的中子吸收涂层。以高铝铬铁矿(主要含 和
和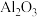 ,还含
,还含 、FeO、MgO、
、FeO、MgO、 )为原料制备硼化铬和铝的工艺流程如下。
)为原料制备硼化铬和铝的工艺流程如下。
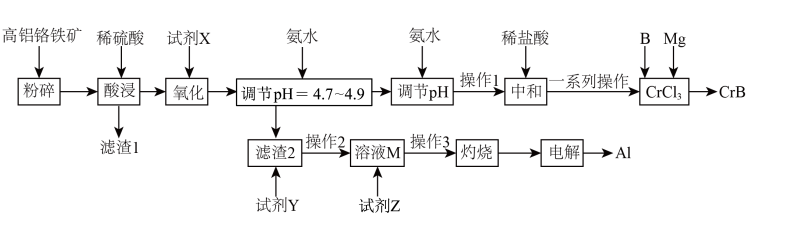
下表列出了相关金属离子生成氢氧化物沉淀的pH:
请回答下列问题:
(1)“氧化”的目的是将溶液中的 转化为
转化为 ,试剂X可选用
,试剂X可选用 或
或 ,若氧化等物质的量的
,若氧化等物质的量的 ,需要消耗
,需要消耗 和
和 的质量比为
的质量比为___________ 。
(2)试剂Y是___________ ,操作1的名称是___________ 。
(3)向M溶液中加入过量试剂Z发生反应的离子方程式为___________ 。
(4)第二次加氨水调节pH的范围是___________ ;加稀盐酸中和前,需要洗涤沉淀,证明沉淀洗涤干净的操作方法是___________ 。
(5)硼化铬是在650℃时由金属镁与硼、氯化铬的混合物制得的,写出该反应的化学方程式:___________ 。
 和
和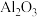 ,还含
,还含 、FeO、MgO、
、FeO、MgO、 )为原料制备硼化铬和铝的工艺流程如下。
)为原料制备硼化铬和铝的工艺流程如下。
下表列出了相关金属离子生成氢氧化物沉淀的pH:
| 金属离子 |  |  |  |  |  |
| 开始沉淀的pH | 2.3 | 10.4 | 4.9 | 7.5 | 3.4 |
| 沉淀完全的Ph | 4.1 | 12.4 | 6.8 | 9.7 | 4.7 |
(1)“氧化”的目的是将溶液中的
 转化为
转化为 ,试剂X可选用
,试剂X可选用 或
或 ,若氧化等物质的量的
,若氧化等物质的量的 ,需要消耗
,需要消耗 和
和 的质量比为
的质量比为(2)试剂Y是
(3)向M溶液中加入过量试剂Z发生反应的离子方程式为
(4)第二次加氨水调节pH的范围是
(5)硼化铬是在650℃时由金属镁与硼、氯化铬的混合物制得的,写出该反应的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
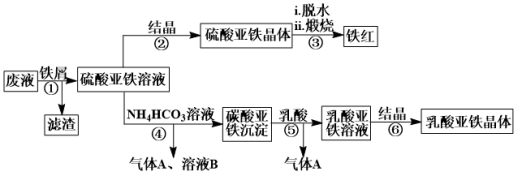
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO 。请回答:
。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是___________ 。
(2)滤渣的主要成分为TiO2•xH2O,写出TiOSO4水解生成TiO2•xH2O的化学方程式___________ 。
(3)写出硫酸亚铁在空气中煅烧生成铁红的反应的化学方程式___________ ,该反应中每产生1mol铁红(氧化铁),转移的电子数为___________ mol。
(4)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因______
(5)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及___________ 。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)___________ 。 (已知MnO +5Fe2++8H+=Mn2++5Fe3++4H2O)
+5Fe2++8H+=Mn2++5Fe3++4H2O)

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO
 。请回答:
。请回答:(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是
(2)滤渣的主要成分为TiO2•xH2O,写出TiOSO4水解生成TiO2•xH2O的化学方程式
(3)写出硫酸亚铁在空气中煅烧生成铁红的反应的化学方程式
(4)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因
(5)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)
 +5Fe2++8H+=Mn2++5Fe3++4H2O)
+5Fe2++8H+=Mn2++5Fe3++4H2O)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
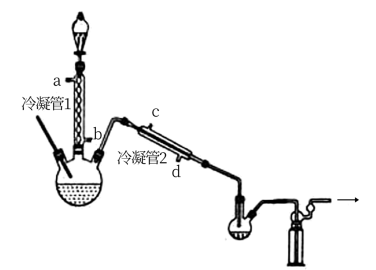
冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2
 +H2O)
+H2O)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI( ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要___________
②设计步骤b的目的是___________
③过氧乙酸的质量分数为___________ %。
(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:CH3COOH+H2O2
 +H2O)
+H2O)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】亚硝酸钠( )的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。
)的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。
已知:
① 有强氧化性又有还原性;
有强氧化性又有还原性;
②NO能被酸性 氧化成硝酸根离子。
氧化成硝酸根离子。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的 。
。
反应原理为:

回答下列问题:
(1)甲装置中盛稀硝酸的仪器名称是___________ ;反应过程中观察到丙中的现象为___________ 。
(2)甲装置中发生反应的化学方程式:___________ 。
(3)甲中滴入稀硝酸前需先通入 ,原因是
,原因是___________ 。
(4)丁中酸性 的作用
的作用___________ 。
(5)人体正常的血红蛋白含有 ,但若误食亚硝酸钠,会导致血红蛋白含有的
,但若误食亚硝酸钠,会导致血红蛋白含有的 转化为
转化为 而中毒,服用维生素C可解毒。解毒时维生素C的作用是
而中毒,服用维生素C可解毒。解毒时维生素C的作用是___________ (填“还原性”或“氧化性”)。
(6)某学生将新制氯水滴加到 溶液中,观察到氯水褪色,生成
溶液中,观察到氯水褪色,生成 利HCl,写出该反应的离子方程式:
利HCl,写出该反应的离子方程式:___________ 。
 )的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。
)的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。已知:
①
 有强氧化性又有还原性;
有强氧化性又有还原性;②NO能被酸性
 氧化成硝酸根离子。
氧化成硝酸根离子。某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的
 。
。反应原理为:


回答下列问题:
(1)甲装置中盛稀硝酸的仪器名称是
(2)甲装置中发生反应的化学方程式:
(3)甲中滴入稀硝酸前需先通入
 ,原因是
,原因是(4)丁中酸性
 的作用
的作用(5)人体正常的血红蛋白含有
 ,但若误食亚硝酸钠,会导致血红蛋白含有的
,但若误食亚硝酸钠,会导致血红蛋白含有的 转化为
转化为 而中毒,服用维生素C可解毒。解毒时维生素C的作用是
而中毒,服用维生素C可解毒。解毒时维生素C的作用是(6)某学生将新制氯水滴加到
 溶液中,观察到氯水褪色,生成
溶液中,观察到氯水褪色,生成 利HCl,写出该反应的离子方程式:
利HCl,写出该反应的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。

(1)吸硫装置如图所示。

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是_____________ ,表明SO2吸收效率低的实验现象是B中溶液______________ 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是______________ 。(任写一条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2),限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(相对分子质量:214)固体配成溶液,
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂,
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为v mL。则c(Na2S2O3)=______ mol·L-1。(只列出算式,不作运算)
已知:IO3-+I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-。甲同学盛装Na2S2O3溶液之前未润洗,这样测得的Na2S2O3的浓度可能________ (填“无影响”、“偏低”或“偏高”);乙同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3的浓度可能________ (填“无影响”、“ 偏低”或“偏高”)。

(1)吸硫装置如图所示。

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2),限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解, | 与白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
第一步:准确称取a g KIO3(相对分子质量:214)固体配成溶液,
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂,
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为v mL。则c(Na2S2O3)=
已知:IO3-+I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-。甲同学盛装Na2S2O3溶液之前未润洗,这样测得的Na2S2O3的浓度可能
您最近一年使用:0次



