锌灰是炼锌厂的烟道灰,含ZnO 35%以上,还含有少量的氧化锰(MnO)、氧化铜、 铁的氧化物和不溶于酸的杂质,工业上常用酸浸法回收 ZnSO4·7H2O。已知 ZnSO4·7H2O 晶体易溶于水,难溶于酒精,某兴趣小组实验室模拟回收 ZnSO4·7H2O 晶体,流程如下:

请回答:
(1)分析步骤Ⅱ中的操作和原理, 回答下列问题:
①结合表 1、 2,分析选择的 pH 及温度分别是______________________ , 其中, 可以采用加入_________________________ 来调节 pH ;
表1 pH对ZnSO4.7H2O 回收量及纯度的影响
表2 温度对ZnSO4.7H2O 回收量及纯度的影响
②酸性 KMnO4 溶液将溶液中的 Fe2+氧化,生成两种沉淀;同时,过量的高锰酸钾在微酸性的条件能自动分解生成MnO2 沉淀。试写出在该环境下,KMnO4 溶液氧化 Fe2+的离子反应方程式_________________________________________ 。 若用稀硝酸做氧化剂,除了产物中可能含有 Zn(NO3)2外,还可能的缺点是:_________________________ ;
(2)分析整个实验过程中,回答下列问题:
①滤渣 B 的主要成分为___________________________ ;
②如何检验滤液B中是否含有铁元素_____________________________________ ;
③写出生成滤渣C的离子方程式__________________________________________ ;
(3)为测定 ZnSO4·7H2O 晶体的纯度,可用 K4Fe(CN)6标准液进行滴定。主要原理如下:2K4Fe(CN)6+ 3ZnSO4= K2Zn3[Fe(CN)6]2↓+ 3K2SO4
准确称取 5.000g ZnSO4·7H2O 晶体,用蒸馏水溶解并定容至 250mL,准确移取该溶液 25.00mL至锥形瓶中,用 0.0500mol/L K4Fe(CN)6溶液进行滴定,所得数据如下表:
则 ZnSO4·7H2O 晶体的纯度是_______________ (以质量分数表示,保留到小数点后两位)。

请回答:
(1)分析步骤Ⅱ中的操作和原理, 回答下列问题:
①结合表 1、 2,分析选择的 pH 及温度分别是
表1 pH对ZnSO4.7H2O 回收量及纯度的影响
| pH | ZnSO4.7H2O 回收量(g) | 产品中Fe的含量% | 产品中其他重金属含量% |
| 1 | 114.32 | 0.750 | 0.059 |
| 2 | 114.4 | 0.086 | 0.056 |
| 3 | 113.68 | 0.034 | 0.054 |
| 4 | 113.60 | 0.010 | 0.050 |
| 5 | 112.43 | 0.010 | 0.050 |
表2 温度对ZnSO4.7H2O 回收量及纯度的影响
| 温度 (℃) | ZnSO4.7H2O 回收量(g) | 产品中Fe的含量% | 产品中其他重金属含量% |
| 20 | 111.45 | 0.011 | 0.052 |
| 40 | 112.89 | 0.010 | 0.051 |
| 60 | 113.30 | 0.010 | 0.050 |
| 80 | 113.80 | 0.010 | 0.050 |
| 90 | 114.40 | 0.091 | 0.048 |
②酸性 KMnO4 溶液将溶液中的 Fe2+氧化,生成两种沉淀;同时,过量的高锰酸钾在微酸性的条件能自动分解生成MnO2 沉淀。试写出在该环境下,KMnO4 溶液氧化 Fe2+的离子反应方程式
(2)分析整个实验过程中,回答下列问题:
①滤渣 B 的主要成分为
②如何检验滤液B中是否含有铁元素
③写出生成滤渣C的离子方程式
(3)为测定 ZnSO4·7H2O 晶体的纯度,可用 K4Fe(CN)6标准液进行滴定。主要原理如下:2K4Fe(CN)6+ 3ZnSO4= K2Zn3[Fe(CN)6]2↓+ 3K2SO4
准确称取 5.000g ZnSO4·7H2O 晶体,用蒸馏水溶解并定容至 250mL,准确移取该溶液 25.00mL至锥形瓶中,用 0.0500mol/L K4Fe(CN)6溶液进行滴定,所得数据如下表:
| 实验次数 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.10 | 19.92 |
| 2 | 1.34 | 21.12 |
| 3 | 0.00 | 20.10 |
则 ZnSO4·7H2O 晶体的纯度是
更新时间:2019-12-21 09:21:29
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】将炼钛厂、氯碱厂和甲醇厂组成产业链如下,可得到烧碱、甲醇、钛以及其他一些有用的副产品。

已知:合成甲醇的主反应为:CO+2H2 CH3OH+Q(Q>0,下同);
CH3OH+Q(Q>0,下同);
同时有副反应如:8CO+17H2 C8H18+8H2O+Q;4CO+8H2
C8H18+8H2O+Q;4CO+8H2 C4H9OH+3H2O+Q。
C4H9OH+3H2O+Q。
请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是__________ (填写化学式)。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________ 。
(3)诸如上述联合生产,其优点有_______ 。生产中除了获得上述目标产品外,还能得到副产品________ (填写化学式)。
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H2_____ 吨(不考虑生产过程中物质的损失及副反应)。
(5)上述产业链中“氯化”在6000C以上的反应器内进行。已知:
为了将TiCl4从“氯化”后的混合物中分离出来,请设计合理的方案:_______ 。

已知:合成甲醇的主反应为:CO+2H2
 CH3OH+Q(Q>0,下同);
CH3OH+Q(Q>0,下同);同时有副反应如:8CO+17H2
 C8H18+8H2O+Q;4CO+8H2
C8H18+8H2O+Q;4CO+8H2 C4H9OH+3H2O+Q。
C4H9OH+3H2O+Q。请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式
(3)诸如上述联合生产,其优点有
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H2
(5)上述产业链中“氯化”在6000C以上的反应器内进行。已知:
| 物质 | 沸点(0C) |
| TiCl4 | 136 |
| FeCl3 | 315 |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】重铬酸钾( )在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为
)在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为 ,还含杂质
,还含杂质 )为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
)为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
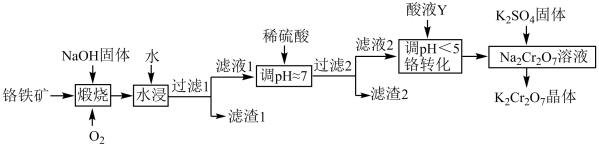
回答下列问题:
(1)基态Cr原子的未成对电子数为_______ 。二氧化硅比二氧化碳熔点高得多的最主要原因是_______ 。
(2)煅烧铬铁矿后生成 和
和 等,已知
等,已知 遇水强烈水解,生成红褐色沉淀,
遇水强烈水解,生成红褐色沉淀, 水解的离子方程式为
水解的离子方程式为_______ ;滤液1中的阴离子主要有 、
、_______ 。
(3)流程中若省去 这一操作,产品中可能含有的杂质是
这一操作,产品中可能含有的杂质是_______ 。
(4)结合离子方程式,从化学平衡移动的角度分析加入酸液Y的作用:_______ 。
(5)由于 是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含
是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含 酸性废水需要进行处理,可用焦亚硫酸钠(
酸性废水需要进行处理,可用焦亚硫酸钠( )将
)将 转化为毒性较低的
转化为毒性较低的 ,室温下再调节溶液的pH,生成
,室温下再调节溶液的pH,生成 沉淀,分离出污泥,保证废水中
沉淀,分离出污泥,保证废水中 的质量浓度小于
的质量浓度小于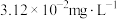 。已知室温下,
。已知室温下,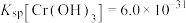 。
。
① 参加反应的离子方程式为
参加反应的离子方程式为_______ 。
②溶液的pH至少要大于_______ 。
 )在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为
)在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为 ,还含杂质
,还含杂质 )为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
)为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
回答下列问题:
(1)基态Cr原子的未成对电子数为
(2)煅烧铬铁矿后生成
 和
和 等,已知
等,已知 遇水强烈水解,生成红褐色沉淀,
遇水强烈水解,生成红褐色沉淀, 水解的离子方程式为
水解的离子方程式为 、
、(3)流程中若省去
 这一操作,产品中可能含有的杂质是
这一操作,产品中可能含有的杂质是(4)结合离子方程式,从化学平衡移动的角度分析加入酸液Y的作用:
(5)由于
 是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含
是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含 酸性废水需要进行处理,可用焦亚硫酸钠(
酸性废水需要进行处理,可用焦亚硫酸钠( )将
)将 转化为毒性较低的
转化为毒性较低的 ,室温下再调节溶液的pH,生成
,室温下再调节溶液的pH,生成 沉淀,分离出污泥,保证废水中
沉淀,分离出污泥,保证废水中 的质量浓度小于
的质量浓度小于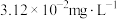 。已知室温下,
。已知室温下,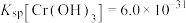 。
。①
 参加反应的离子方程式为
参加反应的离子方程式为②溶液的pH至少要大于
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】二甲基亚砜( )是一种含硫有机化合物,被誉为“万能溶剂”。其在常温下为无色无臭的透明液体,熔点为
)是一种含硫有机化合物,被誉为“万能溶剂”。其在常温下为无色无臭的透明液体,熔点为 ,沸点为
,沸点为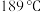 。制备二甲基亚砜的装置如图所示。
。制备二甲基亚砜的装置如图所示。

实验过程:利用仪器A制备 ,将
,将 通入
通入 二甲基硫醚中,控制温度为
二甲基硫醚中,控制温度为 ,进行气液相氧化反应生成二甲基亚砜粗品,最后经减压蒸馏,共收集到二甲基亚砜纯品
,进行气液相氧化反应生成二甲基亚砜粗品,最后经减压蒸馏,共收集到二甲基亚砜纯品 。
。
已知:①二甲基硫醚和二甲基亚砜的密度分别为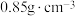 和
和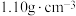 ,相对分子质量分别为62和78;
,相对分子质量分别为62和78;
② 为一元弱酸,不稳定,易分解为
为一元弱酸,不稳定,易分解为 和
和 ;
;
③仪器C中发生的反应为
 +NO。
+NO。
(1) 的作用为
的作用为_______ 。
(2)仪器C中反应液的温度需控制在 ,温度不能过高的原因为
,温度不能过高的原因为_______ 。
(3)仪器E中 溶液的作用为
溶液的作用为_______ 。
 )是一种含硫有机化合物,被誉为“万能溶剂”。其在常温下为无色无臭的透明液体,熔点为
)是一种含硫有机化合物,被誉为“万能溶剂”。其在常温下为无色无臭的透明液体,熔点为 ,沸点为
,沸点为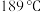 。制备二甲基亚砜的装置如图所示。
。制备二甲基亚砜的装置如图所示。
实验过程:利用仪器A制备
 ,将
,将 通入
通入 二甲基硫醚中,控制温度为
二甲基硫醚中,控制温度为 ,进行气液相氧化反应生成二甲基亚砜粗品,最后经减压蒸馏,共收集到二甲基亚砜纯品
,进行气液相氧化反应生成二甲基亚砜粗品,最后经减压蒸馏,共收集到二甲基亚砜纯品 。
。已知:①二甲基硫醚和二甲基亚砜的密度分别为
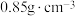 和
和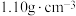 ,相对分子质量分别为62和78;
,相对分子质量分别为62和78;②
 为一元弱酸,不稳定,易分解为
为一元弱酸,不稳定,易分解为 和
和 ;
;③仪器C中发生的反应为

 +NO。
+NO。(1)
 的作用为
的作用为(2)仪器C中反应液的温度需控制在
 ,温度不能过高的原因为
,温度不能过高的原因为(3)仪器E中
 溶液的作用为
溶液的作用为
您最近一年使用:0次



