在标准状况下,①5 g H2 ②11.2 L O2 ③2 mol H2O ④6.02×1023个 CO2分子。
(1)5gH2 的物质的量是_______ ,体积是_______ ;
(2)6.02×1023个CO2分子的物质的量是_____ ,质量是______ ;
(3)所含分子数最多的是______ (请用序号回答,后同);
(4)所含原子数最多的是______ ;
(5)质量最大的是_______ ;
(6)体积最大的是_______ ;
(7) 体积最小的是_______ 。
(1)5gH2 的物质的量是
(2)6.02×1023个CO2分子的物质的量是
(3)所含分子数最多的是
(4)所含原子数最多的是
(5)质量最大的是
(6)体积最大的是
(7) 体积最小的是
更新时间:2019-12-25 14:08:42
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】设用NA表示阿伏加 德罗常数的值,其计算近似值为6.02×1023,按要求完成下列填空:
①0.5mol NH3共含有____ 个原子。
②6mol H2O与标准状况下___ LNH3所含氢原子数相等。
③某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是____ 。
④标准状况下11.2L NO和____ g NO2所含有的氧原子数相等。
⑤0.8g某物质含有3.01×1022个分子,该物质的相对分子质量约为____ 。
①0.5mol NH3共含有
②6mol H2O与标准状况下
③某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是
④标准状况下11.2L NO和
⑤0.8g某物质含有3.01×1022个分子,该物质的相对分子质量约为
您最近半年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g (25℃),再加5 g水充分溶解,仍剩余固体4.80g(25℃)。
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为________________ g(保留2位小数)
(2)若剩余的4.80g固体是MnO2和KCl的混合物,则25℃时KCl的溶解度为_____ ;原混合物中KClO3的质量为________________ g(保留2位小数);所得KCl溶液的密度为1.72g/cm3,则溶液的物质的量浓度为______ mol/L(保留2位小数)。
(3)可用以下反应制备KIO3和K2H3IO6(高碘酸氢二钾):I2+2KClO3=2KIO3+Cl2① KIO3+Cl2+3KOH =K2H3IO6+2KCl ②最终制得的KIO3和K2H3IO6的物质的量之比x,若制得100molK2H3IO6, 共消耗ymolKClO3,试确定y与x的关系式________________ 。
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为
(2)若剩余的4.80g固体是MnO2和KCl的混合物,则25℃时KCl的溶解度为
(3)可用以下反应制备KIO3和K2H3IO6(高碘酸氢二钾):I2+2KClO3=2KIO3+Cl2① KIO3+Cl2+3KOH =K2H3IO6+2KCl ②最终制得的KIO3和K2H3IO6的物质的量之比x,若制得100molK2H3IO6, 共消耗ymolKClO3,试确定y与x的关系式
您最近半年使用:0次
计算题
|
适中
(0.65)
【推荐3】按要求进行计算,直接写出计算结果:
(1)等质量的NH3和H2S中,氢原子的个数比是___________ 。
(2)在相同状况下,等质量的SO2与O2的体积比为___________ ,密度比为___________ 。
(3)加热13.7 g碳酸钠和碳酸氢钠的固体混合物,使碳酸氢钠完全分解,混合物质量减少了3.1 g,则原混合物中碳酸钠的质量为___________ 。
(4)某溶液中只含有Na+、Al3+、Cl-、SO 四种离子,已知前三种离子的个数比为3:1:2,则溶液中Al3+和SO
四种离子,已知前三种离子的个数比为3:1:2,则溶液中Al3+和SO 的离子个数比为
的离子个数比为___________ 。
(1)等质量的NH3和H2S中,氢原子的个数比是
(2)在相同状况下,等质量的SO2与O2的体积比为
(3)加热13.7 g碳酸钠和碳酸氢钠的固体混合物,使碳酸氢钠完全分解,混合物质量减少了3.1 g,则原混合物中碳酸钠的质量为
(4)某溶液中只含有Na+、Al3+、Cl-、SO
 四种离子,已知前三种离子的个数比为3:1:2,则溶液中Al3+和SO
四种离子,已知前三种离子的个数比为3:1:2,则溶液中Al3+和SO 的离子个数比为
的离子个数比为
您最近半年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)标准状况下,2mol NH3与_________ g CO2的体积相等。
(2) 等质量的O2和O3所含的原子个数之比是______ 。
(3)49gH2SO4中的总原子数目为:_______
(4)质量比为11∶7的CO2、CO,它们所含分子数之比为__________ ,所含氧原子数之比为 __________ ,所含电子数之比为 __________ 。
(2) 等质量的O2和O3所含的原子个数之比是
(3)49gH2SO4中的总原子数目为:
(4)质量比为11∶7的CO2、CO,它们所含分子数之比为
您最近半年使用:0次
计算题
|
适中
(0.65)
【推荐2】设NA表示阿伏伽德罗常数。
(1)已知一个NO、NO2分子的质量分别是ag、bg。则一个氧原子的质量是________ ,氧原子的摩尔质量是(用含a、b数字的式子表示)________ ,10 g NO2物质的量为(用含b的式子表示)________ 。
(2)已知H2+Cl2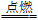 2HCl,在某密闭容器中使NA个Cl2与2 mol H2充分反应后,容器中气体分子数目为
2HCl,在某密闭容器中使NA个Cl2与2 mol H2充分反应后,容器中气体分子数目为________ NA,此时气体总质量为________ 。
(3)含有NA个OH-的Ca(OH)2的质量是________ ,n(Ca2+)=________ 。
(1)已知一个NO、NO2分子的质量分别是ag、bg。则一个氧原子的质量是
(2)已知H2+Cl2
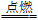 2HCl,在某密闭容器中使NA个Cl2与2 mol H2充分反应后,容器中气体分子数目为
2HCl,在某密闭容器中使NA个Cl2与2 mol H2充分反应后,容器中气体分子数目为(3)含有NA个OH-的Ca(OH)2的质量是
您最近半年使用:0次
计算题
|
适中
(0.65)
名校
【推荐1】I.通过计算填写下列内容:
(1)在标准状况下,6.72LCO的物质的量为_______ ;
(2)在标准状况下,23gC2H5OH的氢原子数目为_______ NA;
(3)7.8 gNa2X中含有Na+0.2 mol,则Na2X的摩尔质量为_______ g/mol;
(4)100mLAl2(SO4)3和MgSO4的混合溶液中,含有Mg2+0.24g, SO 的物质的量浓度为0.7mol/L,则Al3+的物质的量浓度为
的物质的量浓度为0.7mol/L,则Al3+的物质的量浓度为_______ mol/L。
(5)配制500mL 1mol/L的稀硫酸,需取5 mol/L的硫酸_______ mL。
II.分类是学习化学的重要方法,以物质的元素组成和化学性质视角对物质进行科学分类,可体现化学学科独有的魅力。有下列物质:①SO2 ②水银 ③Na2O固体 ④稀硫酸 ⑤碳酸氢钠固体 ⑥酒精 ⑦熔融的KNO3 ⑧蔗糖 ⑨Fe(OH)3胶体
请回答下列问题:
(6)上述物质中属于电解质的是_______ ;
(7)将⑤中固体加热的反应化学方程式是_______ ;
(8)制备⑨的离子反应方程式是_______ 。
(1)在标准状况下,6.72LCO的物质的量为
(2)在标准状况下,23gC2H5OH的氢原子数目为
(3)7.8 gNa2X中含有Na+0.2 mol,则Na2X的摩尔质量为
(4)100mLAl2(SO4)3和MgSO4的混合溶液中,含有Mg2+0.24g, SO
 的物质的量浓度为0.7mol/L,则Al3+的物质的量浓度为
的物质的量浓度为0.7mol/L,则Al3+的物质的量浓度为(5)配制500mL 1mol/L的稀硫酸,需取5 mol/L的硫酸
II.分类是学习化学的重要方法,以物质的元素组成和化学性质视角对物质进行科学分类,可体现化学学科独有的魅力。有下列物质:①SO2 ②水银 ③Na2O固体 ④稀硫酸 ⑤碳酸氢钠固体 ⑥酒精 ⑦熔融的KNO3 ⑧蔗糖 ⑨Fe(OH)3胶体
请回答下列问题:
(6)上述物质中属于电解质的是
(7)将⑤中固体加热的反应化学方程式是
(8)制备⑨的离子反应方程式是
您最近半年使用:0次
计算题
|
适中
(0.65)
【推荐2】物质的量是高中化学常用的物理量,请完成以下有关计算(设阿伏加德罗常数的值为NA):
(1)在标准状况下,0.5molO2的体积为_______ L。
(2)将0.2moLMgCl2固体溶于水配成400mL溶液,MgCl2溶液的物质的量浓度为_______ 。
(3)0.2molCH4含有_______ NA个氢原子。
(4)49g 的物质的量是
的物质的量是_______ mol。
(5)标准状况下,2gH2的体积是_______ L。
(6)等物质的量的 和
和 的质量之比为
的质量之比为_______ 。
(7)标准状况下6.72L某气体质量13.2g,该物质的摩尔质量为_______ 。
(1)在标准状况下,0.5molO2的体积为
(2)将0.2moLMgCl2固体溶于水配成400mL溶液,MgCl2溶液的物质的量浓度为
(3)0.2molCH4含有
(4)49g
 的物质的量是
的物质的量是(5)标准状况下,2gH2的体积是
(6)等物质的量的
 和
和 的质量之比为
的质量之比为(7)标准状况下6.72L某气体质量13.2g,该物质的摩尔质量为
您最近半年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】完成下列问题。
(1)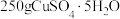 溶于水得到1 L溶液,所得CuSO4溶液中溶质的物质的量浓度为
溶于水得到1 L溶液,所得CuSO4溶液中溶质的物质的量浓度为___________ 。
(2)98 gH2SO4的物质的量是___________ mol;其中含有___________ mol O,含有___________ 个H。
(3)28 g N2的体积(标准状况下)为___________ L。
(4)15.6 g Na2X中含有0.4 mol Na+,则X的相对原子质量为___________ 。
(5)100 mL1 mol/L的碳酸钠溶液所含碳酸钠的质量是___________ g。
(1)
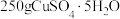 溶于水得到1 L溶液,所得CuSO4溶液中溶质的物质的量浓度为
溶于水得到1 L溶液,所得CuSO4溶液中溶质的物质的量浓度为(2)98 gH2SO4的物质的量是
(3)28 g N2的体积(标准状况下)为
(4)15.6 g Na2X中含有0.4 mol Na+,则X的相对原子质量为
(5)100 mL1 mol/L的碳酸钠溶液所含碳酸钠的质量是
您最近半年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】物质的量及其相关物理量的定量研究对化学科学起着重要的作用,试回答下列问题:
(1)VLFe2(SO4)3溶液中含有48gSO ,取该溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量浓度为
,取该溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量浓度为___________ 。
(2)某物质A在一定条件下加热完全分解,产物都是气体。分解方程式为2A B+2C+2D,测得生成的混合气体对氢气的相对密度为5m,则A的摩尔质量为
B+2C+2D,测得生成的混合气体对氢气的相对密度为5m,则A的摩尔质量为___________ 。
(3)与80gSO2所含有原子数相同的氖气的体积(标准状况)是___________ L。
(4)已知CO、CO2的混合气体质量共12.8g,标准状况下体积为8.96L,则可推知该混合气体的平均相对分子质量为___________ ;CO、CO2的物质的量之比为___________ 。
(1)VLFe2(SO4)3溶液中含有48gSO
 ,取该溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量浓度为
,取该溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量浓度为(2)某物质A在一定条件下加热完全分解,产物都是气体。分解方程式为2A
 B+2C+2D,测得生成的混合气体对氢气的相对密度为5m,则A的摩尔质量为
B+2C+2D,测得生成的混合气体对氢气的相对密度为5m,则A的摩尔质量为(3)与80gSO2所含有原子数相同的氖气的体积(标准状况)是
(4)已知CO、CO2的混合气体质量共12.8g,标准状况下体积为8.96L,则可推知该混合气体的平均相对分子质量为
您最近半年使用:0次
计算题
|
适中
(0.65)
【推荐2】(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比是______ ,原子数之比是______ ,质量之比是______ ,密度之比是______
(2)下列所给出的几组物质中:含有分子数最多的是_________ ;含有原子数最多的是_________ ;标准状况下体积最大的是____________ 。
① 1gH2; ② 2.408×1023个CH4 ;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏伽德罗常数,如果ag某气体含有的分子数是b,则cg该气体在标准状况下的体积是_________________ (用含NA的式子表示)。
(4)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的浓H2SO4(密度为1.84g/cm3)的体积为______________ 。
(2)下列所给出的几组物质中:含有分子数最多的是
① 1gH2; ② 2.408×1023个CH4 ;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏伽德罗常数,如果ag某气体含有的分子数是b,则cg该气体在标准状况下的体积是
(4)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的浓H2SO4(密度为1.84g/cm3)的体积为
您最近半年使用:0次
计算题
|
适中
(0.65)
【推荐3】利用相关知识填空。
(1)等质量的SO2和SO3的物质的量之比是_____ ,所含氧原子个数之比是_______ 。
(2)4.8gCH4中所含氢原子数与________ g水所含氢原子数相等。
(3)在定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为______ 。若此时压强为101kPa,则温度________ 0℃(填“高于”“低于”或“等于”)。
(4)在一密闭容器中充入amolNO和bmolO2,可发生如下反应:2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比为________ 。
(5)有一种由Na2S、Na2SO3、Na2SO4组成的混合物,经测定含硫的质量分数为25.6%,则混合物中含氧的质量分数为______ 。
(6)某同学为测定份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1g混合物,加热至质量不变时,称其质量为m2g,则原混合物中NaHCO3的质量分数为______ (用含m1、m2的代数式表示)。
(1)等质量的SO2和SO3的物质的量之比是
(2)4.8gCH4中所含氢原子数与
(3)在定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为
(4)在一密闭容器中充入amolNO和bmolO2,可发生如下反应:2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比为
(5)有一种由Na2S、Na2SO3、Na2SO4组成的混合物,经测定含硫的质量分数为25.6%,则混合物中含氧的质量分数为
(6)某同学为测定份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1g混合物,加热至质量不变时,称其质量为m2g,则原混合物中NaHCO3的质量分数为
您最近半年使用:0次



