在工业上可用含SiO2、CeO2和Fe2O3的废料作原料来获得硫酸铁铵晶体【Fe2(SO4)3·2(NH4)2 SO4·3H2O】,同时可回收CeO2,工艺流程设计如下

已知: ①SiO2、CeO2不溶于稀硫酸;②酸性条件下,CeO2可与H2O2反应;③“反应Ⅰ”所得溶液中含有Ce3+;④碱性条件下,NH4+与OH-结合生成NH3·H2O。
请回答下列问题
(1)“酸浸”时未发生的反应 物质是__________________ (填化学式)。
(2)“滤液”中含有的阳离子有___________________ (填离子符号)。
(3)写出“反应Ⅰ”的化学方程式:________________________________________ 。
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是__________________ (填化学式)。
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:_____________________ 。

已知: ①SiO2、CeO2不溶于稀硫酸;②酸性条件下,CeO2可与H2O2反应;③“反应Ⅰ”所得溶液中含有Ce3+;④碱性条件下,NH4+与OH-结合生成NH3·H2O。
请回答下列问题
(1)“酸浸”时未发生的反应 物质是
(2)“滤液”中含有的阳离子有
(3)写出“反应Ⅰ”的化学方程式:
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:
更新时间:2020/01/01 22:15:20
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途径。
【实验1】用下图实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S。查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2。为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
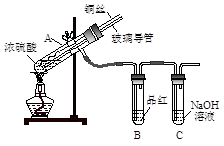

(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是_________________ 。
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有_____________ 。
(3)确定乙是否煅烧完全的操作是____________________________________________ 。
(4)煅烧过程中一定发生的化学反应方程式为__________________________________ 。
【实验2】某化学兴趣小组设计了如下实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱。
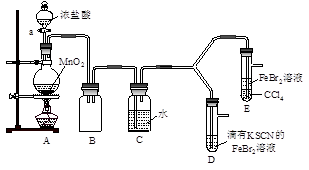
(5)根据下列实验操作和现象,填写实验结论。
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了异常的变化:D装置中,红色慢慢褪去;E装置中,CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因_________________ ;
请设计简单实验证明上述解释__________________________________________ 。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因______________________________ 。
【实验1】用下图实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S。查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2。为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:


(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有
(3)确定乙是否煅烧完全的操作是
(4)煅烧过程中一定发生的化学反应方程式为
【实验2】某化学兴趣小组设计了如下实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱。

(5)根据下列实验操作和现象,填写实验结论。
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了异常的变化:D装置中,红色慢慢褪去;E装置中,CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。 ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因
请设计简单实验证明上述解释
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】“证据推理”是化学实验的一般方法,某化学小组进行以下探究。
I.以亚硝酸钠(NaNO2)溶液为研究对象,探究HNO2的性质。(本实验稀硫酸均为1mol/LH2SO4)
II.探究HNO2和HNO3的氧化性
(1)写出实验4中溶液先变黄的离子方程式:_______ ,后变成棕色的离子方程式为:Fe2++NO⇌[Fe(NO)]2+。
(2)稍等片刻,实验5中溶液A中的棕色逐渐消失,请解释其原因:_______ 。
(3)根据实验4~7,可以得出有关HNO2和HNO3氧化性强弱的结论:
①不同浓度的HNO3溶液,浓HNO3氧化性强于稀HNO3。
②_______ 。
(4)另取试管甲,加入少量Cu粉,加入2mL1mol/L的NaNO2溶液,再滴入5滴稀硫酸,马上观察到Cu粉上和溶液里有大量气泡,溶液变浅蓝色,液面上方出现红棕色气体。再取试管乙,也加入少量Cu粉,加入2mL1mol/L的NaNO3,再滴入5滴稀硫酸,请预测实验现象:_______ 。
I.以亚硝酸钠(NaNO2)溶液为研究对象,探究HNO2的性质。(本实验稀硫酸均为1mol/LH2SO4)
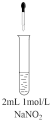 | 操作和现象 | 结论 |
| 实验1:滴入几滴 | 可推断HNO2为弱酸。 | |
| 实验2:滴入1mL0.1mol/LKMnO4溶液,开始仍为紫红色,再向溶液中滴加 | 可推断HNO2具有 | |
| 实验3:滴入5滴稀硫酸,溶液中很快就产生无色气泡,在液面上方出现红棕色气体。 | 可推断HNO2非常不稳定。写出此现象的化学方程式: |
 | 操作和现象 | 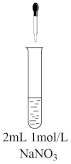 | 操作和现象 |
| 实验4:滴入5滴1mol/LFeSO4溶液(pH=0.5),溶液变黄,迅速变为棕色,再滴加KSCN溶液后溶液变红。(资料:[Fe(NO)]2+在溶液中呈棕色。) | 实验5:滴入5滴1mol/LFeSO4溶液(pH=0.5),几乎无现象。 将试管内溶液改为浓HNO3,重复上述操作,则溶液变黄,迅速变为棕色,得到溶液A。 | ||
| 实验6:滴入5滴淀粉碘化钾溶液,不变色,再滴入几滴稀硫酸,很快变蓝色。 | 实验7:滴入5滴淀粉碘化钾溶液,再滴入足量稀硫酸,仍然不变色。 将试管内溶液改为浓HNO3,滴入5滴淀粉碘化钾溶液,溶液很快变蓝。 |
(2)稍等片刻,实验5中溶液A中的棕色逐渐消失,请解释其原因:
(3)根据实验4~7,可以得出有关HNO2和HNO3氧化性强弱的结论:
①不同浓度的HNO3溶液,浓HNO3氧化性强于稀HNO3。
②
(4)另取试管甲,加入少量Cu粉,加入2mL1mol/L的NaNO2溶液,再滴入5滴稀硫酸,马上观察到Cu粉上和溶液里有大量气泡,溶液变浅蓝色,液面上方出现红棕色气体。再取试管乙,也加入少量Cu粉,加入2mL1mol/L的NaNO3,再滴入5滴稀硫酸,请预测实验现象:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】研究物质性质及物质转化具有重要的价值,根据所学知识回答下列问题:
(1)在一定条件下, 可与NaClO发生反应:
可与NaClO发生反应: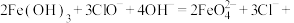
 ,在上述过程中
,在上述过程中 被
被___________ (填“氧化”或“还原”), 中Fe的化合价是
中Fe的化合价是___________ 价。
(2)按如图所示操作,充分反应后:___________ 。
②结合Ⅰ、Ⅱ实验现象可知, 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为___________ 。
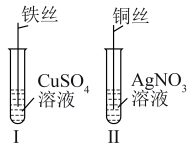
(3)焊接铜器时,可先用 溶液除去表面的CuO再进行焊接,该反应是
溶液除去表面的CuO再进行焊接,该反应是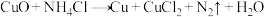 。
。
①配平该反应方程式: 。
。___________
②该反应的氧化剂是___________ (填化学式)。
(4)甲、乙两组同学对某实验后废液缸中所含的离子组成进行探究。其中检测结果分别为:
甲组同学检测得出:溶液中含有的离了组可能为 、
、 、
、 、
、 、
、 。
。
乙组同学检测得出:溶液中含有的离了组可能为 、
、 、
、 、
、 、
、 。
。
①上述两组同学的检测结果中有误的是___________ (填“甲组”或“乙组”)。
②在检测时,为了检验溶液中是否存在 ,可采取的措施为
,可采取的措施为___________ 。
(1)在一定条件下,
 可与NaClO发生反应:
可与NaClO发生反应: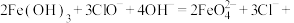
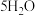 ,在上述过程中
,在上述过程中 被
被 中Fe的化合价是
中Fe的化合价是(2)按如图所示操作,充分反应后:
②结合Ⅰ、Ⅱ实验现象可知,
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(3)焊接铜器时,可先用
 溶液除去表面的CuO再进行焊接,该反应是
溶液除去表面的CuO再进行焊接,该反应是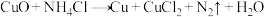 。
。①配平该反应方程式:
 。
。②该反应的氧化剂是
(4)甲、乙两组同学对某实验后废液缸中所含的离子组成进行探究。其中检测结果分别为:
甲组同学检测得出:溶液中含有的离了组可能为
 、
、 、
、 、
、 、
、 。
。乙组同学检测得出:溶液中含有的离了组可能为
 、
、 、
、 、
、 、
、 。
。①上述两组同学的检测结果中有误的是
②在检测时,为了检验溶液中是否存在
 ,可采取的措施为
,可采取的措施为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
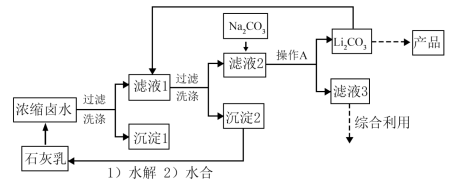
【推荐1】全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有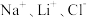 和少量
和少量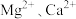 ),并设计了以下流程通过制备碳酸锂来提取锂。
),并设计了以下流程通过制备碳酸锂来提取锂。
 时相关物质的参数如下:
时相关物质的参数如下:  的溶解度:
的溶解度: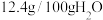
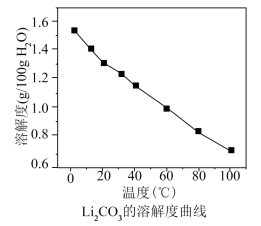
回答下列问题:
(1)“沉淀1”为_______ 。
(2)向“滤液1”中加入适量固体 的目的是
的目的是_______ 。
(3)为提高 的析出量和纯度,“操作A”依次为
的析出量和纯度,“操作A”依次为_______ 、_______ 、洗涤。
(4)有同学建议用“侯氏制碱法”的原理制备 。查阅资料后,发现文献对常温下的
。查阅资料后,发现文献对常温下的 有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究
有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究 的性质,将饱和
的性质,将饱和 溶液与饱和
溶液与饱和 溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。有关反应的离子方程式为
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。有关反应的离子方程式为_______ 。
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入 改为通入
改为通入 。这一改动能否达到相同的效果,作出你的判断并给出理由
。这一改动能否达到相同的效果,作出你的判断并给出理由_______ 。
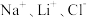 和少量
和少量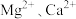 ),并设计了以下流程通过制备碳酸锂来提取锂。
),并设计了以下流程通过制备碳酸锂来提取锂。
 时相关物质的参数如下:
时相关物质的参数如下:  的溶解度:
的溶解度: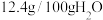
| 化合物 |  |  |  |  |
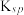 |  | 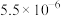 | 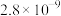 | 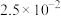 |

回答下列问题:
(1)“沉淀1”为
(2)向“滤液1”中加入适量固体
 的目的是
的目的是(3)为提高
 的析出量和纯度,“操作A”依次为
的析出量和纯度,“操作A”依次为(4)有同学建议用“侯氏制碱法”的原理制备
 。查阅资料后,发现文献对常温下的
。查阅资料后,发现文献对常温下的 有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究
有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究 的性质,将饱和
的性质,将饱和 溶液与饱和
溶液与饱和 溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。有关反应的离子方程式为
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。有关反应的离子方程式为(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入
 改为通入
改为通入 。这一改动能否达到相同的效果,作出你的判断并给出理由
。这一改动能否达到相同的效果,作出你的判断并给出理由
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】钼酸钠晶体( )用于制造生物碱、油墨、化肥、钼红颜料等,也可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。如图所示是利用钼精矿(要成分为
)用于制造生物碱、油墨、化肥、钼红颜料等,也可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。如图所示是利用钼精矿(要成分为 ,含少量PbS等)原料生产钼酸钠晶体的工艺流程图。
,含少量PbS等)原料生产钼酸钠晶体的工艺流程图。

(1) 中Mo的化合价为
中Mo的化合价为___________
(2)“焙烧”时,有 生成,反应的化学方程式为
生成,反应的化学方程式为___________ ,氧化产物是___________
(3)“碱浸”生成 和另外一种物质,
和另外一种物质, 的电子式为
的电子式为___________ ,另外一种生成物的化学式为___________
(4)若“除重金属离子”时加入的沉淀剂为 ,则废渣的成分为
,则废渣的成分为___________ (填化学式)
(5)测得“除重金属离子”中部分离子的浓度: “结晶”前应先除去
“结晶”前应先除去 ,方法是加入
,方法是加入 固体。假设加入
固体。假设加入 固体后溶液体积不变,当
固体后溶液体积不变,当 开始沉淀时,去除的
开始沉淀时,去除的 的质量分数为
的质量分数为___________ %。(保留小数点后一位数字)[已知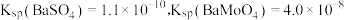 ]
]
(6)在碱性条件下,将钼精矿加入NaClO溶液中,也可以制备钼酸钠。该反应的离子方程式为___________ 。
 )用于制造生物碱、油墨、化肥、钼红颜料等,也可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。如图所示是利用钼精矿(要成分为
)用于制造生物碱、油墨、化肥、钼红颜料等,也可用于制造阻燃剂和无公害型冷却水系统的金属缓蚀剂。如图所示是利用钼精矿(要成分为 ,含少量PbS等)原料生产钼酸钠晶体的工艺流程图。
,含少量PbS等)原料生产钼酸钠晶体的工艺流程图。
(1)
 中Mo的化合价为
中Mo的化合价为(2)“焙烧”时,有
 生成,反应的化学方程式为
生成,反应的化学方程式为(3)“碱浸”生成
 和另外一种物质,
和另外一种物质, 的电子式为
的电子式为(4)若“除重金属离子”时加入的沉淀剂为
 ,则废渣的成分为
,则废渣的成分为(5)测得“除重金属离子”中部分离子的浓度:
 “结晶”前应先除去
“结晶”前应先除去 ,方法是加入
,方法是加入 固体。假设加入
固体。假设加入 固体后溶液体积不变,当
固体后溶液体积不变,当 开始沉淀时,去除的
开始沉淀时,去除的 的质量分数为
的质量分数为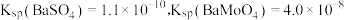 ]
](6)在碱性条件下,将钼精矿加入NaClO溶液中,也可以制备钼酸钠。该反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
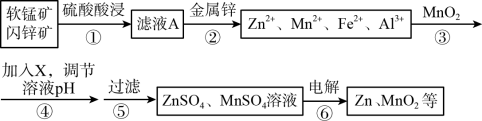
【推荐3】闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。软锰矿的主要成分为 MnO2;含少量A12O3和SiO2。现以闪锌矿和软猛矿为原料制备Zn和MnO2,其简化流程如下(中间产物的固体部分已经略去)。
已知:I.矿石中所有金属元素在滤液中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式________________________________ 。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_______________ 。
(3)步骤③与MnO2发生氧化还原反应的离子方程式_________________ ,物质X可以是__________ (用字母表示。
A.Cu2(OH)2CO3 B.MnCO3 C. MgO D.Zn(OH)2
(4)流程中可以循环利用的物质是____________ (填化学式)。
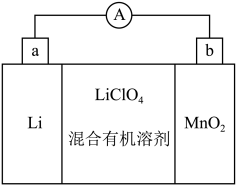
(5)MnO2与Li构成LiMnO2,该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
①外电路中的电子移动方向是由______ 极流向______ 极(填字母)。
②写出该锂离子电池的正极电极反应式_____________________________ 。
(6)已知:25℃时,HCN的电离常数K=4.9×10-10, H2S的电离常数K1=1.3×10-7,K2=7.0 ×10 -15,向NaCN溶液中通入少量的H2S气体,该反应的化学方程式为______________________ 。

已知:I.矿石中所有金属元素在滤液中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe,3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是
(3)步骤③与MnO2发生氧化还原反应的离子方程式
A.Cu2(OH)2CO3 B.MnCO3 C. MgO D.Zn(OH)2
(4)流程中可以循环利用的物质是
(5)MnO2与Li构成LiMnO2,该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
①外电路中的电子移动方向是由
②写出该锂离子电池的正极电极反应式
(6)已知:25℃时,HCN的电离常数K=4.9×10-10, H2S的电离常数K1=1.3×10-7,K2=7.0 ×10 -15,向NaCN溶液中通入少量的H2S气体,该反应的化学方程式为
您最近一年使用:0次



