研究性学习小组的同学,为测定某含铜3%~5%的铝铜合金(不含其它元素)中铜的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一]将铝铜合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___ 。
(2)称取5.4g铝铜合金粉末样品,溶于VmL2.0mol/LNaOH溶液中。为使其反应完全,则NaOH溶液的体积V≥___ mL。过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铜的质量分数将__ (填“偏高”、“偏低”或“无影响”)。
[方案二]将铝铜合金与足量稀硫酸溶液反应,用量筒或者量气管测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
(3)同学们拟选用图1实验装置完成实验:实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因___ 。
(4)实验结束时 ,生成氢气的体积近似等于___ 。
(5)锥形瓶中残存的氢气对实验结果是否有影响___ (填“有”“没有”或“不能判断”)
(6)同学们仔细分析图1实验装置后,经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了图2的实验装置。
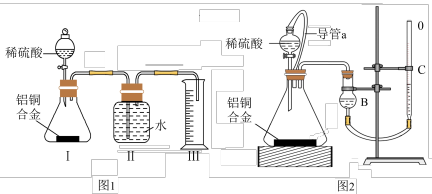
①装置中导管a的作用是___ 。
②实验中准确测定出实验前铝铜合金质量m1g,实验后铝铜合金质量m2g,产生的气体体积为(V2-V1)ml。利用上述数据计算通常状况下的气体摩尔体积:Vm=___ 。
[方案一]将铝铜合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是
(2)称取5.4g铝铜合金粉末样品,溶于VmL2.0mol/LNaOH溶液中。为使其反应完全,则NaOH溶液的体积V≥
[方案二]将铝铜合金与足量稀硫酸溶液反应,用量筒或者量气管测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
(3)同学们拟选用图1实验装置完成实验:实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因
(4)实验结束时 ,生成氢气的体积近似等于
(5)锥形瓶中残存的氢气对实验结果是否有影响
(6)同学们仔细分析图1实验装置后,经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了图2的实验装置。

①装置中导管a的作用是
②实验中准确测定出实验前铝铜合金质量m1g,实验后铝铜合金质量m2g,产生的气体体积为(V2-V1)ml。利用上述数据计算通常状况下的气体摩尔体积:Vm=
更新时间:2020-01-06 14:45:09
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】叠氨化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程:
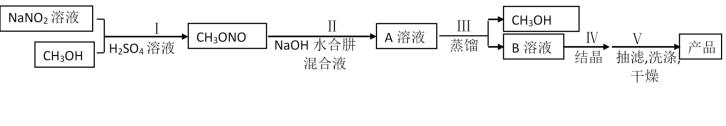
已知 能与
能与 反应生成白色难溶于水的
反应生成白色难溶于水的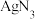 ;有关物质的物理性质如下表:
;有关物质的物理性质如下表:
请回答:
(1)步骤Ⅰ中 与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为另一种气体)的离子方程式为
与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为另一种气体)的离子方程式为___________ 。
(2)实验室模拟步骤Ⅱ实验装置如下图(装置中冷却水省略,下同):

①仪器a的名称___________ 。
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是___________ 。
③图中X处连接的最合适装置应为下图中的___________ (填标号)。

(3)步骤Ⅱ、Ⅲ中制备叠氮化钠并对溶液A进行蒸馏的合理操作顺序是___________ 。
①打开 、
、 ,关闭
,关闭 ②打开
②打开 ③加热④关闭
③加热④关闭 、
、
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的三分之一, 结晶析出。
结晶析出。
①步骤V可以用___________ 洗涤晶体。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
②沉淀滴定法测定产品纯度,是以淡黄色 溶液作指示剂,将
溶液作指示剂,将 标准溶液滴入样品溶液,至有少量
标准溶液滴入样品溶液,至有少量 出现,即溶液呈淡红色为终点。下列操作或说法合理的是
出现,即溶液呈淡红色为终点。下列操作或说法合理的是___________ (填标号)。
A.滴定管和移液管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数会导致测定结果偏高
E.若发现滴液过量,可回滴样品溶液,至红色褪去

已知
 能与
能与 反应生成白色难溶于水的
反应生成白色难溶于水的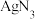 ;有关物质的物理性质如下表:
;有关物质的物理性质如下表:熔点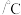 | 沸点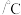 | 溶解性 | |
 |  | 64.7 | 与水互溶 |
水合肼( ) ) | 2 | 113.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯(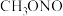 ) ) | 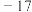 | 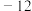 | 溶于乙醚、氯仿 |
请回答:
(1)步骤Ⅰ中
 与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为另一种气体)的离子方程式为
与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为另一种气体)的离子方程式为(2)实验室模拟步骤Ⅱ实验装置如下图(装置中冷却水省略,下同):

①仪器a的名称
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是
③图中X处连接的最合适装置应为下图中的

(3)步骤Ⅱ、Ⅲ中制备叠氮化钠并对溶液A进行蒸馏的合理操作顺序是
①打开
 、
、 ,关闭
,关闭 ②打开
②打开 ③加热④关闭
③加热④关闭 、
、
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的三分之一,
 结晶析出。
结晶析出。①步骤V可以用
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
②沉淀滴定法测定产品纯度,是以淡黄色
 溶液作指示剂,将
溶液作指示剂,将 标准溶液滴入样品溶液,至有少量
标准溶液滴入样品溶液,至有少量 出现,即溶液呈淡红色为终点。下列操作或说法合理的是
出现,即溶液呈淡红色为终点。下列操作或说法合理的是A.滴定管和移液管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数会导致测定结果偏高
E.若发现滴液过量,可回滴样品溶液,至红色褪去
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某课外活动小组测定了某工厂工业废水中游离态氯的含量,下面是测定实验分析报告:
(一)测定目的:测定工厂工业废水中的游离态氯的含量
(二)测定原理:Cl2+2KI=2KCl+I2;I2+2Na2S2O3=2NaI+Na2S4O6
(三)实验用品及试剂:
(1)仪器和用品(自选,略)
(2)试剂:指示剂_______ (填名称),KI溶液,浓度为0.010 mol·L-1的标准Na2S2O3溶液,蒸馏水等。
(四)实验过程:
(1)取水样10.00 mL 于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2~3滴。
(2)取碱式滴定管(经检查不漏水),依次用自来水、蒸馏水洗净,然后注入0.010 mol·L-1Na2S2O3溶液待用。
(3)将锥形瓶置于滴定管下方进行滴定,眼睛注视_______ 直至滴定终点,滴定至终点的现象是_______ 。
(五)数据记录与处理:(请在表格中的横线上填上必要的物理量,不必填数据)
若经数据处理,滴定中消耗标准的Na2S2O3溶液的体积平均是20.00 mL,则废水中Cl2的物质的量浓度为_______ ,从实验过程分析,此浓度比实际浓度_______ (填“偏大”、“偏小”或“相等”),造成误差的原因是_______ (若认为没有误差,该问可不答)。
(六)问题和讨论:
实验结束后,发现个别同学结果误差较大,其所测游离态氯的含量较废水中Cl2的含量低。经过思考,该同学提出了下列可能造成结果偏小的原因,其中你认为正确的是_______ (填编号)。
①滴定前,滴定管嘴尖嘴处有气泡,滴定后气泡消失
②滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外
③滴定前平视Na2S2O3液面,滴定后俯视Na2S2O3液面
(一)测定目的:测定工厂工业废水中的游离态氯的含量
(二)测定原理:Cl2+2KI=2KCl+I2;I2+2Na2S2O3=2NaI+Na2S4O6
(三)实验用品及试剂:
(1)仪器和用品(自选,略)
(2)试剂:指示剂
(四)实验过程:
(1)取水样10.00 mL 于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2~3滴。
(2)取碱式滴定管(经检查不漏水),依次用自来水、蒸馏水洗净,然后注入0.010 mol·L-1Na2S2O3溶液待用。
(3)将锥形瓶置于滴定管下方进行滴定,眼睛注视
(五)数据记录与处理:(请在表格中的横线上填上必要的物理量,不必填数据)
| 滴定次数 | |||||
| 平均值 | |||||
| 1 | 10.00 | ||||
| 2 | 10.00 | ||||
| 3 | 10.00 | ||||
(六)问题和讨论:
实验结束后,发现个别同学结果误差较大,其所测游离态氯的含量较废水中Cl2的含量低。经过思考,该同学提出了下列可能造成结果偏小的原因,其中你认为正确的是
①滴定前,滴定管嘴尖嘴处有气泡,滴定后气泡消失
②滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外
③滴定前平视Na2S2O3液面,滴定后俯视Na2S2O3液面
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,按照如图的工艺流程,将尾气中的SO2转化为有用的副产品。请回答下列问题。
(1)写出氨吸收塔中主要发生的化学方程式_____ 。
(2)写出二氧化硫吸收塔中主要发生的离子方程式_____ 。
(3)当含SO2烟气通入二氧化硫吸收塔中,可能发生氧化还原反应吗_____ ?如可能,请写出至少一个氧化还原反应的化学方程式_____ 。
(4)上述流程可循环利用的物质是什么_____ ?
(5)在氨吸收塔中,反应所得到的高浓度溶液中,按一定比例再加入氨水,此时溶液的温度会自行降低,并析出晶体。
①导致溶液温度降低的原因可能是什么_____ ?
②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,计算其化学式_____ 。
③生产中得到的结晶水合物测定其相对分子质量往往会偏大,分析可能的原因_____ 。

(1)写出氨吸收塔中主要发生的化学方程式
(2)写出二氧化硫吸收塔中主要发生的离子方程式
(3)当含SO2烟气通入二氧化硫吸收塔中,可能发生氧化还原反应吗
(4)上述流程可循环利用的物质是什么
(5)在氨吸收塔中,反应所得到的高浓度溶液中,按一定比例再加入氨水,此时溶液的温度会自行降低,并析出晶体。
①导致溶液温度降低的原因可能是什么
②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,计算其化学式
③生产中得到的结晶水合物测定其相对分子质量往往会偏大,分析可能的原因
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室中可通过NaHSO3的过饱和溶液经结晶制得。
实验I.焦亚硫酸钠的制备
(1)实验室制备少量Na2S2O5的装置如图1所示

①装置Y的作用是___________ 。
②制取Na2S2O5的反应分两步进行,其中第二步为2NaHSO3=Na2S2O5+H2O,则第一步的离子方程式为___________ 。
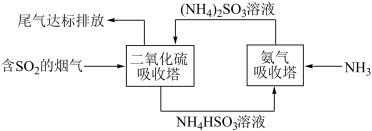
(2)已知:水溶液中H2SO3、HSO 、SO
、SO 的物质的量分数随pH变化分布如图2所示。请补充完整制取Na2S2O5固体的实验方案:
的物质的量分数随pH变化分布如图2所示。请补充完整制取Na2S2O5固体的实验方案:
打开磁力搅拌器,将装有Na2CO3过饱和溶液的锥形瓶至于40℃水浴中,___________ ,可得Na2S2O5固体。(须使用的试剂:SO2、SO2饱和溶液)
实验II.焦亚硫酸钠的性质
(3)长期放置的Na2S2O5固体会部分被氧化成Na2SO4而发生变质。请设计检验Na2S2O5样品是否变质的实验方案___________ 。(已知Na2S2O5、Na2SO3分别与稀硫酸反应得到的产物相同)
实验III.焦亚硫酸钠的测定
(4)某小组通过下述方法检测某饮料中抗氧化剂Na2S2O5残留的含量,步骤如下:
步骤一:取样品100.00mL于锥形瓶中,加入稀硫酸后蒸馏,使SO2全部逸出,馏分用25 mL 0.02 mol·L-1的I2溶液吸收。
步骤二:向吸收液中滴加0.01 mol·L-1的Na2S2O3标准溶液与I2发生反应2S2O +I2=2I-+S4O
+I2=2I-+S4O ,滴定至终点时消耗Na2S2O3标准溶液20.00 mL。
,滴定至终点时消耗Na2S2O3标准溶液20.00 mL。
样品中Na2S2O5的残留量为___________ g·L-1。(写出计算过程)
实验I.焦亚硫酸钠的制备
(1)实验室制备少量Na2S2O5的装置如图1所示

①装置Y的作用是
②制取Na2S2O5的反应分两步进行,其中第二步为2NaHSO3=Na2S2O5+H2O,则第一步的离子方程式为
(2)已知:水溶液中H2SO3、HSO
 、SO
、SO 的物质的量分数随pH变化分布如图2所示。请补充完整制取Na2S2O5固体的实验方案:
的物质的量分数随pH变化分布如图2所示。请补充完整制取Na2S2O5固体的实验方案:
打开磁力搅拌器,将装有Na2CO3过饱和溶液的锥形瓶至于40℃水浴中,
实验II.焦亚硫酸钠的性质
(3)长期放置的Na2S2O5固体会部分被氧化成Na2SO4而发生变质。请设计检验Na2S2O5样品是否变质的实验方案
实验III.焦亚硫酸钠的测定
(4)某小组通过下述方法检测某饮料中抗氧化剂Na2S2O5残留的含量,步骤如下:
步骤一:取样品100.00mL于锥形瓶中,加入稀硫酸后蒸馏,使SO2全部逸出,馏分用25 mL 0.02 mol·L-1的I2溶液吸收。
步骤二:向吸收液中滴加0.01 mol·L-1的Na2S2O3标准溶液与I2发生反应2S2O
 +I2=2I-+S4O
+I2=2I-+S4O ,滴定至终点时消耗Na2S2O3标准溶液20.00 mL。
,滴定至终点时消耗Na2S2O3标准溶液20.00 mL。样品中Na2S2O5的残留量为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下:
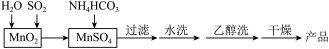
已知:MnCO3难溶于水和乙醇,受热易分解。
(1)实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、___ 。
(2)①检验水洗是否合格的方法是___ 。
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为___ ;图中点D对应固体的成分为___ (填化学式)。


已知:MnCO3难溶于水和乙醇,受热易分解。
(1)实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、
(2)①检验水洗是否合格的方法是
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为

您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】NOCl(名称为亚硝酰氯,熔点为-64.5℃,沸点为-5.5℃)是有机物合成中的重要试剂,为红褐色液体或黄色气体,遇水发生反应:2NOCl+H2O=NO+NO2+2HCl。某学习小组在实验室用Cl2和NO按如图装置制备NOCl,并测定其纯度。请回答下列问题:

(1)仪器a的名称是______ ;a中反应的离子方程式为_______ 。
(2)试剂Y为______ ;如果G中浓盐酸液体不能顺利流下,可采取的措施______ 。
(3)从三颈烧瓶逸出的尾气先通入浓硫酸再通入NaOH溶液吸收,须要先通入浓硫酸原因是______ 。
(4)NOCl与NaOH溶液反应的化学方程式为______ 。(已知:NO+NO2+2NaOH=2NaNO2+H2O)
(5)测量产物NOCl纯度:取三颈烧瓶中所得产物mg溶于水,配制成250mL溶液,取出25.00mL,用cmol•L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为VmL,产物中NOCl纯度的计算式为______ 。

(1)仪器a的名称是
(2)试剂Y为
(3)从三颈烧瓶逸出的尾气先通入浓硫酸再通入NaOH溶液吸收,须要先通入浓硫酸原因是
(4)NOCl与NaOH溶液反应的化学方程式为
(5)测量产物NOCl纯度:取三颈烧瓶中所得产物mg溶于水,配制成250mL溶液,取出25.00mL,用cmol•L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为VmL,产物中NOCl纯度的计算式为
您最近半年使用:0次



