某同学为了验证海带中含有碘元素,拟进行如下实验,请完成相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中不会用到的实验仪器有__ (填代号)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架 E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是__ 。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用__ (填代号)。
A.浓硫酸 B.新制氯水
C.酸性高锰酸钾溶液 D.过氧化氢溶液
理由是__ 。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含有碘元素。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中不会用到的实验仪器有
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架 E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用
A.浓硫酸 B.新制氯水
C.酸性高锰酸钾溶液 D.过氧化氢溶液
理由是
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含有碘元素。
19-20高一·全国·单元测试 查看更多[2]
人教版高中化学必修二第四单元《化学与自然资源的开发利用》测试卷(已下线)8.1.2 海水资源的开发利用(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)
更新时间:2020-01-29 17:45:15
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
【推荐1】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验Ⅰ 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
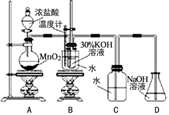
(1)盛放浓盐酸的实验仪器名称是________________ 。
(2)A中发生反应的化学反应方程式是_______________ 。
(3)B中生成氯酸钾的离子反应方程式是_____________ 。
(4)若对调B和C装置的位置,______ (填“能”或“不能”)提高B中氯酸钾的产率,原因是_____________ 。
实验Ⅱ 测定圆底烧瓶中反应残余液中盐酸的浓度
圆底烧瓶中所发生的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:采用酸碱中和滴定法测定。
乙方案:与足量Zn反应,测量生成的H2体积。
继而进行下列实验:
①进行甲方案实验:准确量取冷却后的残余清液,稀释一定的倍数后作为试样。
a.量取试样20.00mL,用0.10 mol·L—1NaOH标准溶液滴定,到达滴定终点时,消耗标准溶液24.00mL,则该次滴定所测的试样中盐酸浓度为__________ ;
b.重复滴定三次后获得实验结果。
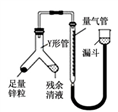
②进行乙方案实验:装置如右图所示(夹持器具已略去)。
(ⅰ)使Y形管中的残余清液与锌粒反应的正确操作是将_________
转移到_________ 中,否则会造成实验结果偏低。(ⅱ)反应完毕,读取H2的体积,读数时应注意:a.冷却至室温,b.________________ c.视线与凹液面最低处相切。
实验Ⅰ 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。

(1)盛放浓盐酸的实验仪器名称是
(2)A中发生反应的化学反应方程式是
(3)B中生成氯酸钾的离子反应方程式是
(4)若对调B和C装置的位置,
实验Ⅱ 测定圆底烧瓶中反应残余液中盐酸的浓度
圆底烧瓶中所发生的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:采用酸碱中和滴定法测定。
乙方案:与足量Zn反应,测量生成的H2体积。
继而进行下列实验:
①进行甲方案实验:准确量取冷却后的残余清液,稀释一定的倍数后作为试样。

a.量取试样20.00mL,用0.10 mol·L—1NaOH标准溶液滴定,到达滴定终点时,消耗标准溶液24.00mL,则该次滴定所测的试样中盐酸浓度为
b.重复滴定三次后获得实验结果。
②进行乙方案实验:装置如右图所示(夹持器具已略去)。
(ⅰ)使Y形管中的残余清液与锌粒反应的正确操作是将
转移到
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
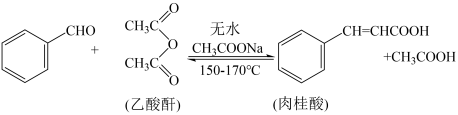
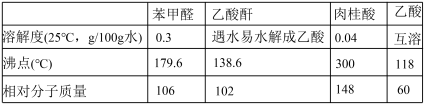
【推荐2】肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料。实验室可用苯甲醛和乙酸酐、醋酸钠等原料经下列反应制取肉桂酸,其中苯甲醛为无色油状液体。已知:
填空:
Ⅰ.合成:反应装置如图所示。向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀。在150~170℃加热1小时,保持微沸状态。
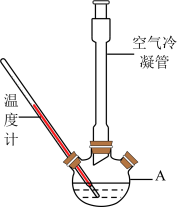
(1)仪器A的名称为___ 。
(2)空气冷凝管的作用是__ ,该装置加热要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是__ 。
(3)不能把无水CH3COONa换成CH3COONa·3H2O的原因是__ 。
Ⅱ.粗品精制:已知水蒸气蒸馏是分离提纯有机化合物的重要方法之一,可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的。
将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
a.在搅拌下,向反应液中加入20mL水
b.再慢慢加入碳酸钠溶液
c.然后进行水蒸气蒸馏
d.待烧瓶内溶液冷却至室温,在搅拌下用加入盐酸酸化,析出大量晶体,过滤,洗涤,干燥。
(4)饱和Na2CO3溶液的作用有__ 。水蒸气蒸馏可除去的杂质是__ ;如何判断蒸馏终点___ 。
(5)若得到的肉桂酸晶体产品不纯,应采用__ 可得到纯度更高的产品。
(6)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是__ (保留两位有效数字)。


填空:
Ⅰ.合成:反应装置如图所示。向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀。在150~170℃加热1小时,保持微沸状态。

(1)仪器A的名称为
(2)空气冷凝管的作用是
(3)不能把无水CH3COONa换成CH3COONa·3H2O的原因是
Ⅱ.粗品精制:已知水蒸气蒸馏是分离提纯有机化合物的重要方法之一,可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的。
将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
a.在搅拌下,向反应液中加入20mL水
b.再慢慢加入碳酸钠溶液
c.然后进行水蒸气蒸馏
d.待烧瓶内溶液冷却至室温,在搅拌下用加入盐酸酸化,析出大量晶体,过滤,洗涤,干燥。
(4)饱和Na2CO3溶液的作用有
(5)若得到的肉桂酸晶体产品不纯,应采用
(6)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如图实验:

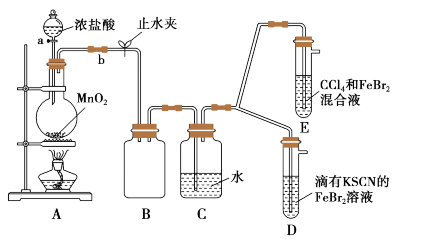
(1)①装置A中发生反应的离子方程式是__ 。
②整套实验装置存在一处明显的不足,请指出__ 。
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,E中发生了新的变化 。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式 (离子或化学方程式不限定)解释产生白色沉淀原因__ 、__ 。


(1)①装置A中发生反应的离子方程式是
②整套实验装置存在一处明显的不足,请指出
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由 |
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
| i.Cl2和Br2反应生成BrCl,BrCl呈红色,沸点约5℃,它与水能反应,且该反应为非氧化还原反应。 ii.AgClO、AgBrO均可溶于水。 iii.溴化银为淡黄色沉淀 |
您最近一年使用:0次
【推荐1】海带中含有碘元素,从海带中提取碘并验证其性质。提取过程如图所示:
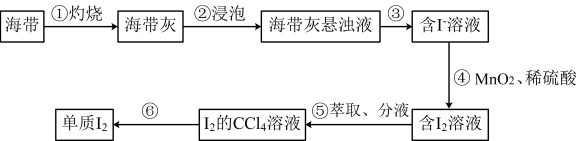
(1)验证“含 溶液”和“含
溶液”和“含 溶液”中含有的
溶液”中含有的 和
和 所需的试剂分别是
所需的试剂分别是______ 和_______ 。
(2)步骤④的反应中 被还原为
被还原为 ,反应的离子方程式为
,反应的离子方程式为__________ ; 、稀硫酸可用
、稀硫酸可用_______ 代替。
a. b.
b. c.
c. 、稀硫酸 d.
、稀硫酸 d.
(3)海带灰中含有的可溶性硫酸盐、碳酸盐等,在实验步骤___________ (填序号)中实现与碘分离。
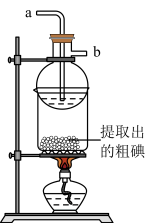
(4)某同学制得的粗碘中含有少量 ,对粗碘进行提纯的装置如图所示,采用的分离方法是
,对粗碘进行提纯的装置如图所示,采用的分离方法是________ ;a、b为冷凝水进出口,其中__________ (填“a”或“b”)接水龙头,最终能得到较多较高纯度的单质碘。

(1)验证“含
 溶液”和“含
溶液”和“含 溶液”中含有的
溶液”中含有的 和
和 所需的试剂分别是
所需的试剂分别是(2)步骤④的反应中
 被还原为
被还原为 ,反应的离子方程式为
,反应的离子方程式为 、稀硫酸可用
、稀硫酸可用a.
 b.
b. c.
c. 、稀硫酸 d.
、稀硫酸 d.
(3)海带灰中含有的可溶性硫酸盐、碳酸盐等,在实验步骤
(4)某同学制得的粗碘中含有少量
 ,对粗碘进行提纯的装置如图所示,采用的分离方法是
,对粗碘进行提纯的装置如图所示,采用的分离方法是
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。
实验室里从海洋植物中提取碘的流程如下:

某化学兴趣小组将上述流程②③设计成如图所示。

回答下列问题:已知氯水中含有 ,回答下列问题:
,回答下列问题:
(1)写出提取过程①③中实验操作的名称:①___________ ,③___________ 。
(2)②中发生反应的化学方程式为:___________ 。
(3)F中上层液体中溶质的主要成分为___________ 。
(4)从F中得到固态碘还需进行的操作是___________ 、___________ 。
(5)在灼烧过程中,将使用到的(除泥三角外)实验仪器有___________ (填字母)
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯
实验室里从海洋植物中提取碘的流程如下:

某化学兴趣小组将上述流程②③设计成如图所示。

回答下列问题:已知氯水中含有
 ,回答下列问题:
,回答下列问题:(1)写出提取过程①③中实验操作的名称:①
(2)②中发生反应的化学方程式为:
(3)F中上层液体中溶质的主要成分为
(4)从F中得到固态碘还需进行的操作是
(5)在灼烧过程中,将使用到的(除泥三角外)实验仪器有
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
【推荐3】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
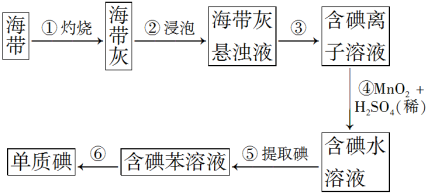
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是_______ (从下列仪器中选出所需的仪器,将标号字母填写在空白处)。
A.烧杯 B.表面皿 C.坩埚 D.酒精灯 E.干燥器
(2)步骤④一定发生的化学反应类型是_______ 。
A.化合反应 B.分解反应 C.氧化还原反应
(3)步骤⑤所用的主要仪器是_______ 。步骤③的实验操作名称是_______ 。
(4)①~⑥操作中,使用玻璃棒的是_______ (填序号)。
(5)请设计简单实验,验证⑤提取碘后的水溶液中是否含有碘单质_______ 。

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是
A.烧杯 B.表面皿 C.坩埚 D.酒精灯 E.干燥器
(2)步骤④一定发生的化学反应类型是
A.化合反应 B.分解反应 C.氧化还原反应
(3)步骤⑤所用的主要仪器是
(4)①~⑥操作中,使用玻璃棒的是
(5)请设计简单实验,验证⑤提取碘后的水溶液中是否含有碘单质
您最近一年使用:0次



