某厂平均每天产生约600m3废氨水(NH3的浓度为153mg·L-1,密度为1g·cm-3。)
(1)该废氨水中氨的物质的量浓度为_________ 。
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3的浓度降为17 mg·L-1。忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为_________ 。(以下计算结果均保留两位小数)
(3)蒸发得到的NH3可用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。
①为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为________ 。
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2→2N2+6H2O。将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1∶10,试求参加主反应的氨占原料氨的体积百分含量_______ 。
(4)废氨水可用于脱除烟气中的SO2。氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物。现称取不同质量的混合物进行实验,结果如下:
试计算生成氨气的质量最大时样品的质量________ 。
(1)该废氨水中氨的物质的量浓度为
(2)对废氨水进行加热蒸发得到NH3,使废氨水中的NH3的浓度降为17 mg·L-1。忽略蒸发前后废氨水体积变化,则上述体积的废氨水蒸发出来的NH3的物质的量为
(3)蒸发得到的NH3可用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。
①为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为
②氨催化氧化制取NO同时会发生副反应:4NH3+3O2→2N2+6H2O。将1L NH3混合10L空气后通入反应器,反应完成后,测得混合气体中不含NH3,而O2和N2的物质的量之比为1∶10,试求参加主反应的氨占原料氨的体积百分含量
(4)废氨水可用于脱除烟气中的SO2。氨水吸收烟气中SO2经氧化后生成(NH4)2SO4和NH4HSO4混合物。现称取不同质量的混合物进行实验,结果如下:
| NaOH溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
试计算生成氨气的质量最大时样品的质量
14-15高三上·上海宝山·阶段练习 查看更多[1]
(已下线)上海市行知中学2015届高三上学期第二次月考化学试题
更新时间:2020-03-22 23:28:40
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】淀粉是人类膳食中糖类的主要来源,在体内被酶水解为葡萄糖(C6H12O6)供机体利用。某病人血液化验单如图所示,其中葡萄糖测定值明显高于正常值(参考范围)。请回答下列问题:
(1)27g葡萄糖中含碳原子的物质的量为__ ,含氢原子数为__ 。
(2)0.5mol葡萄糖在人体内完全转化为二氧化碳的体积(标准状况)是___ 。
(3)该病人血清葡萄糖的物质的量浓度为___ 。
(4)把淀粉溶液溶于沸水中,制成淀粉胶体。鉴别葡萄糖溶液和淀粉胶体的方法是___ ,提纯、精制胶体的方法是___ 。
| ××医院化验单 | |||
| 姓名:××× | |||
| 项目 | 测定值 | 单位 | 参考范围 |
| 丙氨酸氨基转氨酶ALT | 35 | U/L | 9~50 |
| 血清葡萄糖GLU | 216↑ | mg/dl | 60~110 |
| 甘油三酯TG | 217↑ | mg/dl | 50~200 |
| 总胆固醇TCH | 179 | mg/dl | 150~220 |
| 注:1dl=100mL | |||
(1)27g葡萄糖中含碳原子的物质的量为
(2)0.5mol葡萄糖在人体内完全转化为二氧化碳的体积(标准状况)是
(3)该病人血清葡萄糖的物质的量浓度为
(4)把淀粉溶液溶于沸水中,制成淀粉胶体。鉴别葡萄糖溶液和淀粉胶体的方法是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】把 17.1g 固体氢氧化钡溶于水,配成 250mL 溶液,则该溶液的物质的量浓度是____ mol/L;取出 10mL溶液,其中 c(Ba2+)=_____ mol/L;把取出的 10mL 溶液加水稀释到 100mL,稀释后溶液物质的量浓度是_____ mol/L,其中所含溶质质量为____ g。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)最近材料科学家发现了首例带结晶水的晶体在5K下呈现超导性。该晶体的化学式为Na0.35CoO2·1.3H2O(该晶体的摩尔质量为122g·mol-1),若用NA表示阿伏加 德罗常数,则12.2g该晶体中含氧原子数为___ ,氢原子的物质的量为___ mol。
(2)FeCl3溶液可以用来净水,用100mL2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数___ (填“大于”“等于”或“小于”)0.2NA。
(3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=___ mol/L(用以上字母表示,且必须化简)。
(4)工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应:NaClO2+HCl→ClO2↑+NaCl+H2O。写出配平的化学方程式____ 。
(5)向100mL的FeBr2溶液中通入标准状况下Cl23.36L(已知还原性:Fe2+>Br-),反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为____ mol/L。反应的离子方程式为____ 。
(6)若向盛有10mL1mol·L-1NH4Al(SO4)2溶液的烧杯中加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____ mol。
(2)FeCl3溶液可以用来净水,用100mL2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数
(3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=
(4)工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应:NaClO2+HCl→ClO2↑+NaCl+H2O。写出配平的化学方程式
(5)向100mL的FeBr2溶液中通入标准状况下Cl23.36L(已知还原性:Fe2+>Br-),反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为
(6)若向盛有10mL1mol·L-1NH4Al(SO4)2溶液的烧杯中加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)在无土栽培中,需配制500mL含有NH 、K+、Cl-、SO
、K+、Cl-、SO 的植物培养液。且要求该培养液中c(Cl-)=c(K+)=c(SO
的植物培养液。且要求该培养液中c(Cl-)=c(K+)=c(SO )=0.4mol•L-1.该培养液中,c(NH
)=0.4mol•L-1.该培养液中,c(NH )=
)=_______ mol•L-1.若用K2SO4、NH4Cl、(NH4)2SO4配制培养液,则需_______ g(NH4)2SO4。
(2)已知质量分数为98%的浓硫酸,其物质的量浓度为18.4mol•L-1,则该浓硫酸的密度_______ g•cm-3。若某硫酸的质量分数为49%,则其物质的量浓度_______ (填“大于”“小于”或“等于”,下同)9.2mol•L-1;若某硫酸的物质的量浓度为9.2mol•L-1,则其质量分数_______ 49%。
(3)在一定温度和压强下,3.6g石墨和6.4g氧气充分反应至固体无剩余,所得产物为_______ 。若将该产物用200mL2mol•L-1NaOH溶液充分吸收,则所得溶液中c(CO )=
)=_______ mol•L-1(不考虑溶液体积的变化)。
(1)在无土栽培中,需配制500mL含有NH
 、K+、Cl-、SO
、K+、Cl-、SO 的植物培养液。且要求该培养液中c(Cl-)=c(K+)=c(SO
的植物培养液。且要求该培养液中c(Cl-)=c(K+)=c(SO )=0.4mol•L-1.该培养液中,c(NH
)=0.4mol•L-1.该培养液中,c(NH )=
)=(2)已知质量分数为98%的浓硫酸,其物质的量浓度为18.4mol•L-1,则该浓硫酸的密度
(3)在一定温度和压强下,3.6g石墨和6.4g氧气充分反应至固体无剩余,所得产物为
 )=
)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】室温下,50 mL pH = 1的稀H2SO4和盐酸的混合液与50 mL Ba(OH)2溶液相混合,充分反应后过滤,得0.466 g沉淀,滤液的pH值变为13。求:
(1)原混合液中SO42-和Cl-的物质的量 ,
(2)Ba(OH)2溶液的物质的量浓度
(1)原混合液中SO42-和Cl-的物质的量 ,
(2)Ba(OH)2溶液的物质的量浓度
您最近一年使用:0次
填空题
|
适中
(0.65)
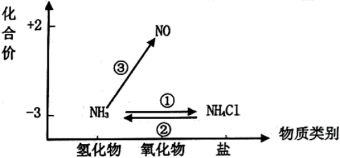
【推荐1】元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。 依据下图中氮元素及其化合物的转化关系,回答下列问题:
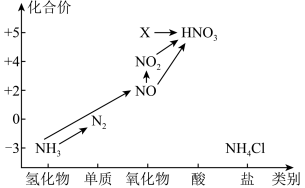
(1)上图中,X 的化学式为______________ ;从化合价上看,X 具有_____________ 性(填 “氧化”或“还原”)。
(2)回答下列关于 NH3的问题:
①实验室常用 NH4Cl 与 Ca(OH)2制备氨气,写出该反应的化学方程式_______________________ 。
②下列试剂不能用于干燥NH3的是__________________ (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
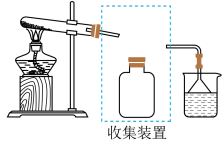
③若要收集一瓶氨气,请将下图装置补充完整,画出虚框内连接图_____________________ 。
④氨气是重要的化工原料,可以合成多种物质,请写出其在工业上制备硝酸的第一步反应____________ 。
(3)回答下列关于 NO、NO2 的问题:
①NO 和 NO2按一定比例混合可以被 NaOH 溶液完全吸收,主要反应如下:NO+NO2+2OH-=2 +H2O,2NO2+2OH-=
+H2O,2NO2+2OH-= +
+ +H2O。根据上述反应,NO 和 NO2完全被NaOH溶液吸收时的体积比可能为
+H2O。根据上述反应,NO 和 NO2完全被NaOH溶液吸收时的体积比可能为_______________ (填字母)。
a.=1:1 b.>1:1 c.<1:1
②尾气处理时,下列措施能够提高尾气中NO和NO2去除率的有__________________ 。
A.加快通入尾气的速率 B.采用气、液逆流的方式吸收尾气 C.尾气吸收过程中定期补加适量 NaOH 溶液

(1)上图中,X 的化学式为
(2)回答下列关于 NH3的问题:
①实验室常用 NH4Cl 与 Ca(OH)2制备氨气,写出该反应的化学方程式
②下列试剂不能用于干燥NH3的是
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将下图装置补充完整,画出虚框内连接图

④氨气是重要的化工原料,可以合成多种物质,请写出其在工业上制备硝酸的第一步反应
(3)回答下列关于 NO、NO2 的问题:
①NO 和 NO2按一定比例混合可以被 NaOH 溶液完全吸收,主要反应如下:NO+NO2+2OH-=2
 +H2O,2NO2+2OH-=
+H2O,2NO2+2OH-= +
+ +H2O。根据上述反应,NO 和 NO2完全被NaOH溶液吸收时的体积比可能为
+H2O。根据上述反应,NO 和 NO2完全被NaOH溶液吸收时的体积比可能为a.=1:1 b.>1:1 c.<1:1
②尾气处理时,下列措施能够提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率 B.采用气、液逆流的方式吸收尾气 C.尾气吸收过程中定期补加适量 NaOH 溶液
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。实验室制取氨的装置如图所示,请回答下列问题:

(1)实验室制取氨的过程中不需要用到的实验用品是
(2)实验时主要操作步骤为:①加热制取氨 ②收集氨 ③检查装置气密性。下列选项中正确的实验操作顺序是
(3)此装置中收集氨的方法为
(4)下列关于氨性质的叙述中错误的是
(5)将大气中游离态的氨转化为氮的化合物的过程叫做氮的固定。下列过程中不属于氮的固定的是
(6)下列关于铵盐的叙述中错误的是

(1)实验室制取氨的过程中不需要用到的实验用品是
| A.试管 | B.酒精灯 | C.铁架台 | D.胶头滴管 |
| A.③①② | B.①③② | C.①②③ | D.②①③ |
| A.向上排空气法 | B.向下排空气法 | C.排水法 | D.排饱和氯化钠溶液法 |
| A.氨是无色、无味的气体 | B.氨易液化,液氨可用作制冷剂 |
| C.氨能使湿润的红色石蕊试纸变蓝 | D.氨可以与酸反应生成铵盐 |
A.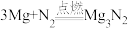 | B. |
C.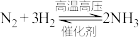 | D. |
| A.铵盐是农业上常用的化肥 | B.绝大多数铵盐受热易分解 |
| C.绝大多数铵盐难溶于水 | D.绝大多数铵盐与碱反应放出氨 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】铁及其化合物是重要的化学物质,如天然磁石中含有较多的Fe3O4、三水合草酸合铁(Ⅲ)酸钾{K3[Fe(C2O4)3]·3H2O,呈绿色,可溶于水,难溶于乙醇,见光易分解}常用于化学光量计、绿矾(FeSO4·7H2O)是常用的还原剂。回答下列问题:
(1)电子工业中,常用氯化铁溶液腐蚀铜制造印刷电路板,该原理的离子方程式为_____ 。
(2)根据化合价及元素的性质,Na2S5可以改写为Na2S·4S、Fe3O4可以改写为FeO·Fe2O3,则Fe3Cl8可以改写为_____ 、Fe3I8可以改写为_____ 。
(3)可通过下列两个步骤制备三水合草酸合铁(Ⅲ)酸钾晶体。
步骤i:向盛有3.00g黄色晶体FeC2O4·2H2O的烧杯中,加入10.00mLK2C2O4溶液,加热至40℃左右,缓慢滴入过量的H2O2,一段时间后,出现红褐色沉淀。
步骤ii:加热至沸腾,分两次缓慢加入8.00~9.00mLH2C2O4溶液,至沉淀溶解,得到绿色溶液。加热浓缩、加入无水乙醇、结晶,抽滤干燥得7.860g三水合草酸合铁(III)酸钾晶体。
①步骤ⅰ中,生成三草酸合铁酸钾与另一种铁的化合物,该化合物为_____ (填化学式)。
②步骤ⅱ加入无水乙醇的目的是_____ 。
③实验小组完成实验后发现产率偏低,其主要原因可能是_____ 。
(4)8.34gFeSO4·7H2O(Mr=278)样品隔绝空气受热分解生成多种化合物过程的热重曲线(残留样品质量随温度变化的曲线)如图所示。
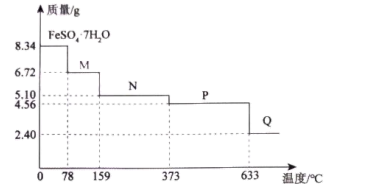
①温度为100℃时,固体物质M的化学式为_____ 。
②在隔绝空气的条件下,由P得到Q的化学方程式为_____ 。
(1)电子工业中,常用氯化铁溶液腐蚀铜制造印刷电路板,该原理的离子方程式为
(2)根据化合价及元素的性质,Na2S5可以改写为Na2S·4S、Fe3O4可以改写为FeO·Fe2O3,则Fe3Cl8可以改写为
(3)可通过下列两个步骤制备三水合草酸合铁(Ⅲ)酸钾晶体。
步骤i:向盛有3.00g黄色晶体FeC2O4·2H2O的烧杯中,加入10.00mLK2C2O4溶液,加热至40℃左右,缓慢滴入过量的H2O2,一段时间后,出现红褐色沉淀。
步骤ii:加热至沸腾,分两次缓慢加入8.00~9.00mLH2C2O4溶液,至沉淀溶解,得到绿色溶液。加热浓缩、加入无水乙醇、结晶,抽滤干燥得7.860g三水合草酸合铁(III)酸钾晶体。
①步骤ⅰ中,生成三草酸合铁酸钾与另一种铁的化合物,该化合物为
②步骤ⅱ加入无水乙醇的目的是
③实验小组完成实验后发现产率偏低,其主要原因可能是
(4)8.34gFeSO4·7H2O(Mr=278)样品隔绝空气受热分解生成多种化合物过程的热重曲线(残留样品质量随温度变化的曲线)如图所示。

①温度为100℃时,固体物质M的化学式为
②在隔绝空气的条件下,由P得到Q的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知铁生锈的过程为:Fe → Fe(OH)2 → Fe(OH)3 → Fe2O3·xH2O。又知草酸(H2C2O4)分解的化学方程式为:H2C2O4 CO↑ + CO2↑ + H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑ + CO2↑ + H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲同学利用草酸分解产生的混合气体和下图所示装置测定其中一种锈铁的组成。
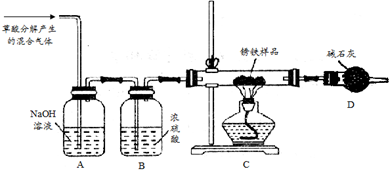
主要操作为:取锈铁样品12.6 g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4 g,装置D增重8.4 g。
①装置A的作用是_________ 。装置B的作用是__________ 。
②根据以上数据能否测定出锈铁的组成?答:_______________ (填“能”或“不能”)。
③该装置还存在的一个明显的缺陷是_____________________ 。
(2)乙同学将生锈铁片溶于过量稀硫酸,检验所得溶液中是否存在Fe2+的实验操作方法是________ 。
(3)乙同学在甲同学装置的基础上将装置D换成装浓硫酸的洗气瓶(装置E,此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4 g,而装置E增重1.8 g,则x =______________ ;m(Fe)︰m (Fe2O3·xH2O) =___________ 。
 CO↑ + CO2↑ + H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑ + CO2↑ + H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。(1)甲同学利用草酸分解产生的混合气体和下图所示装置测定其中一种锈铁的组成。

主要操作为:取锈铁样品12.6 g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4 g,装置D增重8.4 g。
①装置A的作用是
②根据以上数据能否测定出锈铁的组成?答:
③该装置还存在的一个明显的缺陷是
(2)乙同学将生锈铁片溶于过量稀硫酸,检验所得溶液中是否存在Fe2+的实验操作方法是
(3)乙同学在甲同学装置的基础上将装置D换成装浓硫酸的洗气瓶(装置E,此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4 g,而装置E增重1.8 g,则x =
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制 盐酸和
盐酸和 溶液;
溶液;
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用 溶液中和过量的盐酸,记录所消耗NaOH溶液的体积;
溶液中和过量的盐酸,记录所消耗NaOH溶液的体积;
④加入 盐酸。
盐酸。
请回答下列问题:
(1)正确的操作顺序是_______ (填序号)。
(2)测定过程中发生反应的离子方程式为_______ ;_______ 。
(3)如图为实验室某浓盐酸试剂瓶上的标签的有关内容,该浓盐酸中溶质的物质的量浓度为_______  。
。

用该浓盐酸配制本实验所需的 盐酸,需要的仪器有容量瓶、烧杯、玻璃棒、
盐酸,需要的仪器有容量瓶、烧杯、玻璃棒、_______ (从下列图中选择,写出名称)。

下列实验操作对所配制的盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
①容量瓶在使用前未干燥,里面有少量蒸馏水:_______ ;
②未洗涤烧杯及玻璃棒:_______ 。
(4)某同学4次测定所消耗的NaOH溶液的体积如下:
根据这个同学的实验数据,计算这种药片中碳酸钙的质量分数为_______ 。
①配制
 盐酸和
盐酸和 溶液;
溶液;②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用
 溶液中和过量的盐酸,记录所消耗NaOH溶液的体积;
溶液中和过量的盐酸,记录所消耗NaOH溶液的体积;④加入
 盐酸。
盐酸。请回答下列问题:
(1)正确的操作顺序是
(2)测定过程中发生反应的离子方程式为
(3)如图为实验室某浓盐酸试剂瓶上的标签的有关内容,该浓盐酸中溶质的物质的量浓度为
 。
。
用该浓盐酸配制本实验所需的
 盐酸,需要的仪器有容量瓶、烧杯、玻璃棒、
盐酸,需要的仪器有容量瓶、烧杯、玻璃棒、
下列实验操作对所配制的盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
①容量瓶在使用前未干燥,里面有少量蒸馏水:
②未洗涤烧杯及玻璃棒:
(4)某同学4次测定所消耗的NaOH溶液的体积如下:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V[NaOH(aq)]/mL | 13.00 | 12.90 | 13.10 | 13.00 |
根据这个同学的实验数据,计算这种药片中碳酸钙的质量分数为
您最近一年使用:0次

 检验,实现该转化的试剂和条件依次是
检验,实现该转化的试剂和条件依次是

