名校
解题方法
1 . 铁及其化合物在生活生产中应用非常广泛。某兴趣小组的同学对于碳酸亚铁的制取和相关性质进行探究。
【查阅资料】
①溶液pH大于9.6时, 可完全转化为
可完全转化为 沉淀。
沉淀。
② 是白色固体,难溶于水,会在潮湿的空气中发生反应,生成
是白色固体,难溶于水,会在潮湿的空气中发生反应,生成 和
和 。
。
③ 溶液中滴加KSCN溶液,溶液会变为血红色;而
溶液中滴加KSCN溶液,溶液会变为血红色;而 溶液中滴加KSCN溶液,溶液不变色。
溶液中滴加KSCN溶液,溶液不变色。
④碱石灰的主要成分是NaOH和CaO。
【进行实验】
(一)制取
(1)某同学将生锈的铁钉放入稀硫酸中除锈,除锈的化学方程式为______ 。然后将除尽铁锈后的铁钉再放入足量的稀硫酸中,充分反应。
(2)用(1)中反应生成的溶液和pH=11.9的 溶液反应制取
溶液反应制取 时,可能制得
时,可能制得 的操作是______(填序号)。
的操作是______(填序号)。
(二)探究久置于潮湿空气中 的成分
的成分
(3)猜想一: :猜想二:
:猜想二:______ ;猜想三: 和
和 。
。
(4)探究过程:
结论:猜想三正确。
(三)确定 的质量分数
的质量分数
该兴趣小组为进一步确定固体中 的质量分数,称取10.0g固体做了如图所示的补充实验。
的质量分数,称取10.0g固体做了如图所示的补充实验。
(6)反应结束后,需继续通入一段时间 ,其目的是
,其目的是______ 。
(7)实验结束后,测得装置C增重1.1g,则固体中 的质量分数为多少?
的质量分数为多少?
(8)实验过程中,若无D装置,会使实验结果______ (选填“偏大”、“偏小”或“不变”)。
【实验结论】碳酸亚铁在潮湿的空气中易变质,故需要密封保存。
【查阅资料】
①溶液pH大于9.6时,
 可完全转化为
可完全转化为 沉淀。
沉淀。②
 是白色固体,难溶于水,会在潮湿的空气中发生反应,生成
是白色固体,难溶于水,会在潮湿的空气中发生反应,生成 和
和 。
。③
 溶液中滴加KSCN溶液,溶液会变为血红色;而
溶液中滴加KSCN溶液,溶液会变为血红色;而 溶液中滴加KSCN溶液,溶液不变色。
溶液中滴加KSCN溶液,溶液不变色。④碱石灰的主要成分是NaOH和CaO。
【进行实验】
(一)制取

(1)某同学将生锈的铁钉放入稀硫酸中除锈,除锈的化学方程式为
(2)用(1)中反应生成的溶液和pH=11.9的
 溶液反应制取
溶液反应制取 时,可能制得
时,可能制得 的操作是______(填序号)。
的操作是______(填序号)。A.将少量的 溶液与大量的 溶液与大量的 溶液同时加入烧杯中,边加边搅拌 溶液同时加入烧杯中,边加边搅拌 |
B.先将 浴液加入烧杯中,再缓慢加入 浴液加入烧杯中,再缓慢加入 溶液,边加边搅拌 溶液,边加边搅拌 |
C.先将 溶液加入烧杯中,再缓慢加入 溶液加入烧杯中,再缓慢加入 溶液,边加边搅拌 溶液,边加边搅拌 |
(二)探究久置于潮湿空气中
 的成分
的成分(3)猜想一:
 :猜想二:
:猜想二: 和
和 。
。(4)探究过程:
| 实验操作 | 实验现象 | 结论 |
①取少量久置于潮湿空气中的 固体于试管中,加入足量的稀盐酸 固体于试管中,加入足量的稀盐酸 | 观察到试管内 | 说明该固体中含有 |
| ②取少量上述反应后的溶液于另一支管,滴入 | 观察到试管内 | 说明该固体中含有 |
(三)确定
 的质量分数
的质量分数该兴趣小组为进一步确定固体中
 的质量分数,称取10.0g固体做了如图所示的补充实验。
的质量分数,称取10.0g固体做了如图所示的补充实验。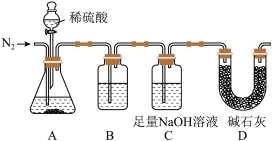
| A.稀硫酸 | B.石灰水 | C.浓硫酸 |
(6)反应结束后,需继续通入一段时间
 ,其目的是
,其目的是(7)实验结束后,测得装置C增重1.1g,则固体中
 的质量分数为多少?
的质量分数为多少?(8)实验过程中,若无D装置,会使实验结果
【实验结论】碳酸亚铁在潮湿的空气中易变质,故需要密封保存。
您最近一年使用:0次
2 . 请参与下列铜的冶炼并回答有关问题:
I.实验室炼铜

(1)如图所示一氧化碳还原氧化铜的实验,硬质玻璃管内出现_______ (填现象)证明反应已经发生。实验过程中若硬质玻璃管内发生了轻微爆炸,其可能原因是_______ 。该实验设计的一个明显缺陷是_______ 。
Ⅱ.古人炼铜
我国古代将炉甘石 (主要成分:ZnCO3)、赤铜矿(主要成分:Cu2O)和木炭粉为原料制得黄铜 (铜和锌的合金),其主要反应原理为:①ZnCO3在800℃时分解,生成两种氧化物;②木炭粉还原锌和铜的氧化物得到金属单质。
(2)ZnCO3分解的化学方程式为:_______ 。
(3)炼得的黄铜呈液态从设备中流出有利于黄铜与固体杂质分离,而铜的熔点是 1084℃远高于设备内温度,黄铜在设备内呈液态的原因是_______ 。
Ⅲ.工业炼铜废气的处理
工业上利用反应:Cu2S+O2 2Cu+SO2,冶炼得到 Cu。冶炼产生的烟气经过水洗除尘后,烟气中部分气体分子的百分含量
2Cu+SO2,冶炼得到 Cu。冶炼产生的烟气经过水洗除尘后,烟气中部分气体分子的百分含量 ,随温度变化气体分子总数如图所示:
,随温度变化气体分子总数如图所示:

(4)图中虚线表示 SO2或O2的变化,其中曲线2表示的物质是_______ 。
(5)作出猜想: 300℃以后烟气中 H2SO4含量降低的主要原因是: 300℃以后H2SO4开始分解。500℃以后曲线1上升的主要原因是:_______ 要验证该猜想可_______ (填操作、现象与结论)。
I.实验室炼铜

(1)如图所示一氧化碳还原氧化铜的实验,硬质玻璃管内出现
Ⅱ.古人炼铜
我国古代将炉甘石 (主要成分:ZnCO3)、赤铜矿(主要成分:Cu2O)和木炭粉为原料制得黄铜 (铜和锌的合金),其主要反应原理为:①ZnCO3在800℃时分解,生成两种氧化物;②木炭粉还原锌和铜的氧化物得到金属单质。
(2)ZnCO3分解的化学方程式为:
(3)炼得的黄铜呈液态从设备中流出有利于黄铜与固体杂质分离,而铜的熔点是 1084℃远高于设备内温度,黄铜在设备内呈液态的原因是
Ⅲ.工业炼铜废气的处理
工业上利用反应:Cu2S+O2
 2Cu+SO2,冶炼得到 Cu。冶炼产生的烟气经过水洗除尘后,烟气中部分气体分子的百分含量
2Cu+SO2,冶炼得到 Cu。冶炼产生的烟气经过水洗除尘后,烟气中部分气体分子的百分含量 ,随温度变化气体分子总数如图所示:
,随温度变化气体分子总数如图所示:
(4)图中虚线表示 SO2或O2的变化,其中曲线2表示的物质是
(5)作出猜想: 300℃以后烟气中 H2SO4含量降低的主要原因是: 300℃以后H2SO4开始分解。500℃以后曲线1上升的主要原因是:
您最近一年使用:0次
解题方法
3 . 化学实验室常常产生许多废液,经无害化处理后可防止对环境的破坏。化学兴趣小组同学设计了四组实验对NaOH溶液和Ca(OH)2溶液进行鉴别,请你参与实验,并对废液的成分展开探究。
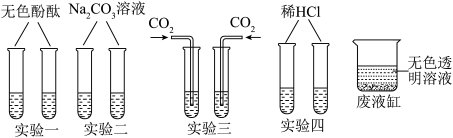
(1)上述四组实验不能达到鉴别目的是_______________ 。
(2)将上述四组实验的八支试管中的废液倒入一个洁净的大烧杯中,先有大量的气泡,后沉淀消失,得到澄清无色透明溶液。那么,该废液中含有哪些物质呢(酚酞除外)?
【查阅资料】NaCl、CaCl2溶液呈中性
【猜想】A:NaCl、CaCl2、NaOH B:NaCl、CaCl2 C:_______________ 。
大家经认真思考后,认为猜想_______________ 一定是错的。理由是_______________ 。
(3)【设计实验】
大家共同决定在废液中加入适量的碳酸钠溶液,恰好完全反应后,过滤。
再将废液进行________________ (填实验操作),就可以将废液处理并回收得到NaCl。

(1)上述四组实验不能达到鉴别目的是
(2)将上述四组实验的八支试管中的废液倒入一个洁净的大烧杯中,先有大量的气泡,后沉淀消失,得到澄清无色透明溶液。那么,该废液中含有哪些物质呢(酚酞除外)?
【查阅资料】NaCl、CaCl2溶液呈中性
【猜想】A:NaCl、CaCl2、NaOH B:NaCl、CaCl2 C:
大家经认真思考后,认为猜想
(3)【设计实验】
| 实验方案 | 实验操作 | 实验现象 | 实验结论 |
| 方案 | 另取废液缸中少量试液于另一试管中,加入少量 | 固体溶解消失,溶液变成蓝色 | 猜想C正确 |
再将废液进行
您最近一年使用:0次
4 . 小谢同学利用图 1 装置探究稀盐酸与氢氧化钠溶液反应的过程,并用 pH 传感器和温度传感器测量反应过程中相关物理量的变化情况,如图 2、图 3 所示。

(1)图 1 发生反应的化学方程式为________ 。
(2)溶液 A 中的溶质是_______ (填化学式)。
(3)下列有关图 2 的说法正确的是 (填标号)。
(4)由图 3 可知,中和反应是_______ 反应(填“放热”或“吸热”),图中 V 的数值最接近_____ (选填“6”“12”或“16”)。
(5)下列图象能正确反映图 1 反应变化关系的是 (填标号)。
【实验拓展】小莹同学向氢氧化钠溶液中滴加一定量的稀盐酸,为了判断反应程度,继续向其中加入酚酞试液,溶液呈无色。小婷同学认为此时溶液中的溶质可能有以下两种情况。
【猜想假设】
(6)猜想①:NaCl 猜想②:_________ 。
【查阅资料】①金属钴(Co)的活动性位于 H 前;② CoCl2溶液呈粉红色。
【设计实验】
(7)她们共同设计了如下实验方案进行探究。

(1)图 1 发生反应的化学方程式为
(2)溶液 A 中的溶质是
(3)下列有关图 2 的说法正确的是 (填标号)。
| A.b 点溶液中滴入酚酞试液会变红色 | B.c 点溶液加热蒸干所得固体为纯净物 |
| C.d 点溶液中的溶质种类比 c 点少 | D.一段时间后,溶液 pH 会变为 0 |
(5)下列图象能正确反映图 1 反应变化关系的是 (填标号)。
A. | B. | C. | D. |
【实验拓展】小莹同学向氢氧化钠溶液中滴加一定量的稀盐酸,为了判断反应程度,继续向其中加入酚酞试液,溶液呈无色。小婷同学认为此时溶液中的溶质可能有以下两种情况。
【猜想假设】
(6)猜想①:NaCl 猜想②:
【查阅资料】①金属钴(Co)的活动性位于 H 前;② CoCl2溶液呈粉红色。
【设计实验】
(7)她们共同设计了如下实验方案进行探究。
| 实验 | 实验步骤 | 实验现象 | 实验结论 |
| ① | 取反应后剩余液体,加入适量金属钴 | 猜想②成立 | |
| ② | 取反应后剩余液体,加入适量的 | 固体溶解溶液变蓝 |
您最近一年使用:0次
5 . 某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了氧气的制备实验。

(1)写出仪器名称:①_______ 。
(2)甲同学用高锰酸钾制取氧气,选用的发生装置是___ (填字母),反应的化学方程式为____ 。若用E装置收集的氧气,在完成硫粉在氧气中燃烧的实验时,集气瓶内要预留适量的水(图F所示),水的作用是____ 。
(3)实验室可用锌粒和稀盐酸在常温下制取氢气,应选择的发生装置是_____ (填字母,下同),收集纯净的氢气最好选择装置____ ,用该方法收集的氢气若不纯,其原因可能是_____ 。
(4)丙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,乙同学发现用排水法收集到的O2大于理论产量。针对这一现象,同学们进行了如下探究。
【提出猜想】猜想I:反应生成的MnO2分解出O2
猜想II:反应生成的K2MnO4分解放出O2;
猜想III:反应生成的K2MnO4和MnO2分解都放出O2
【实验验证】同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想____ 错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论。该组同学选择的实验方法是____ 。
【拓展延伸】实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快。请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?_____ 。

(1)写出仪器名称:①
(2)甲同学用高锰酸钾制取氧气,选用的发生装置是
(3)实验室可用锌粒和稀盐酸在常温下制取氢气,应选择的发生装置是
(4)丙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,乙同学发现用排水法收集到的O2大于理论产量。针对这一现象,同学们进行了如下探究。
【提出猜想】猜想I:反应生成的MnO2分解出O2
猜想II:反应生成的K2MnO4分解放出O2;
猜想III:反应生成的K2MnO4和MnO2分解都放出O2
【实验验证】同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想
【拓展延伸】实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快。请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?
您最近一年使用:0次
6 . 小明进行 H2O2 溶液制 O2 的实验探究。结合下列过程,回答有关问题。
(1)MnO2 作催化剂,向 5mL5%的 H2O2 溶液中加入少量 MnO2,立即产生大量气泡。(浓硫酸具有吸水性,能用做干燥剂)
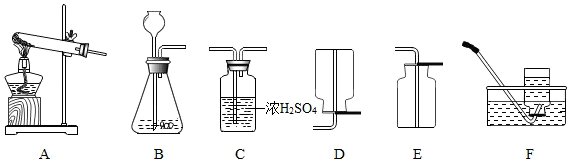
①写出用 H2O2 溶液制备O2 的符号表达式:___________ 。
②用上述反应原理制备并收集一瓶干燥的O2,从所给装置图中选择并组装一套装置,其连接顺序为____ → C →_______ (填标号)。为了确保实验成功,在装药品之前应该__________ 。
③用 E 收集氧气验满的方法是___________ ,若木条复燃, 则证明收集满。
(2)FeCl3 溶液做催化剂
向 5mL5%的 H2O2 溶液中加入 2 滴一定浓度的 FeCl3 溶液,立即产生大量气泡。
【已知】FeCl3 溶液中主要含有三种微粒:H2O、Fe3+、Cl-
【问题】哪种微粒对 H2O2 溶液的分解起催化作用?
【假设】假设一:可能是 H2O;假设二:可能是 Fe3+;假设三:可能是 Cl-
【分析】①假设一不可能成立,理由是______________
【实验】
【结论】②假设_________________ 成立,而假设一和另一种假设不成立。
(3)催化剂比较
从循环利用的角度分析,_________________ (填“FeCl3”或“MnO2”)更适合做该反应 的催化剂。
(1)MnO2 作催化剂,向 5mL5%的 H2O2 溶液中加入少量 MnO2,立即产生大量气泡。(浓硫酸具有吸水性,能用做干燥剂)

①写出用 H2O2 溶液制备O2 的符号表达式:
②用上述反应原理制备并收集一瓶干燥的O2,从所给装置图中选择并组装一套装置,其连接顺序为
③用 E 收集氧气验满的方法是
(2)FeCl3 溶液做催化剂
向 5mL5%的 H2O2 溶液中加入 2 滴一定浓度的 FeCl3 溶液,立即产生大量气泡。
【已知】FeCl3 溶液中主要含有三种微粒:H2O、Fe3+、Cl-
【问题】哪种微粒对 H2O2 溶液的分解起催化作用?
【假设】假设一:可能是 H2O;假设二:可能是 Fe3+;假设三:可能是 Cl-
【分析】①假设一不可能成立,理由是
【实验】
| 操作 | 现象 |
| 其他条件不变,向 H2O2溶液中加入 NaCl 溶液 | 无明显变化 |
| 其他条件不变,向 H2O2 溶液中加入 Na2SO4 溶液 | 无明显变化 |
| 其他条件不变,向H2O2 溶液中加入 Fe2(SO4)3 溶液 | 立即产生大量气泡 |
【结论】②假设
(3)催化剂比较
从循环利用的角度分析,
您最近一年使用:0次
7 . 某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
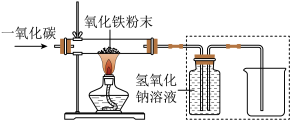
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】
① CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关
② CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe
③ NaOH溶液与石灰水相似,能吸收CO2,但不变浑浊
④
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有________ 和 ________
(2)进行猜想:黑色固体粉末可能a.全部为铁粉;b.__________ ;c._________
【得出结论】
(3)通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)________ 。
【反思与评价】
(4)一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
(5)实验装置图中采用虚线框内的装置,其作用有________ 。
A.收集CO B.吸收CO2 C.检验CO2
【实践应用】小明和他的同学想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
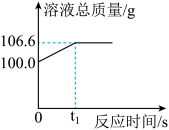
(6)上述反应产生CO2的质量为_______ g;
(7)计算该赤铁矿石中氧化铁的质量分数为___________ 。(需要有计算过程)

【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】
① CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关
② CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe
③ NaOH溶液与石灰水相似,能吸收CO2,但不变浑浊
④
| 物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有
(2)进行猜想:黑色固体粉末可能a.全部为铁粉;b.
【得出结论】
(3)通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)
【反思与评价】
(4)一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
(5)实验装置图中采用虚线框内的装置,其作用有
A.收集CO B.吸收CO2 C.检验CO2
【实践应用】小明和他的同学想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。

(6)上述反应产生CO2的质量为
(7)计算该赤铁矿石中氧化铁的质量分数为
您最近一年使用:0次
2017-12-20更新
|
151次组卷
|
2卷引用:江苏省扬州市江都区五校2018届九年级12月月考化学试题



