名校
1 . 根据实验目的,下列操作、现象及结论都正确的是
| 选项 | 目的 | 操作及现象 | 结论 |
| A | 检验 的性质 的性质 | 向试管中加入3mL稀 酸性溶液,再通入 酸性溶液,再通入 气体,紫红色褪去 气体,紫红色褪去 |  具有漂白性 具有漂白性 |
| B | 检验补铁口服液中是否含有 | 加入KSCN溶液无明显现象,再滴加少量氯水,溶液立即变为红色 | 含有 |
| C | 检验 固体是否变质 固体是否变质 | 溶解后,滴加硝酸酸化的硝酸钡溶液,产生白色沉淀 | 已变质 |
| D | 检验某溶液中是否含有 | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 不含 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-27更新
|
254次组卷
|
3卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高三上学期11月月考化学试题
名校
解题方法
2 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
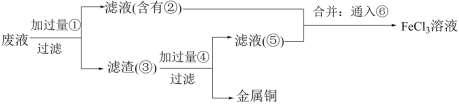
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
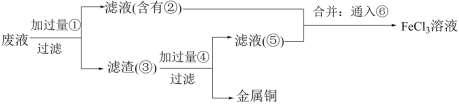
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
408次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市第一中学2021--2022学年高一上学期期末考试化学试题
名校
解题方法
3 . 磷酸亚铁[ ]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以
]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以 、
、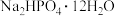 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为
 。合成磷酸亚铁的装置如图。
。合成磷酸亚铁的装置如图。

回答下列问题:
(1)仪器A的名称为___________ 。
(2)实验中需要210 0.1
0.1
 溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有
溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有___________ ,需要称量的绿矾( )的质量为
)的质量为___________ g。
(3)实验中应使用煮沸并冷却的蒸馏水配制酸性 溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为
溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为___________ 。
(4)实验时,在仪器A中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入 与
与 混合溶液至
混合溶液至 ,再滴入
,再滴入 溶液,最终维持
溶液,最终维持 。用抗坏血酸稀溶液作底液的作用是
。用抗坏血酸稀溶液作底液的作用是___________ 。
(5)生成的 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是___________ 。
(6)某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠(含 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到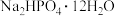 晶体。已知:
晶体。已知: 溶液的
溶液的 在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;
在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;___________ ,冷却结晶,过滤、洗涤及干燥。[实验中可选用的试剂: 溶液、0.1
溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、活性炭]
溶液、活性炭]
 ]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以
]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以 、
、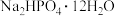 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为
 。合成磷酸亚铁的装置如图。
。合成磷酸亚铁的装置如图。
回答下列问题:
(1)仪器A的名称为
(2)实验中需要210
 0.1
0.1
 溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有
溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有 )的质量为
)的质量为(3)实验中应使用煮沸并冷却的蒸馏水配制酸性
 溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为
溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为(4)实验时,在仪器A中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入
 与
与 混合溶液至
混合溶液至 ,再滴入
,再滴入 溶液,最终维持
溶液,最终维持 。用抗坏血酸稀溶液作底液的作用是
。用抗坏血酸稀溶液作底液的作用是(5)生成的
 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是(6)某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠(含
 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到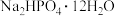 晶体。已知:
晶体。已知: 溶液的
溶液的 在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;
在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水; 溶液、0.1
溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、活性炭]
溶液、活性炭]
您最近一年使用:0次
2023-10-22更新
|
321次组卷
|
3卷引用:新疆生产建设兵团第二中学(新疆兵团地州学校)2023-2024学年高三上学期期中联考化学试题
名校
4 . 下列中学常见实验的现象或表述正确的是
| A.赤铁矿的主要成分是Fe3O4 |
| B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 |
| C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可 |
| D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加入足量的铁粉,然后过滤 |
您最近一年使用:0次
2016-12-09更新
|
124次组卷
|
2卷引用:新疆乌鲁木齐市第四中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
5 . 下列关于 、
、 性质实验的说法错误的是
性质实验的说法错误的是
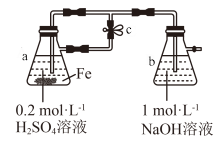
 、
、 性质实验的说法错误的是
性质实验的说法错误的是
A.用上图装置可以制备 沉淀 沉淀 |
B. 溶液中滴加KI溶液,会有碘单质生成 溶液中滴加KI溶液,会有碘单质生成 |
| C.配制溶液所用的蒸馏水通常要煮沸 |
D.向 溶液中加入少量铁粉是为了防止 溶液中加入少量铁粉是为了防止 被氧化 被氧化 |
您最近一年使用:0次
名校
解题方法
6 . 甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。实验室利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如图所示(夹持和加热仪器已省略)。

查阅资料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
I.装置C中盛有17.4gFeCO3和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是_______ ;与a相比,仪器b的优点是_______ 。
(2)装置B中盛有的试剂是:_______ ;装置D的作用是_______ 。
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为_______ 。
(4)过程I加入柠檬酸促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。

①pH过低或过高均导致产率下降,其原因是_______ ;
②柠檬酸的作用还有_______ 。
(5)过程II中加入无水乙醇的目的是_______ 。

查阅资料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
I.装置C中盛有17.4gFeCO3和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是
(2)装置B中盛有的试剂是:
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为
(4)过程I加入柠檬酸促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。

①pH过低或过高均导致产率下降,其原因是
②柠檬酸的作用还有
(5)过程II中加入无水乙醇的目的是
您最近一年使用:0次
2021-03-16更新
|
125次组卷
|
2卷引用:新疆维吾尔自治区新源县第二中学2020届高三上学期9月月考化学试题



