21-22高一上·全国·课前预习
解题方法
1 . 回答下列问题:
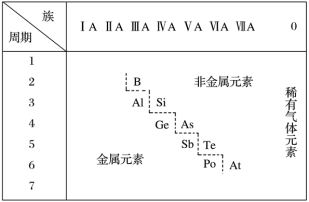
图中从第IIIA族的硼到第VIIA的砹连成一条斜线,即为金属元素和非金属元素的分界线。
问题:分界线附近元素的性质有什么特点____ ?金属性、非金属性最强的元素分别处于元素周期表的什么位置?_____

图中从第IIIA族的硼到第VIIA的砹连成一条斜线,即为金属元素和非金属元素的分界线。
问题:分界线附近元素的性质有什么特点
您最近一年使用:0次
21-22高一上·全国·课前预习
解题方法
2 . 门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下了空位。例如:他认为铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家布瓦博德朗发现了这种元素,将它命名为“镓”,镓的性质与门捷列夫预测的一样。门捷列夫还预测在硅和锡之间存在一种元素“类硅”,15年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。
2016年国际纯粹与应用化学联合会(IUPAC)正式宣布,元素周期表中将加入4种新元素,原子序数分别为113、115、117和118.这可是件大事,因为这四种元素都是在实验室合成的,放射性强,还特别重。也因此而补齐了元素周期表的第七行。他们的发现也为科学家在未来合成更重要、更有实用价值的元素提供了可能。
问题:元素周期表给科学工作者发现元素提供了哪些依据_____ ?元素周期表中元素的位置和性质之间存在着怎样的内在联系_____ ?
2016年国际纯粹与应用化学联合会(IUPAC)正式宣布,元素周期表中将加入4种新元素,原子序数分别为113、115、117和118.这可是件大事,因为这四种元素都是在实验室合成的,放射性强,还特别重。也因此而补齐了元素周期表的第七行。他们的发现也为科学家在未来合成更重要、更有实用价值的元素提供了可能。
问题:元素周期表给科学工作者发现元素提供了哪些依据
您最近一年使用:0次
21-22高一上·全国·课前预习
3 . 1~18号元素原子结构的特点
(1)最外层电子数为1的元素有___________ ;
(2)最外层电子数为2的元素有___________ ;
(3)最外层电子数与次外层电子数相等的元素有___________ ;
(4)最外层电子数是次外层电子数2倍的元素是___________ ;
(5)最外层电子数是次外层电子数3倍的元素是___________ ;
(6)次外层电子数是最外层电子数2倍的元素有___________ ;
(7)内层电子总数是最外层电子数2倍的元素有___________ ;
(8)电子层数与最外层电子数相等的元素有___________ ;
(9)最外层电子数是电子层数2倍的元素有___________ ;
(10)最外层电子数是电子层数3倍的元素有___________ ;
(1)最外层电子数为1的元素有
(2)最外层电子数为2的元素有
(3)最外层电子数与次外层电子数相等的元素有
(4)最外层电子数是次外层电子数2倍的元素是
(5)最外层电子数是次外层电子数3倍的元素是
(6)次外层电子数是最外层电子数2倍的元素有
(7)内层电子总数是最外层电子数2倍的元素有
(8)电子层数与最外层电子数相等的元素有
(9)最外层电子数是电子层数2倍的元素有
(10)最外层电子数是电子层数3倍的元素有
您最近一年使用:0次
4 . 电子层
(1)概念:在含有多个电子的原子里,电子分别在___________ 的区域内运动。我们把不同的区域简化为___________ ,也称作电子层。
(2)不同电子层的表示及能量关系
(1)概念:在含有多个电子的原子里,电子分别在
(2)不同电子层的表示及能量关系
| 各电子层由内到外 | 电子层数(n) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 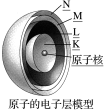 |
| 字母代号 | O | P | Q | ||||||
| 最多容纳电子数(2n2) | 50 | 72 | 98 | ||||||
| 离核远近 | 由 | ||||||||
| 能量高低 | 由 | ||||||||
您最近一年使用:0次
21-22高一上·全国·课前预习
解题方法
5 . 俄罗斯科学家用含20个质子的钙的一种原子轰击含95个质子的镅原子,结果4次成功合成4个第115号元素的原子,中文名“镆”,其元素符号为Mc,这4个原子数微秒后衰变成第113号元素,中文名“鉨”。
(1)问题一:113号元素原子的核外电子数是多少___ ?
(2)问题二:若115号元素的一种核素的质量数为289,写出该核素符号___ ,该核素中质子数与中子数的差为多少___ ?
(1)问题一:113号元素原子的核外电子数是多少
(2)问题二:若115号元素的一种核素的质量数为289,写出该核素符号
您最近一年使用:0次
21-22高一上·全国·课前预习
6 . 在化学学习过程中,我们常用化学用语表示物质的组成、结构和变化。为了简便起见,我们用电子式表示物质的形成过程。
问题:为什么可用电子式表示物质的形成过程___ ?
问题:为什么可用电子式表示物质的形成过程
您最近一年使用:0次
7 . 钠在Cl2中燃烧装置如图,实验中可观察到黄色火焰、产生大量的白烟,说明Na在氯气中燃烧生成了NaCl。
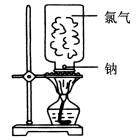
已知:晶体NaCl不导电,熔融NaCl能导电,NaCl的熔融热为517.5kJ/mol,H2O的熔融热为6kJ/mol。
问题:结合已知,试从Na、Cl原子的结构特点分析NaCl的形成过程___ 。

已知:晶体NaCl不导电,熔融NaCl能导电,NaCl的熔融热为517.5kJ/mol,H2O的熔融热为6kJ/mol。
问题:结合已知,试从Na、Cl原子的结构特点分析NaCl的形成过程
您最近一年使用:0次
21-22高一上·全国·课前预习
解题方法
8 . 前面学习碱金属化学性质的比较时,通过金属钠、钾分别与氧气、水的反应,对比金属钠与金属钾的化学性质,再对比金属钠与金属钾的原子结构,认识原子半径对物质性质的影响,最终预测金属锂分别与氧气和水反应的现象。学习卤族元素化学性质的比较时,通过氟、氯、溴、碘与氢气的反应及卤素单质间的置换反应,对比卤族元素的性质。对于第三周期元素,电子层数相同,最外层电子数不同、原子半径不同,因此比较第三周期元素的性质时,需综合考虑最外层电子数与原子半径。
(1)问题一:可从哪些方面设计实验方案比较Na、Mg、Al金属性的强弱___ ?
(2)问题二:可从哪些方面设计实验方案比较Si、P、S、Cl非金属性的强弱___ ?
(1)问题一:可从哪些方面设计实验方案比较Na、Mg、Al金属性的强弱
(2)问题二:可从哪些方面设计实验方案比较Si、P、S、Cl非金属性的强弱
您最近一年使用:0次
21-22高一上·全国·课前预习
解题方法
9 . 1824年,法国化学家巴拉尔(1802—1876)在研究盐湖中植物的时候,将从大西洋和地中海沿岸采集到的黑角菜燃烧成灰,然后用浸泡的方法得到一种灰黑色的浸取液。他往浸取液中加入氯水和淀粉,溶液即分为两层:下层显蓝色(这是由于淀粉与溶液中的碘生成了化合物);上层显棕黄色。为什么会出现这种现象呢?经巴拉尔的研究,认为可能有两种情况:一是氯与溶液中的碘形成新的氯化碘,这种化合物使溶液呈棕黄色;二是氯把溶液中的新元素置换出来了,因而使上层溶液呈棕黄色。于是巴拉尔想了些办法,试图把新的化合物分开,但都没有成功。所以他断定这是一种与氯、碘相似的新元素。
1825年,德国海德堡大学学生罗威把家乡克罗次纳的一种矿泉水通入氯气,产生一种红棕色的物质。这种物质用乙醚提取后,再将乙醚蒸发,则得到红棕色的液溴。所以罗威也是独立发现溴的化学家。
(1)问题一:巴拉尔向浸取液中加入氯水和淀粉,溶液分为两层,下层呈蓝色,写出反应的离子方程式________ ,并分析由此得出的结论_________ 。
(2)问题二:罗威的实验中发生反应的离子方程式____ ,并分析由此得出的结论____ 。
1825年,德国海德堡大学学生罗威把家乡克罗次纳的一种矿泉水通入氯气,产生一种红棕色的物质。这种物质用乙醚提取后,再将乙醚蒸发,则得到红棕色的液溴。所以罗威也是独立发现溴的化学家。
(1)问题一:巴拉尔向浸取液中加入氯水和淀粉,溶液分为两层,下层呈蓝色,写出反应的离子方程式
(2)问题二:罗威的实验中发生反应的离子方程式
您最近一年使用:0次
21-22高一上·全国·课前预习
解题方法
10 . 某年,瑞典的化学家阿尔费德森在分析一种矿物时发现,得出的已知成分只有96%,那么其余的4%到哪儿去了呢?他经过反复试验,确信一定是矿物中含有一种至今还不知道的元素。因这种元素是在名叫透锂长石的矿物中发现的,他就取名为“锂”(希腊文“岩石”之意)。不久,阿尔费德森又在其它矿物中发现了这种元素。另一名瑞典化学家贝采尼乌斯也在卡尔斯温泉和捷克的马里安温泉的矿泉水中发生了锂。
(1)问题一:在元素周期表中,锂处于什么位置________ ?
(2)问题二:由Na的性质预测Li可能的化学性质_________ ?
(1)问题一:在元素周期表中,锂处于什么位置
(2)问题二:由Na的性质预测Li可能的化学性质
您最近一年使用:0次



