解题方法
1 . 药中间体G( )的一种合成路线如图所示。
)的一种合成路线如图所示。
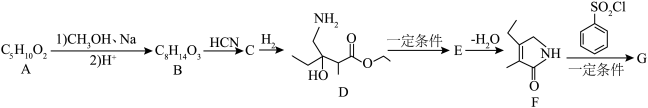
已知:①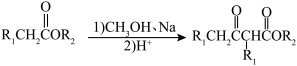 (
( 代表烃基);
代表烃基);
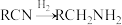 (R代表烃基);
(R代表烃基);③
(1)A的名称为
(2)B→C的反应类型为
(3)E分子中含有手性碳个数为
(4)同时满足下列条件的A的同分异构体有
a.能发生银镜反应 b.与金属钠反应产生氢气
其中核磁共振氢谱显示四组峰,且峰面积之比为1∶1∶2∶6的结构简式为
(5)结合题目信息,以丙酮、
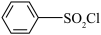 为原料,设计制备
为原料,设计制备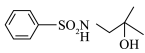 的合成路线(用流程图表示,无机试剂,有机溶剂任选):
的合成路线(用流程图表示,无机试剂,有机溶剂任选):
您最近一年使用:0次
2024-03-26更新
|
216次组卷
|
2卷引用:贵州省部分学校2024届高三下学期一模联考化学试题(二)
2 . 秸秆(含多糖物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:

回答下列问题:
(1)下列关于糖类的说法正确的是______________ 。(填标号)
A.糖类都有甜味,具有CnH2mOm的通式
B.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
C.用银镜反应不能判断淀粉水解是否完全
D.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为______ 。
(3)D中官能团名称为______ ,D生成E的反应类型为______ 。
(4)F 的化学名称是______ ,由F生成G的化学方程式为______ 。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5mol W与足量碳酸氢钠溶液反应生成44g CO2,W共有______ 种(不含立体结构),其中核磁共振氢谱为三组峰的结构简式为_________ 。
(6)参照上述合成路线,以(反,反)-2,4-己二烯和C2H4为原料(无机试剂任选),设计制备对苯二甲酸的合成路线_______________________ 。

回答下列问题:
(1)下列关于糖类的说法正确的是
A.糖类都有甜味,具有CnH2mOm的通式
B.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
C.用银镜反应不能判断淀粉水解是否完全
D.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为
(3)D中官能团名称为
(4)F 的化学名称是
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5mol W与足量碳酸氢钠溶液反应生成44g CO2,W共有
(6)参照上述合成路线,以(反,反)-2,4-己二烯和C2H4为原料(无机试剂任选),设计制备对苯二甲酸的合成路线
您最近一年使用:0次
2016-12-09更新
|
5285次组卷
|
34卷引用:贵州省黔南布依族苗族自治州龙里中学2019-2020学年高三上学期期末考试理综化学试题
贵州省黔南布依族苗族自治州龙里中学2019-2020学年高三上学期期末考试理综化学试题贵州省剑河县第二中学2019-2020学年高三上学期期末考试化学试题2015-2016学年河南省南阳一中高二下期末模拟化学试卷2016年全国普通高等学校招生统一考试化学(新课标1卷精编版)2015-2016学年福建省漳州市龙海市程溪中学高二下期末化学试卷2017届重庆市第八中学高三上周考化学试卷江西省上高县第二中学2016-2017学年高二第七次月考(5月)化学试题2【全国百强校】江西省上高县第二中学2016-2017学年高二第七次月考(5月)化学试题河南省驻马店市2016-2017学年高二下学期期末考试化学试题山西省康杰中学2018届高三第二次月考化学试卷(已下线)黄金30题系列 高二化学(选修5) 大题易丢分安徽省马鞍山市第二中学2017-2018学年高二上学期期末教学质量检测化学试题安徽省马鞍山市2017-2018学年高二上学期期末教学质量检测化学理科试题 (已下线)《考前20天终极攻略》5月31日 有机化学基础2016年全国普通高等学校招生统一考试化学(全国1卷参考版)广东省深圳外国语学校2019届高三第一次月考理综化学试题(已下线)2019年5月19日《每日一题》人教选修5—— 每周一测云南省文山州马关县实验高中2020届高三上学期开学考试化学试题2020届高三化学大二轮增分强化练—— 有机化学合成的综合考查2020届高三化学二轮选修大题必练——有机化学推断大题广东省梅州市五华县2018-2019学年高二上学期第四次质量监测化学试题(已下线)第32讲 烃的衍生物-2021年高考化学一轮复习名师精讲练黑龙江省牡丹江市海林林业局第一中学2019-2020学年高二下学期第一次月考化学试题(已下线)第34讲 生命中的基础有机化学物质 合成有机高分子(精讲)-2021年高考化学一轮复习讲练测高二选择性必修3(人教版2019)第四章 生物大分子 第四章素养检测四川省内江市威远中学2021届高三1月月考化学试题黑龙江省密山四中2020-2021学年高二下学期期末考试化学试题江西省上高县第二中学2016-2017学年高二第七次月考(5月)化学试题1山东省烟台第二中学2021-2022学年高二4月月考化学试题第五章 本章复习提升云南省普洱市第一中学2021-2022学年高三下学期3月份考试理综化学试题(已下线)第九章 有机化学基础 第61练 生命中的基础有机化学物质 合成有机高分子天津市第二南开学校2023-2024学年高三上学期期中质量调查化学试题(已下线)第四章 生物大分子(B卷)
12-13高三·贵州·阶段练习
3 . A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图,所示(图中球与球之间连线代表化学键单键或双键)。

(1)根据分子结构模型写出A的结构简式___________ ;
(2)拟从芳香烃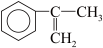 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下:
已知:A在酸性条件下水解生成有机物B和甲醇。
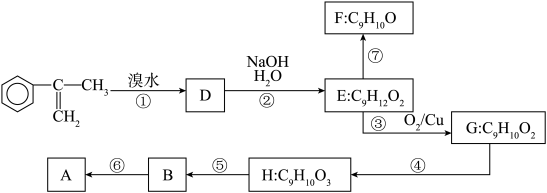
(a)写出⑤反应类型___________ ;写出H的结构简式___________
(b)已知F分子中含有“—CH2OH”,通过F不能有效、顺利地获得B,其原因是___________
(c)写出反应方程式(注明必要的条件)
⑥___________
⑦___________
(3)A的同分异构体有多种,同时满足下列条件A的同分异构体有___________ 种:
ⅰ.含有苯环,苯环上有两个侧链且苯环上一氯取代物有两种;
ⅱ.与A有相同的官能团。

(1)根据分子结构模型写出A的结构简式
(2)拟从芳香烃
 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下:已知:A在酸性条件下水解生成有机物B和甲醇。

(a)写出⑤反应类型
(b)已知F分子中含有“—CH2OH”,通过F不能有效、顺利地获得B,其原因是
(c)写出反应方程式(注明必要的条件)
⑥
⑦
(3)A的同分异构体有多种,同时满足下列条件A的同分异构体有
ⅰ.含有苯环,苯环上有两个侧链且苯环上一氯取代物有两种;
ⅱ.与A有相同的官能团。
您最近一年使用:0次
名校
4 . 铃兰醛(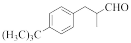 )具有甜润的百合香味,对皮肤的刺激性小,对碱稳定,广泛用于百合、丁香、玉兰、茶花以及素心兰、东方型香型日用香精的合成。常用作肥皂、洗涤剂的香料,还可用作花香型化妆品的香料。其合成路线如下图所示:
)具有甜润的百合香味,对皮肤的刺激性小,对碱稳定,广泛用于百合、丁香、玉兰、茶花以及素心兰、东方型香型日用香精的合成。常用作肥皂、洗涤剂的香料,还可用作花香型化妆品的香料。其合成路线如下图所示:
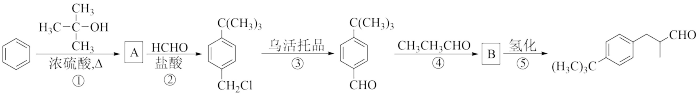
(1)B中官能团的名称是________________ ;
(2)④的反应类型是__________________ ;
(3)写出反应②的化学方程式_________________________ ;
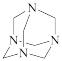
(4)乌洛托品的结构式如图所示,其二氯取代物有____________ 种;将甲醛的水溶液与氨水混合蒸发可制得乌洛托品,该反应的化学方程式是_______________ ;
(5)写出满足下列条件A的有芳香性的同分异构体有____________ 种
I.有两个取代基; II.取代基在邻位。
(6)已知:RCH2COOH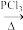 RCHClCOOH。仿照上述流程,写出以CH3CH2CHO为原料制备聚乳酸(
RCHClCOOH。仿照上述流程,写出以CH3CH2CHO为原料制备聚乳酸(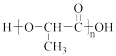 )的合成路线流程图(无机试剂可以任选):CH3CH2CHO—→
)的合成路线流程图(无机试剂可以任选):CH3CH2CHO—→_________ 。
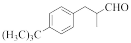 )具有甜润的百合香味,对皮肤的刺激性小,对碱稳定,广泛用于百合、丁香、玉兰、茶花以及素心兰、东方型香型日用香精的合成。常用作肥皂、洗涤剂的香料,还可用作花香型化妆品的香料。其合成路线如下图所示:
)具有甜润的百合香味,对皮肤的刺激性小,对碱稳定,广泛用于百合、丁香、玉兰、茶花以及素心兰、东方型香型日用香精的合成。常用作肥皂、洗涤剂的香料,还可用作花香型化妆品的香料。其合成路线如下图所示:
(1)B中官能团的名称是
(2)④的反应类型是
(3)写出反应②的化学方程式
(4)乌洛托品的结构式如图所示,其二氯取代物有

(5)写出满足下列条件A的有芳香性的同分异构体有
I.有两个取代基; II.取代基在邻位。
(6)已知:RCH2COOH
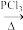 RCHClCOOH。仿照上述流程,写出以CH3CH2CHO为原料制备聚乳酸(
RCHClCOOH。仿照上述流程,写出以CH3CH2CHO为原料制备聚乳酸( )的合成路线流程图(无机试剂可以任选):CH3CH2CHO—→
)的合成路线流程图(无机试剂可以任选):CH3CH2CHO—→
您最近一年使用:0次
2016-12-09更新
|
630次组卷
|
3卷引用:2015-2016学年贵州省凯里一中高二下期中理综化学试卷
5 . 聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景。PPG的一种合成路线如下:
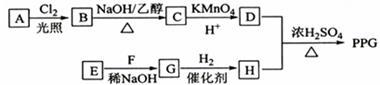
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④ 。
。
回答下列问题:
(1)A的结构简式为______ 。
(2)由B生成C的化学方程式为_______ 。
(3)由E和F生成G的反应类型为______ ,G的化学名称为_________ 。
(4)①由D和H生成PPG的化学方程式为_______ 。
②若PPG平均相对分子质量为10000,则其平均聚合度约为_______ (填标号)。
a.48 b.58 c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有_____ 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是_____ (写结构简式):
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是_____ (填标号)。
a.质谱仪b.红外光谱仪c.元素分析仪d.核磁共振仪

已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④
 。
。回答下列问题:
(1)A的结构简式为
(2)由B生成C的化学方程式为
(3)由E和F生成G的反应类型为
(4)①由D和H生成PPG的化学方程式为
②若PPG平均相对分子质量为10000,则其平均聚合度约为
a.48 b.58 c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是
a.质谱仪b.红外光谱仪c.元素分析仪d.核磁共振仪
您最近一年使用:0次
2019-01-30更新
|
6309次组卷
|
11卷引用:贵州省遵义航天高级中学2018届高三假期模拟考试理科综合化学试题
贵州省遵义航天高级中学2018届高三假期模拟考试理科综合化学试题2015年全国普通高等学校招生统一考试化学(新课标II卷)2016届黑龙江哈尔滨六中高三下三模理综化学试卷黑龙江省哈尔滨师范大学附属中学2016-2017学年高二下学期期中考试化学试题河北省唐山市开滦第二中学2016-2017学年高二6月月考化学试题2018版化学(苏教版)高考总复习专题十二课时跟踪训练--基本营养物质 合成有机高分子广东省仲元中学2017-2018学年高二上学期期中考试化学(理)试题甘肃省平凉市泾川市2019届高三模拟测试化学试题2020届成都市第七中学高中毕业班四月份教学质量监测卷理科综合化学部分陕西省西安市高新第一中学2020届高三教学质量监测理综化学试题黑龙江省哈尔滨市哈尔滨师范大学附属中学2021-2022学年高二下学期开学考试化学试题
6 . 【有机化学基础 15分】化合物x是一种食品保鲜剂,它的结构简式为 。
。
已知:
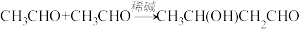
A是一种芳香烃,其蒸汽密度是氢气的46倍。气态物质C的密度在标准状况下为1.25g/L。合成X的路线如下:

回答下列问题:
(1)A的名称是________ ,F分子中含有的官能团名称是___________ 。
(2)实验室制备C的化学反应方程式是___________ ,反应类型是________ 。
(3)写出B与E的反应方程式:_______________ 。
(4)Y是F的同分异构体,其苯环上只有一个取代基,既能发生水解反应也能发生银镜反应的同分异构体有______ 种。其中一种结构的核磁共振氢谱图有5组峰,峰面积之比为1︰1︰2︰2︰6,请写出其结构简式: _______________ 。
(5)根据下列合成路线回答问题:

试剂G的结构简式是_______________ 。
 。
。已知:

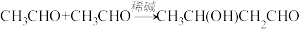
A是一种芳香烃,其蒸汽密度是氢气的46倍。气态物质C的密度在标准状况下为1.25g/L。合成X的路线如下:

回答下列问题:
(1)A的名称是
(2)实验室制备C的化学反应方程式是
(3)写出B与E的反应方程式:
(4)Y是F的同分异构体,其苯环上只有一个取代基,既能发生水解反应也能发生银镜反应的同分异构体有
(5)根据下列合成路线回答问题:

试剂G的结构简式是
您最近一年使用:0次
7 . CO2和H2可用于合成甲醇和甲醚。
(1)已知①CH3OH(l)+ O2(g) ="=" CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
O2(g) ="=" CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
②H2(g)+ O2(g) ="=" H2O(g) ΔH =-241.8 kJ·mol-1
O2(g) ="=" H2O(g) ΔH =-241.8 kJ·mol-1
③H2O(g) ="=" H2O(l) ΔH =-44 kJ·mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l),同时生成H2O(l)的热化学方程式为_______ 。
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
已知在投料比n(CO2):n(H2)=1:3的条件下,不同温度、不同压强时,CO2的转化率见下表:

①下列关于上述可逆反应的说法正确的是
②上述反应的化学平衡常数的表达式为__________ 。
③该反应的ΔH______ 0,原因是_______________________ 。
④在压强为P、温度为500K、投料比n(CO2):n(H2)=1:3的条件下,反应达平衡状态时H2的转化率为_________ ,混合气体中CO2的体积分数为_____________ 。
(3)以甲醇、空气、KOH溶液为原料可设计成燃料电池:放电时,负极的电极反应式为____________ 。
(1)已知①CH3OH(l)+
 O2(g) ="=" CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
O2(g) ="=" CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1②H2(g)+
 O2(g) ="=" H2O(g) ΔH =-241.8 kJ·mol-1
O2(g) ="=" H2O(g) ΔH =-241.8 kJ·mol-1③H2O(g) ="=" H2O(l) ΔH =-44 kJ·mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l),同时生成H2O(l)的热化学方程式为
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)已知在投料比n(CO2):n(H2)=1:3的条件下,不同温度、不同压强时,CO2的转化率见下表:

①下列关于上述可逆反应的说法正确的是
| A.在恒温、恒容的密闭容器中,当反应混合气体的密度保持不变时反应达平衡状态 |
| B.当v正(CO2)=" 3" v逆(H2),反应达平衡状态 |
| C.当n(CO2):n(H2)=1:3时,反应达平衡状态 |
| D.a > 60% |
②上述反应的化学平衡常数的表达式为
③该反应的ΔH
④在压强为P、温度为500K、投料比n(CO2):n(H2)=1:3的条件下,反应达平衡状态时H2的转化率为
(3)以甲醇、空气、KOH溶液为原料可设计成燃料电池:放电时,负极的电极反应式为
您最近一年使用:0次
2016-12-09更新
|
386次组卷
|
2卷引用:2015-2016学年贵州省习水县一中高二下学期期中考试化学试卷
8 . 工业上可由天然气为原料制备甲醇,也可由水煤气合成甲醇。
(1)已知2CH4(g)+O2(g)=2CO2(g)+4H2(g) △H=akJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=bkJ/mol
试写出由CH4和O2制取甲烷的热化学方程式:___________________。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。图甲是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况。从反应开始到平衡,用CO表示平均反应速率v(CO)=____________,该反应的平衡常数表达式为______________。
CH3OH(g)。图甲是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况。从反应开始到平衡,用CO表示平均反应速率v(CO)=____________,该反应的平衡常数表达式为______________。

(3)在一容积可变的密闭容器中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示.
①下列说法不能判断该反应达到化学平衡状态的是___________。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA___________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=___________L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则电池负极反应的离子方程式为_____________。
②若电解质溶液中KOH的物质的量为1.0mol,当有0.75mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______________。
(1)已知2CH4(g)+O2(g)=2CO2(g)+4H2(g) △H=akJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=bkJ/mol
试写出由CH4和O2制取甲烷的热化学方程式:___________________。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)
 CH3OH(g)。图甲是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况。从反应开始到平衡,用CO表示平均反应速率v(CO)=____________,该反应的平衡常数表达式为______________。
CH3OH(g)。图甲是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况。从反应开始到平衡,用CO表示平均反应速率v(CO)=____________,该反应的平衡常数表达式为______________。
(3)在一容积可变的密闭容器中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示.
①下列说法不能判断该反应达到化学平衡状态的是___________。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA___________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=___________L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则电池负极反应的离子方程式为_____________。
②若电解质溶液中KOH的物质的量为1.0mol,当有0.75mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______________。
您最近一年使用:0次
2015-11-10更新
|
773次组卷
|
2卷引用:2016届贵州省贵阳一中高三上学期第二次月考理综化学试卷



