2022高三·全国·专题练习
1 . 化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:

回答下列问题:
(1) 的反应类型是
的反应类型是___________ 。
(2)化合物B核磁共振氢谱的吸收峰有___________ 组。
(3)化合物C的结构简式为___________ 。
(4) 的过程中,被还原的官能团是
的过程中,被还原的官能团是___________ ,被氧化的官能团是___________ 。
(5)若只考虑氟的位置异构,则化合物F的同分异构体有___________ 种。
(6)已知 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为___________ 。
(7) 配合物可催化
配合物可催化 转化中
转化中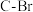 键断裂,也能催化反应①:
键断裂,也能催化反应①:
反应①: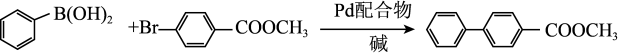
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子 (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
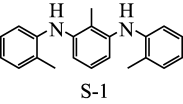
根据上述信息,甲、乙两组合成的 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是___________ 。

回答下列问题:
(1)
 的反应类型是
的反应类型是(2)化合物B核磁共振氢谱的吸收峰有
(3)化合物C的结构简式为
(4)
 的过程中,被还原的官能团是
的过程中,被还原的官能团是(5)若只考虑氟的位置异构,则化合物F的同分异构体有
(6)已知
 、
、 和
和 的产率分别为70%、82%和80%,则
的产率分别为70%、82%和80%,则 的总产率为
的总产率为(7)
 配合物可催化
配合物可催化 转化中
转化中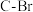 键断裂,也能催化反应①:
键断裂,也能催化反应①:反应①:
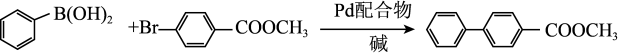
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子
 (结构如下图所示)。在合成
(结构如下图所示)。在合成 的过程中,甲组使用了
的过程中,甲组使用了 催化剂,并在纯化过程中用沉淀剂除
催化剂,并在纯化过程中用沉淀剂除 ;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
根据上述信息,甲、乙两组合成的
 产品催化性能出现差异的原因是
产品催化性能出现差异的原因是
您最近一年使用:0次
2022-07-12更新
|
9052次组卷
|
15卷引用:新疆乌鲁木齐市第四十中学2023-2024学年高三上学期11月月考化学试题
新疆乌鲁木齐市第四十中学2023-2024学年高三上学期11月月考化学试题(已下线)专题18 有机化学基础(综合题)-2022年高考真题模拟题分项汇编2022年湖北省高考真题化学试题(已下线)2022年湖北省高考真题变式题16-19(已下线)考点45 有机化合物的合成-备战2023年高考化学一轮复习考点帮(全国通用)湖北省武汉市第一中学2022-2023学年高三上学期9月开学考试化学试题陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题陕西师范大学附属中学、渭北中学等2023届高三上学期期初检测联考化学试题(已下线)第35讲 生物大分子与合成高分子(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)热点情景汇编-专题十一 有机推断中的新发展(已下线)第一部分 二轮专题突破 大题突破5 有机综合推断(选考)(已下线)专题21 有机推断题(已下线)专题21 有机推断题(已下线)专题16 有机合成与推断-2023年高考化学真题题源解密(新高考专用)(已下线)考点39 有机推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
2 . 我国科学家实现了喹啉并内酯的高选择性制备。合成路线如下图。
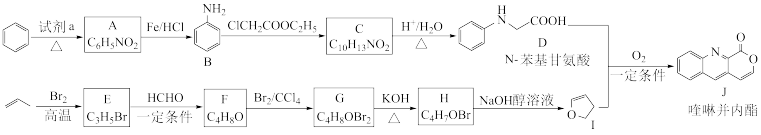
已知:
i. R-Br+R’CHO
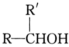
ii.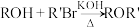
iii.碳碳双键直接与羟基相连不稳定
(1)试剂a为_______ ;B中官能团的电子式为_______ 。
(2)B(苯胺)具有碱性,B转化为C的反应中,使B过量可以提高 的平衡转化率,其原因是
的平衡转化率,其原因是_______ (写出一条即可)。
(3)C→D的化学方程式为_______ 。
(4)H的结构简式为_______ ;H→I的反应类型为_______ 。
(5)K是F的同分异构体,其中能使溴的四氯化碳溶液褪色的结构还有_______ 种(不考虑立体异构)。其中核磁共振氢谱有3组峰,峰面积之比为2:3:3的结构简式为_______ 。
(6)D和I转化成J的反应过程中还生成水,理论上该过程中消耗的 与生成的J的物质的量之比为
与生成的J的物质的量之比为_______ 。

已知:
i. R-Br+R’CHO

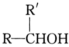
ii.
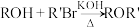
iii.碳碳双键直接与羟基相连不稳定
(1)试剂a为
(2)B(苯胺)具有碱性,B转化为C的反应中,使B过量可以提高
 的平衡转化率,其原因是
的平衡转化率,其原因是(3)C→D的化学方程式为
(4)H的结构简式为
(5)K是F的同分异构体,其中能使溴的四氯化碳溶液褪色的结构还有
(6)D和I转化成J的反应过程中还生成水,理论上该过程中消耗的
 与生成的J的物质的量之比为
与生成的J的物质的量之比为
您最近一年使用:0次
2022-01-16更新
|
799次组卷
|
4卷引用:新疆乌鲁木齐市高级中学2024届高三上学期第一次模拟考试化学试题
21-22高三上·北京·期中
名校
3 . 奥昔布宁是具有解痉和抗胆碱作用的药物。其合成路线如下:
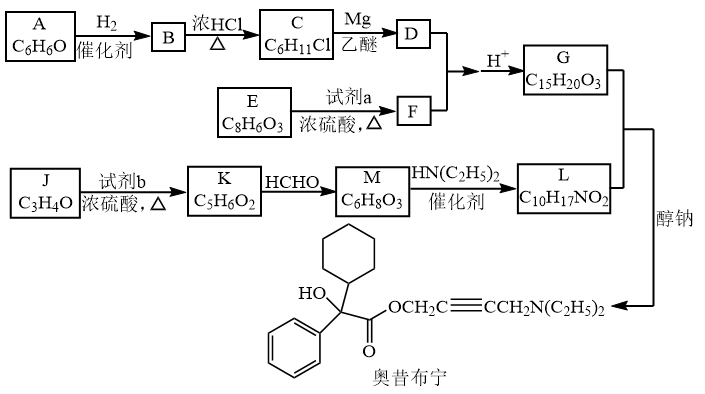
已知:
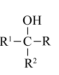
i.R-Cl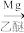 RMgCl
RMgCl 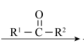

ii.R3COOR4 + R5COOR6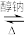 R3COOR6+ R5COOR4
R3COOR6+ R5COOR4
(1)A是芳香族化合物,A分子中含氧官能团是___________ 。
(2)B→C的反应类型是___________ 。
(3)E的结构简式___________ 。试剂a为___________ 。
(4)G的结构简式___________ 。
(5)J→K的化学方程式是___________ 。
(6)M→L的化学方程式是___________ 。
(7)已知: G、L和奥昔布宁的沸点均高于200℃,G和L发生反应合成奥昔布宁时,通过在70℃左右蒸出___________ (填物质名称)来促进反应。

已知:
i.R-Cl
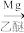 RMgCl
RMgCl 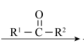


ii.R3COOR4 + R5COOR6
 R3COOR6+ R5COOR4
R3COOR6+ R5COOR4(1)A是芳香族化合物,A分子中含氧官能团是
(2)B→C的反应类型是
(3)E的结构简式
(4)G的结构简式
(5)J→K的化学方程式是
(6)M→L的化学方程式是
(7)已知: G、L和奥昔布宁的沸点均高于200℃,G和L发生反应合成奥昔布宁时,通过在70℃左右蒸出
您最近一年使用:0次
4 . 点击化学及其应用
2001年诺贝尔化学奖获得者K.B.Sharpless教授发现,在亚铜的催化下,末端炔烃可以高区域选择性地与叠氮化合物发生高效的点击(Click)反应,类似炔烃与叠氮化合物发生了1,3-偶极环加成反应。这一反应目前已经应用于生物化学等交叉领域,Sharpless教授也因此获得了2022年度诺贝尔化学奖。
Click反应示例:
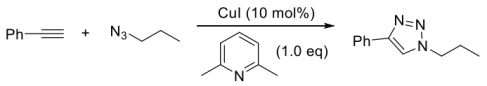
科学家以环己烯为原料,经过多步转化和click反应合成化合物E,请按要求回答下面的问题。在四氢呋喃溶剂中,环己烯与NBS(N-溴代丁二酰亚胺)反应生成关键中间体A,A与水发生反应生成化合物B化合物B经过碳酸钾处理可以高产率合成化合物C,化合物C也可以通过环己烯与间氯过氧苯甲酸反应直接制得;化合物C与叠氮化钠反应可以合成D,D与苯乙炔在碱的存在下及碘化亚铜的催化下发生Click反应生成E。
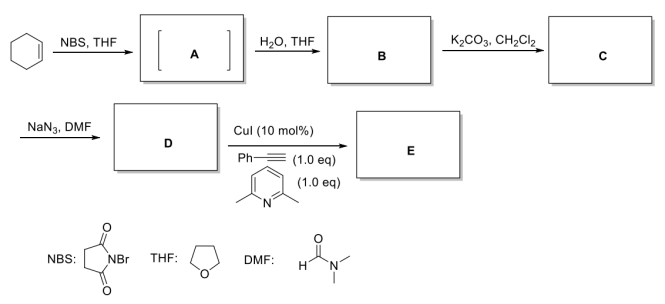
请给出关键中间体A,产物B、C、D、E的结构式,请用楔形式标注产物中的立体化学_____ 、_____ 、_____ 、_____ 、_____ 。
2001年诺贝尔化学奖获得者K.B.Sharpless教授发现,在亚铜的催化下,末端炔烃可以高区域选择性地与叠氮化合物发生高效的点击(Click)反应,类似炔烃与叠氮化合物发生了1,3-偶极环加成反应。这一反应目前已经应用于生物化学等交叉领域,Sharpless教授也因此获得了2022年度诺贝尔化学奖。
Click反应示例:

科学家以环己烯为原料,经过多步转化和click反应合成化合物E,请按要求回答下面的问题。在四氢呋喃溶剂中,环己烯与NBS(N-溴代丁二酰亚胺)反应生成关键中间体A,A与水发生反应生成化合物B化合物B经过碳酸钾处理可以高产率合成化合物C,化合物C也可以通过环己烯与间氯过氧苯甲酸反应直接制得;化合物C与叠氮化钠反应可以合成D,D与苯乙炔在碱的存在下及碘化亚铜的催化下发生Click反应生成E。

请给出关键中间体A,产物B、C、D、E的结构式,请用楔形式标注产物中的立体化学
您最近一年使用:0次
名校
解题方法
5 . 以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.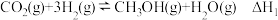
Ⅱ.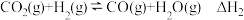
回答下列问题:
(1)反应I、II的1nK(K代表化学平衡常数)随 (温度的倒数)的变化如图所示。据图判断,升高温度时,反应CO(g)+2H2(g)
(温度的倒数)的变化如图所示。据图判断,升高温度时,反应CO(g)+2H2(g) CH3OH(g)的化学平衡常数将
CH3OH(g)的化学平衡常数将___________ (填“增大”“减小”或“不变”)。

(2)上述反应体系在一定条件下建立平衡后,若在恒温恒压下充入氦气,反应Ⅱ的平衡将___________ (填“正向”“逆向”或“不”)移动;若将反应体系体积压缩至原来一半,重新达到平衡时两反应所需时间tI___________ tII(填“>”“<”或“=”)。
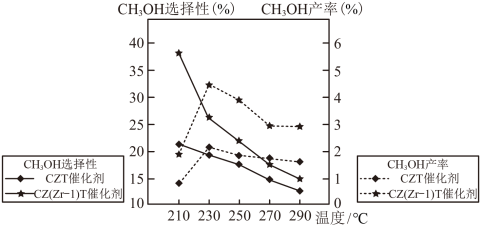
(3)恒压条件下,将CO2和H2按体积比1:3混合,初始压强为P0,在不同催化剂作用下发生反应I和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
已知:CH3OH的选择性=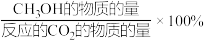
①在上述条件下合成甲醇的工业条件是___________ 。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr—1)T
②在230℃以上,升高温度CO2的转化率增大,但甲醇的产率降低,原因是___________ 。
③已知反应Ⅱ的速率方程可表示为 ,
,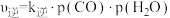 ,其中
,其中 分别为正、逆反应的速率常数,1gk与
分别为正、逆反应的速率常数,1gk与 的关系如图所示,①、②、③、④四条斜线中,表示1gk正的是
的关系如图所示,①、②、③、④四条斜线中,表示1gk正的是___________ ;230℃下,图中A、B、C、D点的纵坐标分别为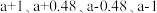 ,达到平衡时,测得体系中
,达到平衡时,测得体系中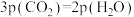 ,以物质的分压表示的反应I的平衡常数
,以物质的分压表示的反应I的平衡常数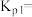
___________ 。(已知:10-0.48=0.33,10-0.52=0.30)

Ⅰ.
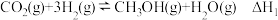
Ⅱ.
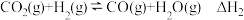
回答下列问题:
(1)反应I、II的1nK(K代表化学平衡常数)随
 (温度的倒数)的变化如图所示。据图判断,升高温度时,反应CO(g)+2H2(g)
(温度的倒数)的变化如图所示。据图判断,升高温度时,反应CO(g)+2H2(g) CH3OH(g)的化学平衡常数将
CH3OH(g)的化学平衡常数将
(2)上述反应体系在一定条件下建立平衡后,若在恒温恒压下充入氦气,反应Ⅱ的平衡将
(3)恒压条件下,将CO2和H2按体积比1:3混合,初始压强为P0,在不同催化剂作用下发生反应I和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。

已知:CH3OH的选择性=
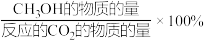
①在上述条件下合成甲醇的工业条件是
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr—1)T
②在230℃以上,升高温度CO2的转化率增大,但甲醇的产率降低,原因是
③已知反应Ⅱ的速率方程可表示为
 ,
,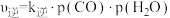 ,其中
,其中 分别为正、逆反应的速率常数,1gk与
分别为正、逆反应的速率常数,1gk与 的关系如图所示,①、②、③、④四条斜线中,表示1gk正的是
的关系如图所示,①、②、③、④四条斜线中,表示1gk正的是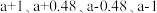 ,达到平衡时,测得体系中
,达到平衡时,测得体系中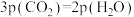 ,以物质的分压表示的反应I的平衡常数
,以物质的分压表示的反应I的平衡常数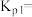

您最近一年使用:0次
2022-06-02更新
|
1559次组卷
|
6卷引用:新疆维吾尔自治区阿克苏地区第二中学2022-2023学年高三上学期第一次月考化学试题
新疆维吾尔自治区阿克苏地区第二中学2022-2023学年高三上学期第一次月考化学试题山东省实验中学2022届高三打靶化学试题(已下线)第22讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(全国通用)山东省青岛第二中学2022-2023学年高三上学期期中考试化学试题山东省济宁市泗水县2023-2024学年高三上学期期中考试化学试题宁夏银川市银川一中2024届高三一模理综-化学试题
名校
解题方法
6 . 1,6—己二酸是合成高分子化合物尼龙的重要原料之一,可用六个碳原子的化合物氧化制备。下图是合成尼龙的反应流程:

已知:
 2CH3COOH
2CH3COOH
完成下列填空:
(1)写出反应类型:反应①_____ 反应②__________ 。
(2)A和B的结构简式为_______ 、_________ 。
(3)在上述反应流程的物质中,含氢原子位置不同最多的物质是___________ (填名称),最少的物质是________ (填结构简式)。
(4)由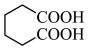 合成尼龙的化学方程式为
合成尼龙的化学方程式为___________ 。
(5)由A通过两步制备1,3—环己二烯的合成线路为:_____ 。

已知:

 2CH3COOH
2CH3COOH完成下列填空:
(1)写出反应类型:反应①
(2)A和B的结构简式为
(3)在上述反应流程的物质中,含氢原子位置不同最多的物质是
(4)由
 合成尼龙的化学方程式为
合成尼龙的化学方程式为(5)由A通过两步制备1,3—环己二烯的合成线路为:
您最近一年使用:0次
2020-03-22更新
|
234次组卷
|
3卷引用:新疆乌鲁木齐市第十二中学2023-2024学年高三上学期11月月考化学试题
7 . 苯乙烯(C6H5CH=CH2)是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等。工业上以乙苯(C6H5CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:
C6H5CH2CH3(g) C6H5CH=CH2(g)+H2(g)
C6H5CH=CH2(g)+H2(g)  H
H
(1)已知:H2和CO的燃烧热( H)分别为-285.8
H)分别为-285.8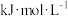 和-283.0
和-283.0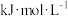 ;
;
C6H5CH2CH3(g)+CO2 (g) C6H5CH=CH2(g)+CO(g)+H2O(l)
C6H5CH=CH2(g)+CO(g)+H2O(l)  H=+114.8 kJ·mol-1,则制取苯乙烯反应的
H=+114.8 kJ·mol-1,则制取苯乙烯反应的 H为
H为_________
(2)向密闭容器中加入1 mol乙苯,在恒温恒容条件下合成苯乙烯,达平衡时,反应的能量变化为QkJ。下列说法正确的是 _________。
达平衡时反应能量变化为( H-Q)kJ
H-Q)kJ
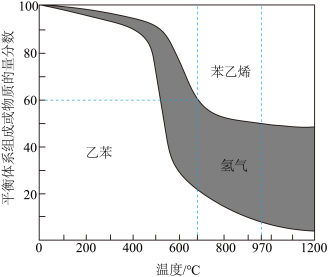
(3)向2 L密闭容器中加入1 mol乙苯发生反应,达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。700℃时,乙苯的平衡转化率为_______ ,此温度下该反应的平衡常数为 ______ ;温度高于970℃时,苯乙烯的产率不再增加,其原因可能是_________ 。
(4)含苯乙烯的废水排放会对环境造成严重污染,可采用电解法去除废水中的苯乙烯,基本原理是在阳极材料MOx上生成自由基MOx(OH),其进一步氧化有机物生成CO2,该阳极的电极反应式为_________ ,若去除0.5 mol苯乙烯,两极共收集气体_________ mol。
C6H5CH2CH3(g)
 C6H5CH=CH2(g)+H2(g)
C6H5CH=CH2(g)+H2(g)  H
H(1)已知:H2和CO的燃烧热(
 H)分别为-285.8
H)分别为-285.8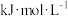 和-283.0
和-283.0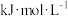 ;
;C6H5CH2CH3(g)+CO2 (g)
 C6H5CH=CH2(g)+CO(g)+H2O(l)
C6H5CH=CH2(g)+CO(g)+H2O(l)  H=+114.8 kJ·mol-1,则制取苯乙烯反应的
H=+114.8 kJ·mol-1,则制取苯乙烯反应的 H为
H为(2)向密闭容器中加入1 mol乙苯,在恒温恒容条件下合成苯乙烯,达平衡时,反应的能量变化为QkJ。下列说法正确的是 _________。
| A.升高温度,正反应速率减小,逆反应速率增大 |
| B.若继续加入1 mol乙苯,苯乙烯转化率增大 |
| C.压缩体积,平衡逆向移动,反应物浓度增大,生成物浓度减小 |
| D.相同条件下若起始加入1 mol苯乙烯和1 mol氢气 |
达平衡时反应能量变化为(
 H-Q)kJ
H-Q)kJ(3)向2 L密闭容器中加入1 mol乙苯发生反应,达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。700℃时,乙苯的平衡转化率为

(4)含苯乙烯的废水排放会对环境造成严重污染,可采用电解法去除废水中的苯乙烯,基本原理是在阳极材料MOx上生成自由基MOx(OH),其进一步氧化有机物生成CO2,该阳极的电极反应式为
您最近一年使用:0次
2016-12-09更新
|
614次组卷
|
2卷引用:新疆岳普湖县2021-2022学年高二下学期第一次学情调研测试化学试题



