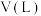1 . 硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为 。
(2)将1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是 。
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2
4FeS2+11 O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量各为多少?
(4)闪锌矿(主要成份为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。计算回答下列问题(计算保留2位小数)
取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是多少?
生产10吨98%的浓硫酸需要这种矿石多少吨?(反应过程中硫损失2%)
完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为 。
(2)将1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是 。
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2
4FeS2+11 O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量各为多少?
(4)闪锌矿(主要成份为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。计算回答下列问题(计算保留2位小数)
取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是多少?
生产10吨98%的浓硫酸需要这种矿石多少吨?(反应过程中硫损失2%)
您最近一年使用:0次
名校
解题方法
2 . 为确定某一铁铜样品中各成份的含量,某同学进行了如下实验:准确称取一份质量为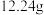 铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成
铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成 气体的体积为
气体的体积为 (已换成标准状况,假设生成的
(已换成标准状况,假设生成的 全部逸出),并测得剩余固体质量为
全部逸出),并测得剩余固体质量为 。各次实验的数据如下表:
。各次实验的数据如下表:
根据以上实验数据,请回答:
(1)上述实验当加入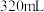 稀硝酸后,所发生反应的离子方程式为
稀硝酸后,所发生反应的离子方程式为______ 。
(2)稀硝酸的物质的量浓度为______  。
。
(3)样品中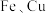 的物质的量之比为
的物质的量之比为______ 。
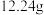 铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成
铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成 气体的体积为
气体的体积为 (已换成标准状况,假设生成的
(已换成标准状况,假设生成的 全部逸出),并测得剩余固体质量为
全部逸出),并测得剩余固体质量为 。各次实验的数据如下表:
。各次实验的数据如下表:稀硝酸体积 | 0 | 80 | 160 | 240 | 320 | 400 |
| 0 | 0.896 | 1.792 | 2.688 | 3.584 | 4.48 |
剩余固体质量 | 12.24 | 8.88 | 5.52 | 1.92 | 0 | 0 |
(1)上述实验当加入
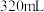 稀硝酸后,所发生反应的离子方程式为
稀硝酸后,所发生反应的离子方程式为(2)稀硝酸的物质的量浓度为
 。
。(3)样品中
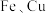 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
3 . 某 样品露置在空气中部分变质生成
样品露置在空气中部分变质生成 ,为确定其中
,为确定其中 和
和 的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸
的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸 ,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
(1)样品中物质的量之比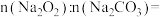
___________ 。
(2)盐酸的物质的量浓度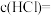
___________ 。
 样品露置在空气中部分变质生成
样品露置在空气中部分变质生成 ,为确定其中
,为确定其中 和
和 的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸
的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸 ,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸体积/mL | 100.0 | 100.0 | 100.0 | 100.0 |
| 样品质量/g | 2.62 | 3.93 | 5.24 | 6.55 |
| 气体总体积/mL | 448 | 560 | 448 | 560 |
(1)样品中物质的量之比
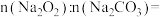
(2)盐酸的物质的量浓度
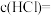
您最近一年使用:0次
4 . 实验室中有一瓶碳酸氢钠固体,因受热而部分变质(杂质为碳酸钠,假设杂质分布均匀)。为测其组成,称取3.784克样品溶于水,配成1000mL溶液。取出50mL该溶液,加入0.05mol/LBa(OH)2溶液至44.00mL时沉淀量最大。请计算
(1)0.05mol/LBa(OH)2溶液的c(OH-)=____ 。
(2)样品中n(NaHCO3):n(Na2CO3)=____ 。
(1)0.05mol/LBa(OH)2溶液的c(OH-)=
(2)样品中n(NaHCO3):n(Na2CO3)=
您最近一年使用:0次
解题方法
5 . 实验室中有一瓶碳酸钠固体,已有部分变质(假设杂质只有 ,并且杂质分布均匀)。为测定其组成,称取6.14g样品溶于水,配成100mL溶液。取出25.00mL该溶液,然后向溶液中滴加
,并且杂质分布均匀)。为测定其组成,称取6.14g样品溶于水,配成100mL溶液。取出25.00mL该溶液,然后向溶液中滴加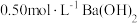 溶液至30.00mL时恰好完全沉淀。
溶液至30.00mL时恰好完全沉淀。
请计算:
(1)加入的 溶液中溶质的物质的量为
溶液中溶质的物质的量为_______ 。
(2)样品中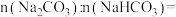
_______ 。
 ,并且杂质分布均匀)。为测定其组成,称取6.14g样品溶于水,配成100mL溶液。取出25.00mL该溶液,然后向溶液中滴加
,并且杂质分布均匀)。为测定其组成,称取6.14g样品溶于水,配成100mL溶液。取出25.00mL该溶液,然后向溶液中滴加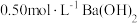 溶液至30.00mL时恰好完全沉淀。
溶液至30.00mL时恰好完全沉淀。请计算:
(1)加入的
 溶液中溶质的物质的量为
溶液中溶质的物质的量为(2)样品中
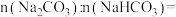
您最近一年使用:0次
6 . 计算
(1)在标准状况下,10.2gH2S 与标况下_______ LNH3含有相同的H原子。
(2)实验室中有一瓶碳酸氢钠固体,因受热而部分变质(杂质为Na2CO3,假设杂质分布均匀)。为测定其组成,称取4.420g样品溶于水,配成500mL溶液。取出50.00mL该溶液,加入0. 1000 mol/L Ba(OH)2溶液至50.00mL时沉淀量达到最大。请计算:
①25°C时,0.1000 mol/L Ba(OH)2溶液中的氢氧根离子浓度是_______ mol/L。
②样品中n(NaHCO3):n(Na2CO3)=_______ 。
(1)在标准状况下,10.2gH2S 与标况下
(2)实验室中有一瓶碳酸氢钠固体,因受热而部分变质(杂质为Na2CO3,假设杂质分布均匀)。为测定其组成,称取4.420g样品溶于水,配成500mL溶液。取出50.00mL该溶液,加入0. 1000 mol/L Ba(OH)2溶液至50.00mL时沉淀量达到最大。请计算:
①25°C时,0.1000 mol/L Ba(OH)2溶液中的氢氧根离子浓度是
②样品中n(NaHCO3):n(Na2CO3)=
您最近一年使用:0次
20-21高一下·浙江·阶段练习
名校
7 . 实验室中有一瓶碳酸氢钠固体,因受热而部分变质(杂质为Na2CO3,假设杂质分布均匀)。为测定其组成,称取1.892g样品溶于水,配成500mL溶液。取出25.00mL该溶液,加入0.050mol·L-1Ba(OH)2溶液至22.00mL时沉淀量达到最大。请计算:
(1)25℃时,0.050mol·L-1Ba(OH)2溶液中的氢氧根离子浓度是_______ mol/L
(2)样品中n(NaHCO3)∶n(Na2CO3)=_______ 。
(1)25℃时,0.050mol·L-1Ba(OH)2溶液中的氢氧根离子浓度是
(2)样品中n(NaHCO3)∶n(Na2CO3)=
您最近一年使用:0次
名校
解题方法
8 . 实验室中有一瓶碳酸氢钠固体,因受热而部分变质(杂质为Na2CO3,假设杂质分布均匀)。为测定其组成,用分析天平称称取1.7240g样品溶于水,配成500mL溶液。取出25.00mL该溶液,加入一定物质的量浓度的Ba(OH)2溶液至20.00mL时沉淀量达到最大值,过滤、洗涤、干燥,称量沉淀质量为0.1970 g。请计算:
(1)所加Ba(OH)2溶液的物质的量浓度为______ mol·L-1
(2)样品中n(NaHCO3) ∶n(Na2CO3)=___
(1)所加Ba(OH)2溶液的物质的量浓度为
(2)样品中n(NaHCO3) ∶n(Na2CO3)=
您最近一年使用:0次
2020-11-26更新
|
220次组卷
|
6卷引用:浙江省杭州地区(含周边)重点中学2020-2021学年高一上学期期中考试化学试题
浙江省杭州地区(含周边)重点中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】86.(已下线)【浙江新东方】108(已下线)【浙江新东方】在线化学21(已下线)【萧山新东方】萧山试卷解析浙江省瑞安中学2023-2024学年高一上学期12月月考化学试卷
20-21高一·浙江·阶段练习
解题方法
9 . 实验室中有一瓶碳酸氢钾固体,因受热而部分变质(杂质为K2CO3,假设杂质分布均匀)。为测定其组成,称取12.76 g样品溶于水,配成500 mL溶液。取出25.00 mL该溶液,加入0.1000 mol/LBa(OH)2 溶液至60.00mL时沉淀量达到最大。回答下列问题:
(1)写出碳酸氢钾固体受热分解的化学方程式:_______ 。
(2)写出样品溶液与Ba(OH)2溶液反应的离子方程式:_______ 。
(3)12.76g样品中碳酸氢钾物质的量为_______ ,碳酸钾物质的量为_______ 。
(1)写出碳酸氢钾固体受热分解的化学方程式:
(2)写出样品溶液与Ba(OH)2溶液反应的离子方程式:
(3)12.76g样品中碳酸氢钾物质的量为
您最近一年使用:0次
解题方法
10 . 实验室中有一瓶碳酸氢钠固体,因受热而部分变质(杂质为 Na2CO3,假设杂质分布均匀)。为测定其组成,称取1. 892 g 样品溶于水,配成 500 mL 溶液。取出 25. 00 mL 该溶液,加入 0. 050 mol • L-1 Ba(OH)2 溶液至 22. 00 mL 时沉淀量达到最大。
请计算:
(1)25°C时,0. 050mol •L-1Ba (OH)2溶液的pH=__________ 。
(2)样品中 n(NaHCO3):n ( Na2CO3)=__________ 。
请计算:
(1)25°C时,0. 050mol •L-1Ba (OH)2溶液的pH=
(2)样品中 n(NaHCO3):n ( Na2CO3)=
您最近一年使用:0次