名校
1 . 下表为某试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中 的物质的量浓度为
的物质的量浓度为___________  。
。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___________。
(3)实验室为了研究稀盐酸的化学性质,按图进行实验。
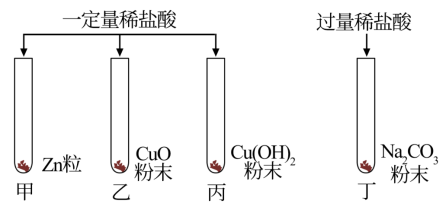
①丁试管中现象为___________ 。
②乙、丙试管均生成蓝色溶液,写出乙试管中发生反应的离子方程式:___________ 。
(4)下列给定状态下可以导电的是:(填序号)___________ 。
①固体食盐②生理盐水③蔗糖溶液④干冰⑤水银⑥熔融的氯化钠 ⑦氨水⑧盐酸⑨硫酸⑩石墨
| 盐酸 | |
| 分子式 |  |
| 相对分子质量 | 36.5 |
| 密度 | 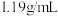 |
 的质量分数 的质量分数 | 36.5% |
(1)该浓盐酸中
 的物质的量浓度为
的物质的量浓度为 。
。(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___________。
A.溶液中 的物质的量 的物质的量 | B.溶液的物质的量浓度 |
C.溶液中 的数目 的数目 | D.溶液的密度 |

①丁试管中现象为
②乙、丙试管均生成蓝色溶液,写出乙试管中发生反应的离子方程式:
(4)下列给定状态下可以导电的是:(填序号)
①固体食盐②生理盐水③蔗糖溶液④干冰⑤水银⑥熔融的氯化钠 ⑦氨水⑧盐酸⑨硫酸⑩石墨
您最近一年使用:0次
2 . 回答下列问题
(1)分离豆浆和豆渣常用的实验方法为___________ 。
(2)已知R是一种金属,75.5gR(NO3)3中含有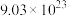 个硝酸根离子,则该硝酸盐的摩尔质量为
个硝酸根离子,则该硝酸盐的摩尔质量为___________ g/mol。
(3)在80g密度为dg/cm3的硫酸铁溶液中,含有2.8gFe3+,则此溶液中SO 的物质的量浓度为
的物质的量浓度为___________ mol/L。
(4) 在水溶液中的电离方程式为
在水溶液中的电离方程式为___________ 。
(5)二氧化硅(SiO2)是酸性氧化物,写出其与NaOH溶液反应的化学方程式:___________ 。
(1)分离豆浆和豆渣常用的实验方法为
(2)已知R是一种金属,75.5gR(NO3)3中含有
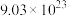 个硝酸根离子,则该硝酸盐的摩尔质量为
个硝酸根离子,则该硝酸盐的摩尔质量为(3)在80g密度为dg/cm3的硫酸铁溶液中,含有2.8gFe3+,则此溶液中SO
 的物质的量浓度为
的物质的量浓度为(4)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(5)二氧化硅(SiO2)是酸性氧化物,写出其与NaOH溶液反应的化学方程式:
您最近一年使用:0次
2021-11-23更新
|
123次组卷
|
2卷引用:陕西省武功县2021-2022学年高一上学期期中考试化学试题
解题方法
3 . 物质的量是联系宏观物质和微观粒子的桥梁。
(1)34g 与标准状况下
与标准状况下_______ L 含有相同数目的H原子。
含有相同数目的H原子。
(2)0.5L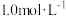
 溶液与0.2L
溶液与0.2L
 溶液中
溶液中 的物质的量浓度之比为
的物质的量浓度之比为_______ 。
(3)100mL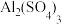 溶液中含有
溶液中含有 2.7g,则
2.7g,则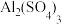 的物质的量浓度是
的物质的量浓度是_______ mol/L。
(4)同温同压下,体积比为 的
的 和CO,它们的物质的量之比为
和CO,它们的物质的量之比为_______ ,质量之比为_______ (填最简整数比)。
(5)设 为阿伏加德罗常数的值,已知ag某气体中含分子数为b,则该气体的摩尔质量为
为阿伏加德罗常数的值,已知ag某气体中含分子数为b,则该气体的摩尔质量为_______  。
。
(6)三种盐的混合溶液中含有0.2mol 、0.25mol
、0.25mol 、0.4mol
、0.4mol 和一定物质的量的
和一定物质的量的 ,则该混合溶液中含有
,则该混合溶液中含有 的个数为
的个数为_______ 。
(1)34g
 与标准状况下
与标准状况下 含有相同数目的H原子。
含有相同数目的H原子。(2)0.5L
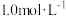
 溶液与0.2L
溶液与0.2L
 溶液中
溶液中 的物质的量浓度之比为
的物质的量浓度之比为(3)100mL
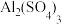 溶液中含有
溶液中含有 2.7g,则
2.7g,则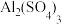 的物质的量浓度是
的物质的量浓度是(4)同温同压下,体积比为
 的
的 和CO,它们的物质的量之比为
和CO,它们的物质的量之比为(5)设
 为阿伏加德罗常数的值,已知ag某气体中含分子数为b,则该气体的摩尔质量为
为阿伏加德罗常数的值,已知ag某气体中含分子数为b,则该气体的摩尔质量为 。
。(6)三种盐的混合溶液中含有0.2mol
 、0.25mol
、0.25mol 、0.4mol
、0.4mol 和一定物质的量的
和一定物质的量的 ,则该混合溶液中含有
,则该混合溶液中含有 的个数为
的个数为
您最近一年使用:0次
解题方法
4 . 根据所学知识,可答下列问题:
(1)化学计量在中学化学中占有重要地位。
①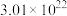 个
个 的物质的量为
的物质的量为___________  ,含有电子的物质的量为
,含有电子的物质的量为___________  。
。
②相同质量的 和
和 气体中所含氢原子个数比为
气体中所含氢原子个数比为___________ 。
③ 氢氧化钡溶液中含有
氢氧化钡溶液中含有 个
个 ,则
,则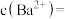
___________  (用
(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(2)下图是中学化学中常用于混合物的分离和提纯的装置:
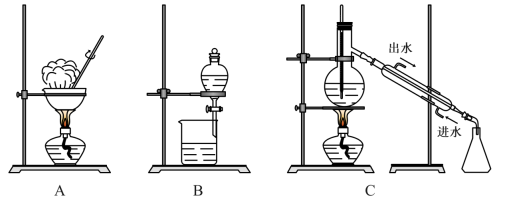
①装置A中玻璃棒的作用是___________ 。
②除去自来水中的 等杂质,选择装置
等杂质,选择装置___________ (填字母,下同),用四氯化碳提取碘水中的碘,选择装置___________ 。
③装置B分液时为使液体顺利滴下,应进行的具体操作是___________ ,再旋开分液漏斗下面的活塞。
④装置C中存在的一处错误是___________ 。
(1)化学计量在中学化学中占有重要地位。
①
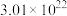 个
个 的物质的量为
的物质的量为 ,含有电子的物质的量为
,含有电子的物质的量为 。
。②相同质量的
 和
和 气体中所含氢原子个数比为
气体中所含氢原子个数比为③
 氢氧化钡溶液中含有
氢氧化钡溶液中含有 个
个 ,则
,则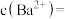
 (用
(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(2)下图是中学化学中常用于混合物的分离和提纯的装置:

①装置A中玻璃棒的作用是
②除去自来水中的
 等杂质,选择装置
等杂质,选择装置③装置B分液时为使液体顺利滴下,应进行的具体操作是
④装置C中存在的一处错误是
您最近一年使用:0次
5 . 国家规定,酿造食醋的总酸含量标准为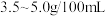 (总酸含量即
(总酸含量即 食醋中含醋酸的质量)。某兴趣小组为测定一市售食醋的总酸含量,进行了实验。实验后,得知
食醋中含醋酸的质量)。某兴趣小组为测定一市售食醋的总酸含量,进行了实验。实验后,得知 该食醋样品与
该食醋样品与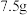 溶质的质量分数为
溶质的质量分数为 的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准
的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准______ 。(食醋和氢氧化钠反应的化学方程式: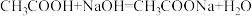 假设该市售食醋样品中其它物质不与氢氧化钠发生反应)
假设该市售食醋样品中其它物质不与氢氧化钠发生反应)
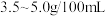 (总酸含量即
(总酸含量即 食醋中含醋酸的质量)。某兴趣小组为测定一市售食醋的总酸含量,进行了实验。实验后,得知
食醋中含醋酸的质量)。某兴趣小组为测定一市售食醋的总酸含量,进行了实验。实验后,得知 该食醋样品与
该食醋样品与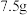 溶质的质量分数为
溶质的质量分数为 的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准
的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准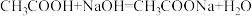 假设该市售食醋样品中其它物质不与氢氧化钠发生反应)
假设该市售食醋样品中其它物质不与氢氧化钠发生反应)
您最近一年使用:0次
6 . 已知下列物质:①NH3,②稀硫酸,③氢氧化钡,④饱和FeCl3溶液,⑤稀硝酸,⑥硫酸铝。根据上述提供的物质,回答下列问题:
(1)属于非电解质的是_______ (填序号),属于电解质的是_______ (填序号)。
(2)上述物质间发生的某反应的离子方程式为H++OH-=H2O,则该反应的化学方程式为_______ 。
(3)实验室制备少量Fe(OH)3胶体所用的物质是_______ (填序号),具体操作是_______ ,Fe(OH)3胶体与稀硫酸是两种不同的分散系,其本质区别是_______ 。
(4)实验室配制245 mL 0.5 mol·L-1硫酸铝溶液,从配制好的溶液中取出100 mL,其中硫酸铝的浓度是_______ mol/L,含有的SO 的数目为
的数目为_______ (设NA为阿伏加德罗常数的值),将该100 mL稀释至200 mL,硫酸铝的浓度是_______ mol/L, Al3+的浓度是_______ mol/L。
(1)属于非电解质的是
(2)上述物质间发生的某反应的离子方程式为H++OH-=H2O,则该反应的化学方程式为
(3)实验室制备少量Fe(OH)3胶体所用的物质是
(4)实验室配制245 mL 0.5 mol·L-1硫酸铝溶液,从配制好的溶液中取出100 mL,其中硫酸铝的浓度是
 的数目为
的数目为
您最近一年使用:0次
7 . 回答下列问题:
(1)现有12.8gCO和CO2混合气体,在标准状况下的体积为8.96L,该混合气体的平均摩尔质量为_______ ;
(2)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为_______ ,密度之比为_______ 。
(3)在标准状况下,4 g H2、11.2 L O2、1 mol H2O中,所含分子数最多的是_______ (填化学式),质量最大的是_______ (填化学式)。
(4)用等体积的0.1 mol·L-1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、MgSO4三种溶液中的SO 都恰好完全沉淀,则三种硫酸盐的物质的量浓度之比为
都恰好完全沉淀,则三种硫酸盐的物质的量浓度之比为_______ 。
(5)同温同压下的氧气和氢气,若体积相同时,两种气体的质量比为_______ ,若质量相等时,两种气体的体积比为_______ 。
(6)Cl‒浓度为0.4mol·L‒1的MgCl2溶液的物质的量浓度为_______ mol·L-1,200mL该MgCl2溶液中含Mg2+的数目为_______ 。
(1)现有12.8gCO和CO2混合气体,在标准状况下的体积为8.96L,该混合气体的平均摩尔质量为
(2)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为
(3)在标准状况下,4 g H2、11.2 L O2、1 mol H2O中,所含分子数最多的是
(4)用等体积的0.1 mol·L-1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、MgSO4三种溶液中的SO
 都恰好完全沉淀,则三种硫酸盐的物质的量浓度之比为
都恰好完全沉淀,则三种硫酸盐的物质的量浓度之比为(5)同温同压下的氧气和氢气,若体积相同时,两种气体的质量比为
(6)Cl‒浓度为0.4mol·L‒1的MgCl2溶液的物质的量浓度为
您最近一年使用:0次
名校
解题方法
8 . 将73.0g HCl溶于水中,配成2L溶液,试计算(写出计算过程):
(1)气体的物质的量______ 。
(2)HCl在标况下的体积______ 。
(3)盐酸的浓度______ 。
(1)气体的物质的量
(2)HCl在标况下的体积
(3)盐酸的浓度
您最近一年使用:0次
名校
解题方法
9 . 某0.2L无土栽培用的营养液中含有KCl、K2SO4、NH4Cl三种溶质,测得该营养液中部分离子的浓度柱状图如图甲所示:
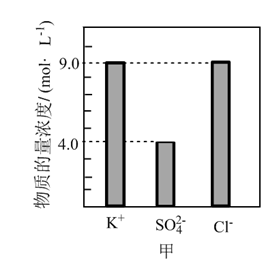
(1)该营养液中K2SO4的物质的量浓度为___________ mol·L-1,含KCl的质量为___________ 。
(2)该营养液中NH4Cl的物质的量为___________ 。
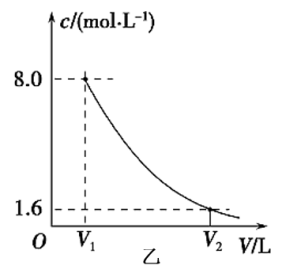
(3)将该营养液加水稀释,稀释过程中NH 的浓度(c)随溶液体积(V)变化的曲线如图乙所示,则V1=
的浓度(c)随溶液体积(V)变化的曲线如图乙所示,则V1=___________ ,V2=___________ 。

(1)该营养液中K2SO4的物质的量浓度为
(2)该营养液中NH4Cl的物质的量为
(3)将该营养液加水稀释,稀释过程中NH
 的浓度(c)随溶液体积(V)变化的曲线如图乙所示,则V1=
的浓度(c)随溶液体积(V)变化的曲线如图乙所示,则V1=
您最近一年使用:0次
2021-10-21更新
|
467次组卷
|
14卷引用:陕西省耀州中学2021-2022学年高一上学期第一次月考化学试题
陕西省耀州中学2021-2022学年高一上学期第一次月考化学试题山东省烟台市第二中学2019-2020学年高一10月月考化学试题福建省建瓯市芝华中学2019-2020学年高一上学期第一次阶段考试化学试题(已下线)【南昌新东方】2019 南大附中 高一上第二次月考高一必修第一册(鲁科2019)第1章第3节 化学中常用的物理量——物质的量福建省龙岩市上杭县第一中学2021届高三上学期10月月考化学试题(已下线)2.3.3 物质的量浓度(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)福建省莆田第一中学2021届高三上学期期中考试化学试题甘肃省镇原县第二中学2020-2021学年高一上学期期中考试化学试题北京市海淀区北方交通大学附属中学2019-2020学年高一上学期10月月考化学试题(已下线)第05讲 物质的量浓度-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)第三节 物质的量 第3课时 物质的量浓度广东省揭阳市惠来县第一中学2022-2023学年高一上学期12月第二阶段考试化学试题作业(六) 物质的量浓度
名校
10 . 回答下列问题:
(1)18.6gNa2X含有0.6molNa+,则X的相对原子质量为___ 。
(2)标准状况下,1.6g某气态氧化物RO2体积为0.56L,RO2的摩尔质量为___ 。
(3)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,其中NH3的体积分数为___ 。
(4)相同条件下,H2和O2的质量比为m∶n的混合气体,其平均相对分子质量是___ 。
(5)同温同压下,等质量的O2和CO2,体积之比为___ 。
(6)某物质A在一定条件下加热完全分解,产物都是气体。分解方程式为4A B+2C+3D,测得生成的混合气体对甲烷的相对密度为
B+2C+3D,测得生成的混合气体对甲烷的相对密度为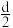 ,则A的相对分子质量为
,则A的相对分子质量为___ 。
(7)将标准状况下4.48LHCl气体通入0.5L水中(水的密度为1g/cm3),HCl完全溶解得到的盐酸溶液的密度为1.1g/cm3,该盐酸的物质的量浓度为____ mol·L-1(保留到小数点后一位小数)。
(8)将20.0g氢氧化钠固体溶于水配成100mL溶液,其密度为1.25g·mL-1。从该溶液中取出10mL,将其加水稀释到100mL,稀释后溶液中氢氧化钠的物质的量浓度为___ 。将一定体积的原溶液和稀释后的溶液按1:4的体积比混合(忽略混合时溶液体积变化),所得混合溶液中氢氧化钠的物质的量浓度为___ 。
(1)18.6gNa2X含有0.6molNa+,则X的相对原子质量为
(2)标准状况下,1.6g某气态氧化物RO2体积为0.56L,RO2的摩尔质量为
(3)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,其中NH3的体积分数为
(4)相同条件下,H2和O2的质量比为m∶n的混合气体,其平均相对分子质量是
(5)同温同压下,等质量的O2和CO2,体积之比为
(6)某物质A在一定条件下加热完全分解,产物都是气体。分解方程式为4A
 B+2C+3D,测得生成的混合气体对甲烷的相对密度为
B+2C+3D,测得生成的混合气体对甲烷的相对密度为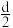 ,则A的相对分子质量为
,则A的相对分子质量为(7)将标准状况下4.48LHCl气体通入0.5L水中(水的密度为1g/cm3),HCl完全溶解得到的盐酸溶液的密度为1.1g/cm3,该盐酸的物质的量浓度为
(8)将20.0g氢氧化钠固体溶于水配成100mL溶液,其密度为1.25g·mL-1。从该溶液中取出10mL,将其加水稀释到100mL,稀释后溶液中氢氧化钠的物质的量浓度为
您最近一年使用:0次
2021-10-20更新
|
163次组卷
|
2卷引用:陕西省西安市长安区第一中学2021-2022学年上学期高一10月月考化学试题



