11-12高一上·河南开封·期中
1 . 为测定氯化钾和硫酸钾混合物中氯化钾的含量,某同学设计了如下实验:称量样品,溶解,添加适量A溶液,过滤,得沉淀和滤液B,将沉淀洗涤,烘干,得物质C。
回答下列问题:
(1)溶液A溶质的化学式_______ ,物质C的化学式_______ 。
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码质量为26g,游码为0.4g,则右盘样品实际质量是_______ 。
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是_______ 。
(4)若C的质量为23.3g,则原混合物中氯化钾的质量分数为_______ 。
回答下列问题:
(1)溶液A溶质的化学式
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码质量为26g,游码为0.4g,则右盘样品实际质量是
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是
(4)若C的质量为23.3g,则原混合物中氯化钾的质量分数为
您最近一年使用:0次
名校
2 . Ⅰ.X、Y、Z三种可溶性盐,其阳离子分别是 、
、 、
、 中的某一种,阴离子分别是
中的某一种,阴离子分别是 、
、 、
、 ,中的某一种。现进行以下实验:
,中的某一种。现进行以下实验:
①将三种盐各取少量,分别溶于盛有5mL蒸馏水的三支试管中,只有X盐溶液呈蓝色。
②分别向三支试管中加入2mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象。
回答下列问题:
(1)根据上述事实,推断这三种盐的化学式:X_______ ,Y_______ ,Z_______ 。
(2)写出下列反应的离子方程式。
X与氢氧化钡溶液反应:_______ 。
Y与盐酸反应:_______ 。
Ⅱ.有关物质的量的计算
(3) 和
和 一定条件下可以发生反应
一定条件下可以发生反应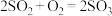 ,若有a mol
,若有a mol  与b mol
与b mol  充分反应,则反应后硫原子与氧原子的个数比为
充分反应,则反应后硫原子与氧原子的个数比为_______ (用含a、b的代数式表示)。
(4)36g CO与 的混合气体与足量
的混合气体与足量 充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与
充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与 的混合气体的总物质的量为
的混合气体的总物质的量为_______ mol,其中的CO在标准状况下的体积为_______ L。
(5)用质量分数为98%,密度为1.84g/mL的浓硫酸配制1mol/L的稀硫酸500mL,则需用量筒量取浓硫酸的体积为_______ 。
 、
、 、
、 中的某一种,阴离子分别是
中的某一种,阴离子分别是 、
、 、
、 ,中的某一种。现进行以下实验:
,中的某一种。现进行以下实验:①将三种盐各取少量,分别溶于盛有5mL蒸馏水的三支试管中,只有X盐溶液呈蓝色。
②分别向三支试管中加入2mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象。
回答下列问题:
(1)根据上述事实,推断这三种盐的化学式:X
(2)写出下列反应的离子方程式。
X与氢氧化钡溶液反应:
Y与盐酸反应:
Ⅱ.有关物质的量的计算
(3)
 和
和 一定条件下可以发生反应
一定条件下可以发生反应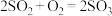 ,若有a mol
,若有a mol  与b mol
与b mol  充分反应,则反应后硫原子与氧原子的个数比为
充分反应,则反应后硫原子与氧原子的个数比为(4)36g CO与
 的混合气体与足量
的混合气体与足量 充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与
充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与 的混合气体的总物质的量为
的混合气体的总物质的量为(5)用质量分数为98%,密度为1.84g/mL的浓硫酸配制1mol/L的稀硫酸500mL,则需用量筒量取浓硫酸的体积为
您最近一年使用:0次
名校
3 . 聚合硫酸铁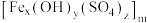 简称PFS,是一种高效絮凝剂,广泛用于水的净化,其中铁元素为+3价。
简称PFS,是一种高效絮凝剂,广泛用于水的净化,其中铁元素为+3价。
(1)聚合硫酸铁PFS化学式中x、y、z之间的等量关系式是______ 。
(2)用聚合硫酸铁PFS进行模拟净化高岭土废水。该高岭土废水净化效果(即浊度去除率)受絮凝剂的投加量及 的影响如图1、图2所示:
的影响如图1、图2所示:

可知聚合硫酸铁PFS最佳投加量是______  ,最佳
,最佳 是
是________ 。
(3)为测定某聚合硫酸铁样品中铁的质量分数,进行如下实验:
a.准确称取 该聚合硫酸铁样品溶于适量的硫酸,配成
该聚合硫酸铁样品溶于适量的硫酸,配成 溶液A。
溶液A。
b.准确量取 溶液A,加入足量铜粉,将
溶液A,加入足量铜粉,将 还原为
还原为 ,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并配成溶液B。
,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并配成溶液B。
c.用 的酸性
的酸性 溶液滴加到溶液B中至恰好反应完全,消耗
溶液滴加到溶液B中至恰好反应完全,消耗 溶液
溶液 。
。
反应原理: (未配平),请先配平步骤c中的离子方程式
(未配平),请先配平步骤c中的离子方程式_________ ,并通过计算确定该聚合硫酸铁样品中铁的质量分数______ (写出计算过程)。
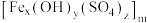 简称PFS,是一种高效絮凝剂,广泛用于水的净化,其中铁元素为+3价。
简称PFS,是一种高效絮凝剂,广泛用于水的净化,其中铁元素为+3价。(1)聚合硫酸铁PFS化学式中x、y、z之间的等量关系式是
(2)用聚合硫酸铁PFS进行模拟净化高岭土废水。该高岭土废水净化效果(即浊度去除率)受絮凝剂的投加量及
 的影响如图1、图2所示:
的影响如图1、图2所示:
可知聚合硫酸铁PFS最佳投加量是
 ,最佳
,最佳 是
是(3)为测定某聚合硫酸铁样品中铁的质量分数,进行如下实验:
a.准确称取
 该聚合硫酸铁样品溶于适量的硫酸,配成
该聚合硫酸铁样品溶于适量的硫酸,配成 溶液A。
溶液A。b.准确量取
 溶液A,加入足量铜粉,将
溶液A,加入足量铜粉,将 还原为
还原为 ,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并配成溶液B。
,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并配成溶液B。c.用
 的酸性
的酸性 溶液滴加到溶液B中至恰好反应完全,消耗
溶液滴加到溶液B中至恰好反应完全,消耗 溶液
溶液 。
。反应原理:
 (未配平),请先配平步骤c中的离子方程式
(未配平),请先配平步骤c中的离子方程式
您最近一年使用:0次
名校
4 . Ⅰ.某兴趣小组的同学用 晶体配制
晶体配制 的
的 溶液
溶液 。请回答下列问题:
。请回答下列问题:
(1)应称取 晶体的质量:
晶体的质量:___________ 。
(2)根据下列操作对所配溶液的浓度产生的影响,完成下列问题:
① 晶体失去了部分结晶水
晶体失去了部分结晶水
②用“左码右物”的称量方法称量晶体(使用游码)
③碳酸钠晶体不纯,其中混有氯化钠
④容量瓶未经干燥使用
⑤定容时仰视刻度线观察液面
其中引起所配溶液浓度偏高的有___________ (填序号,下同),无影响的有___________ 。
(3)某同学改用固体 配制上述
配制上述 溶液的过程如图所示:
溶液的过程如图所示:

①你认为该同学的错误步骤有___________ (填序号)。
A.1处 B.2处 C.3处 D.4处
②该配制过程中两次用到玻璃棒,其作用分别是___________ 、___________ 。
Ⅱ.另一兴趣小组的同学开展了测定 和
和 的固体混合物中
的固体混合物中 质量分数的探究实验。他们设计了如图的实验方案:
质量分数的探究实验。他们设计了如图的实验方案:

(4)滴加 溶液应“过量”,否则可能会使测定的结果
溶液应“过量”,否则可能会使测定的结果___________ (填“偏大”或“偏小”),确定 溶液是否过量的方法是
溶液是否过量的方法是___________ 。
(5)该混合物中 的质量分数为
的质量分数为___________ (保留三位有效数字)。
 晶体配制
晶体配制 的
的 溶液
溶液 。请回答下列问题:
。请回答下列问题:(1)应称取
 晶体的质量:
晶体的质量:(2)根据下列操作对所配溶液的浓度产生的影响,完成下列问题:
①
 晶体失去了部分结晶水
晶体失去了部分结晶水②用“左码右物”的称量方法称量晶体(使用游码)
③碳酸钠晶体不纯,其中混有氯化钠
④容量瓶未经干燥使用
⑤定容时仰视刻度线观察液面
其中引起所配溶液浓度偏高的有
(3)某同学改用固体
 配制上述
配制上述 溶液的过程如图所示:
溶液的过程如图所示:
①你认为该同学的错误步骤有
A.1处 B.2处 C.3处 D.4处
②该配制过程中两次用到玻璃棒,其作用分别是
Ⅱ.另一兴趣小组的同学开展了测定
 和
和 的固体混合物中
的固体混合物中 质量分数的探究实验。他们设计了如图的实验方案:
质量分数的探究实验。他们设计了如图的实验方案:
(4)滴加
 溶液应“过量”,否则可能会使测定的结果
溶液应“过量”,否则可能会使测定的结果 溶液是否过量的方法是
溶液是否过量的方法是(5)该混合物中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 某溶液可能含 和
和 中的某几种。探究小组为了确定该溶液中离子的组成,取
中的某几种。探究小组为了确定该溶液中离子的组成,取 该溶液进行实验(溶液密度为
该溶液进行实验(溶液密度为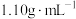 )。
)。
(1)填写下面实验报告中的空格:
(2)步骤三发生反应的离子方程式为___________ 。
(3)上述实验还不能确定是否存在的离子是___________ 。
 和
和 中的某几种。探究小组为了确定该溶液中离子的组成,取
中的某几种。探究小组为了确定该溶液中离子的组成,取 该溶液进行实验(溶液密度为
该溶液进行实验(溶液密度为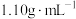 )。
)。(1)填写下面实验报告中的空格:
| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | 加入过量NaOH溶液,得到蓝色沉淀 | 原溶液中肯定有 ,肯定无 ,肯定无 | 肯定无该离子的理由是 |
| 步骤二 | 将蓝色沉淀过滤、洗涤、灼烧得到 黑色固体 黑色固体 | 原溶液中 的质量分数为 的质量分数为 |  元素守恒 元素守恒 |
| 步骤三 | 向步骤二的滤液中加足量稀硝酸和 溶液,得到白色沉淀,过滤 溶液,得到白色沉淀,过滤 | 原溶液中肯定有 | 肯定无 的理由是 的理由是 |
| 步骤四 | 向步骤三的滤液中加足量稀硝酸和 溶液,得到白色沉淀 溶液,得到白色沉淀 | 原溶液中肯定有 | 白色沉淀的化学式为 |
(3)上述实验还不能确定是否存在的离子是
您最近一年使用:0次
2024-01-21更新
|
79次组卷
|
2卷引用:甘肃省靖远县第一中学2023-2024学年高一上学期12月期末考试化学试题
6 . 有一包白色固体,可能含有 、
、 、KCl、
、KCl、 和无水
和无水 ,按下列步骤做实验:
,按下列步骤做实验:
①将该白色固体溶于水,得到无色溶液;
②向所得的无色溶液中加入足量 溶液,得到白色沉淀,再加稀硝酸,白色沉淀部分溶解并有气泡产生,将气体通入澄清石灰水中,石灰水变浑浊。
溶液,得到白色沉淀,再加稀硝酸,白色沉淀部分溶解并有气泡产生,将气体通入澄清石灰水中,石灰水变浑浊。
回答下列问题:
(1)该白色固体中一定存在的物质是___________ ,一定不存在的物质是___________ ,可能存在的物质是___________ 。
(2)称取该白色固体3.53 g,将其溶于水得到溶液A,在A中加入50 mL未知的 溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀硝酸,充分反应后剩余沉淀2.87g,同时放出0.224 L气体(标准状况)。
溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀硝酸,充分反应后剩余沉淀2.87g,同时放出0.224 L气体(标准状况)。
①该白色固体中 的质量分数为
的质量分数为___________ (保留2位有效数字,下同)。
② 溶液中溶质的物质的量浓度为
溶液中溶质的物质的量浓度为___________ 。
③该白色固体的成分是___________ 。
 、
、 、KCl、
、KCl、 和无水
和无水 ,按下列步骤做实验:
,按下列步骤做实验:①将该白色固体溶于水,得到无色溶液;
②向所得的无色溶液中加入足量
 溶液,得到白色沉淀,再加稀硝酸,白色沉淀部分溶解并有气泡产生,将气体通入澄清石灰水中,石灰水变浑浊。
溶液,得到白色沉淀,再加稀硝酸,白色沉淀部分溶解并有气泡产生,将气体通入澄清石灰水中,石灰水变浑浊。回答下列问题:
(1)该白色固体中一定存在的物质是
(2)称取该白色固体3.53 g,将其溶于水得到溶液A,在A中加入50 mL未知的
 溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀硝酸,充分反应后剩余沉淀2.87g,同时放出0.224 L气体(标准状况)。
溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀硝酸,充分反应后剩余沉淀2.87g,同时放出0.224 L气体(标准状况)。①该白色固体中
 的质量分数为
的质量分数为②
 溶液中溶质的物质的量浓度为
溶液中溶质的物质的量浓度为③该白色固体的成分是
您最近一年使用:0次
2023-11-03更新
|
192次组卷
|
3卷引用:甘肃省平凉市静宁县2023-2024学年高三上学期11月月考化学试题
甘肃省平凉市静宁县2023-2024学年高三上学期11月月考化学试题(已下线) 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末考试练习题山东省聊城市临清市第一中学2023-2024学年高一上学期期末模拟考试化学试题
名校
解题方法
7 . 碱式氯化铜有多种组成,可表示为Cua(OH)bClc•xH2O。
(1)碱式氯化铜制法之一;先制备CuCl2,再与石灰乳反应生成碱式氯化铜Cua(OH)bClc•xH2O。已知Cu与稀盐酸在持续通入空气和Fe3+催化下反应生成CuCl2,试写出此反应化学方程式________ ,反应类型为________ 。
(2)为测定某碱式氯化铜[Cua(OH)bClc•xH2O]的组成,进行下列实验:
称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;取25.00mL溶液A,加入足量AgNO3溶液,得AgCl(Mr为143.5)0.1722g;另取25.00mL溶液A,调节pH至4~5,用浓度为0.08000mol•L-1的EDTA(Na2H2Y•2H2O)标准溶液与Cu2+反应(离子方程式为Cu2++H2Y2-=CuY2-+2H+),消耗标准溶液30.00mL时恰好完全反应。
①溶液A中加入AgNO3溶液的目的是为了获得AgCl沉淀而测定Cl-的含量,简述实验中确认AgNO3溶液已加至足量的实验方法:__________ 。
②通过计算确定该样品的化学式(写出必要计算过程)_________ 。
(1)碱式氯化铜制法之一;先制备CuCl2,再与石灰乳反应生成碱式氯化铜Cua(OH)bClc•xH2O。已知Cu与稀盐酸在持续通入空气和Fe3+催化下反应生成CuCl2,试写出此反应化学方程式
(2)为测定某碱式氯化铜[Cua(OH)bClc•xH2O]的组成,进行下列实验:
称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;取25.00mL溶液A,加入足量AgNO3溶液,得AgCl(Mr为143.5)0.1722g;另取25.00mL溶液A,调节pH至4~5,用浓度为0.08000mol•L-1的EDTA(Na2H2Y•2H2O)标准溶液与Cu2+反应(离子方程式为Cu2++H2Y2-=CuY2-+2H+),消耗标准溶液30.00mL时恰好完全反应。
①溶液A中加入AgNO3溶液的目的是为了获得AgCl沉淀而测定Cl-的含量,简述实验中确认AgNO3溶液已加至足量的实验方法:
②通过计算确定该样品的化学式(写出必要计算过程)
您最近一年使用:0次
名校
8 . 有下列物质:①NH3 ②Na2CO3 ③NaOH ④稀盐酸 ⑤Al ⑥CuSO4·5H2O ⑦Fe(OH)3胶体 ⑧酒精
(1)以上物质中,属于混合物的是___________ (填序号,下同),属于电解质的是___________ 。
(2)Na2CO3既属于钠盐又属于碳酸盐,这种分类方法的名称是___________ 。
(3)某溶液中的溶质可能由下列离子组成:Na+、Cu2+、Ba2+、Fe3+、Cl-、SO 、CO
、CO ,某同学为检验其成分,进行了如下实验:
,某同学为检验其成分,进行了如下实验:
①向适量原溶液中加入过量的稀盐酸,有无色气体a和无色溶液b生成;
②向无色溶液b中加入过量的Ba(OH)2溶液,有白色沉淀c生成,过滤,得滤液d;
③取少量滤液d,加入过量的稀硝酸酸化,再滴加AgNO3溶液,有白色沉淀e生成。
依据以上实验可以推断,原溶液中一定含有大量的___________ (用离子符号表示,下同);可能含有___________ ,检验是否存在该离子还需进行的实验操作、现象和结论为______ 。
(4)实验室需用到0.6mol/L的稀盐酸240mL,现用质量分数为36.5%、密度为1.12g/cm3的浓盐酸来配制此浓度的稀盐酸,需要用量筒量取浓盐酸的体积为___________ mL,该配制过程中除需要量筒、烧杯、玻璃棒外,还需要使用的玻璃仪器有___________ 。
(5)将久置在空气中的铝片放在NaOH溶液中,一段时间后可观察到铝片表面产生无色气泡,写出在此过程中发生反应的离子方程式:______ 。
(1)以上物质中,属于混合物的是
(2)Na2CO3既属于钠盐又属于碳酸盐,这种分类方法的名称是
(3)某溶液中的溶质可能由下列离子组成:Na+、Cu2+、Ba2+、Fe3+、Cl-、SO
 、CO
、CO ,某同学为检验其成分,进行了如下实验:
,某同学为检验其成分,进行了如下实验:①向适量原溶液中加入过量的稀盐酸,有无色气体a和无色溶液b生成;
②向无色溶液b中加入过量的Ba(OH)2溶液,有白色沉淀c生成,过滤,得滤液d;
③取少量滤液d,加入过量的稀硝酸酸化,再滴加AgNO3溶液,有白色沉淀e生成。
依据以上实验可以推断,原溶液中一定含有大量的
(4)实验室需用到0.6mol/L的稀盐酸240mL,现用质量分数为36.5%、密度为1.12g/cm3的浓盐酸来配制此浓度的稀盐酸,需要用量筒量取浓盐酸的体积为
(5)将久置在空气中的铝片放在NaOH溶液中,一段时间后可观察到铝片表面产生无色气泡,写出在此过程中发生反应的离子方程式:
您最近一年使用:0次
9 . 无土栽培是一种在营养液中培育植物的高新技术,有良好的发展前景
Ⅰ.表为某“水培绿叶营养液”的成分
(1)上述各成分均属于_______(填字母)
(2) 该营养液中,
该营养液中, 的物质的量浓度为
的物质的量浓度为_______ 
(3)某兴趣小组用K2SO4固体配制250mL0.2mol/LK2SO4溶液用于性质实验
①该实验中要用到玻璃棒,其作用是_______
②在配制过程中,下列操作会使所配溶液浓度偏低的是_______ (填字母)
A.定容时,俯视刻度线 B.摇匀后液面低于刻度线,加水至刻度线
C.容量瓶中事先含有少量蒸馏水 D.未将烧杯的洗涤液转移至容量瓶中
Ⅱ.某水培营养液中可能含有 、
、 、
、 、
、 和
和 ,为确定其成分,进行如下实验:
,为确定其成分,进行如下实验:
①加入过量NaOH溶液,无明显现象;
②向①所得溶液中加足量BaCl2溶液,产生白色沉淀,再加入足量HNO3,白色沉淀部分溶解;
③过滤,向滤液中滴加足量AgNO3溶液,有白色沉淀生成.
(4)溶液中一定存在的离子有_______
(5)实验②中沉淀溶解发生反应的离子方程式为_______
(6)有同学认为实验③不能达到目的,原因是_______
Ⅰ.表为某“水培绿叶营养液”的成分
| 成分 | 含量/ mol/L |
| Ca(NO3)2 | 8×10-3 |
| K2SO4 | 2×10-3 |
| NH4H2PO4 | 3×10-3 |
| MgSO4 | 5×10-3 |
| A.酸 | B.盐 | C.氧化物 | D.电解质 |
 该营养液中,
该营养液中, 的物质的量浓度为
的物质的量浓度为
(3)某兴趣小组用K2SO4固体配制250mL0.2mol/LK2SO4溶液用于性质实验
①该实验中要用到玻璃棒,其作用是
②在配制过程中,下列操作会使所配溶液浓度偏低的是
A.定容时,俯视刻度线 B.摇匀后液面低于刻度线,加水至刻度线
C.容量瓶中事先含有少量蒸馏水 D.未将烧杯的洗涤液转移至容量瓶中
Ⅱ.某水培营养液中可能含有
 、
、 、
、 、
、 和
和 ,为确定其成分,进行如下实验:
,为确定其成分,进行如下实验:①加入过量NaOH溶液,无明显现象;
②向①所得溶液中加足量BaCl2溶液,产生白色沉淀,再加入足量HNO3,白色沉淀部分溶解;
③过滤,向滤液中滴加足量AgNO3溶液,有白色沉淀生成.
(4)溶液中一定存在的离子有
(5)实验②中沉淀溶解发生反应的离子方程式为
(6)有同学认为实验③不能达到目的,原因是
您最近一年使用:0次
2023-07-31更新
|
73次组卷
|
2卷引用:陕西省延安市延安新区2020-2021学年高一上学期期末考试化学试题
解题方法
10 . 现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如表所示:
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。A溶液与B溶液反应的离子方程式为______ 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为______ ,B溶于水后的电离方程式为______ 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E.B溶液与C溶液反应至中性的离子方程式为______ 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为______ 。
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO SO SO |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。A溶液与B溶液反应的离子方程式为
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E.B溶液与C溶液反应至中性的离子方程式为
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为
您最近一年使用:0次



