名校
解题方法
1 . 填写下列空白:
(1)工业上湿法制备高铁酸钾( )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、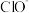 、
、 、
、 、
、 、
、 。写出并配平该反应的离子方程式
。写出并配平该反应的离子方程式___________ ;若反应过程中转移了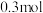 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为___________  。
。
(2)一定条件下,下列物质可以通过化合反应制得的有(写序号)___________ 。
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(3)向一定量的 的混合物中加入
的混合物中加入 的盐酸,恰好使混合物完全溶解,放出
的盐酸,恰好使混合物完全溶解,放出 (标准状况)的气体,在所得溶液中加入
(标准状况)的气体,在所得溶液中加入 溶液无血红色出现。若用足量的
溶液无血红色出现。若用足量的 在高温下还原相同质量的此混合物,能得到铁的质量是
在高温下还原相同质量的此混合物,能得到铁的质量是___________ g。
(4)将 铁粉与含有
铁粉与含有 的
的 溶液完全反应,铁粉全部溶解,并得到
溶液完全反应,铁粉全部溶解,并得到 铜,则参加反应的
铜,则参加反应的 与
与 的物质的量之比为
的物质的量之比为___________ 。
(5)等质量的铝分别与 浓度均为
浓度均为 的盐酸和氢氧化钠溶液反应,生成气体体积比为
的盐酸和氢氧化钠溶液反应,生成气体体积比为 ,铝与氢氧化钠溶液反应的离子方程式:
,铝与氢氧化钠溶液反应的离子方程式:___________ ;铝的质量为___________ g。
(6)将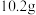 镁铝合金置于
镁铝合金置于 的盐酸中充分反应,无金属剩余,向反应后的溶液中加入
的盐酸中充分反应,无金属剩余,向反应后的溶液中加入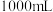 烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为
烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为___________  。
。
(1)工业上湿法制备高铁酸钾(
 )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、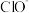 、
、 、
、 、
、 、
、 。写出并配平该反应的离子方程式
。写出并配平该反应的离子方程式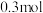 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为 。
。(2)一定条件下,下列物质可以通过化合反应制得的有(写序号)
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(3)向一定量的
 的混合物中加入
的混合物中加入 的盐酸,恰好使混合物完全溶解,放出
的盐酸,恰好使混合物完全溶解,放出 (标准状况)的气体,在所得溶液中加入
(标准状况)的气体,在所得溶液中加入 溶液无血红色出现。若用足量的
溶液无血红色出现。若用足量的 在高温下还原相同质量的此混合物,能得到铁的质量是
在高温下还原相同质量的此混合物,能得到铁的质量是(4)将
 铁粉与含有
铁粉与含有 的
的 溶液完全反应,铁粉全部溶解,并得到
溶液完全反应,铁粉全部溶解,并得到 铜,则参加反应的
铜,则参加反应的 与
与 的物质的量之比为
的物质的量之比为(5)等质量的铝分别与
 浓度均为
浓度均为 的盐酸和氢氧化钠溶液反应,生成气体体积比为
的盐酸和氢氧化钠溶液反应,生成气体体积比为 ,铝与氢氧化钠溶液反应的离子方程式:
,铝与氢氧化钠溶液反应的离子方程式:(6)将
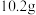 镁铝合金置于
镁铝合金置于 的盐酸中充分反应,无金属剩余,向反应后的溶液中加入
的盐酸中充分反应,无金属剩余,向反应后的溶液中加入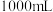 烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为
烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为 。
。
您最近一年使用:0次
11-12高三上·全国·单元测试
2 . 2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
___ MnO4-+ Fe2++ H+= Mn2++ Fe3++H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_____ mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为_________ g。
(4)混合物中Cu2S的质量分数为________________ 。
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为
(4)混合物中Cu2S的质量分数为
您最近一年使用:0次



