名校
解题方法
1 . 填写下列空白:
(1)工业上湿法制备高铁酸钾( )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 。写出并配平该反应的离子方程式
。写出并配平该反应的离子方程式___________ ;若反应过程中转移了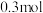 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为___________  。
。
(2)一定条件下,下列物质可以通过化合反应制得的有(写序号)___________ 。
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(3)向一定量的 的混合物中加入
的混合物中加入 的盐酸,恰好使混合物完全溶解,放出
的盐酸,恰好使混合物完全溶解,放出 (标准状况)的气体,在所得溶液中加入
(标准状况)的气体,在所得溶液中加入 溶液无血红色出现。若用足量的
溶液无血红色出现。若用足量的 在高温下还原相同质量的此混合物,能得到铁的质量是
在高温下还原相同质量的此混合物,能得到铁的质量是___________ g。
(4)将 铁粉与含有
铁粉与含有 的
的 溶液完全反应,铁粉全部溶解,并得到
溶液完全反应,铁粉全部溶解,并得到 铜,则参加反应的
铜,则参加反应的 与
与 的物质的量之比为
的物质的量之比为___________ 。
(5)等质量的铝分别与 浓度均为
浓度均为 的盐酸和氢氧化钠溶液反应,生成气体体积比为
的盐酸和氢氧化钠溶液反应,生成气体体积比为 ,铝与氢氧化钠溶液反应的离子方程式:
,铝与氢氧化钠溶液反应的离子方程式:___________ ;铝的质量为___________ g。
(6)将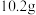 镁铝合金置于
镁铝合金置于 的盐酸中充分反应,无金属剩余,向反应后的溶液中加入
的盐酸中充分反应,无金属剩余,向反应后的溶液中加入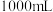 烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为
烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为___________  。
。
(1)工业上湿法制备高铁酸钾(
 )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 。写出并配平该反应的离子方程式
。写出并配平该反应的离子方程式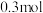 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为 。
。(2)一定条件下,下列物质可以通过化合反应制得的有(写序号)
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(3)向一定量的
 的混合物中加入
的混合物中加入 的盐酸,恰好使混合物完全溶解,放出
的盐酸,恰好使混合物完全溶解,放出 (标准状况)的气体,在所得溶液中加入
(标准状况)的气体,在所得溶液中加入 溶液无血红色出现。若用足量的
溶液无血红色出现。若用足量的 在高温下还原相同质量的此混合物,能得到铁的质量是
在高温下还原相同质量的此混合物,能得到铁的质量是(4)将
 铁粉与含有
铁粉与含有 的
的 溶液完全反应,铁粉全部溶解,并得到
溶液完全反应,铁粉全部溶解,并得到 铜,则参加反应的
铜,则参加反应的 与
与 的物质的量之比为
的物质的量之比为(5)等质量的铝分别与
 浓度均为
浓度均为 的盐酸和氢氧化钠溶液反应,生成气体体积比为
的盐酸和氢氧化钠溶液反应,生成气体体积比为 ,铝与氢氧化钠溶液反应的离子方程式:
,铝与氢氧化钠溶液反应的离子方程式:(6)将
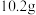 镁铝合金置于
镁铝合金置于 的盐酸中充分反应,无金属剩余,向反应后的溶液中加入
的盐酸中充分反应,无金属剩余,向反应后的溶液中加入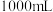 烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为
烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为 。
。
您最近一年使用:0次
2 . 饮用水中NO 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO 的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO
的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO 还原为N2。
还原为N2。
(1)①配平方程式:_______Al+____NO +_____OH↑+____=_____[Al(OH)4] ↑+____N2↑
+_____OH↑+____=_____[Al(OH)4] ↑+____N2↑
______
②上述反应中,还原剂与还原产物的物质的量之比是_______ ,反应中转移电子0.3mol,生成_______ mLN2(标准状况下)。
(2)①已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_______ 。
②Na2S2O3具有较强还原性,能作为织锦物漂白后的脱氯剂,脱氯后S2O 转变为SO
转变为SO 。现需处理含标准状况下2.24L Cl2的织锦物,理论上需要0.1mol/L Na2S2O3溶液的体积为
。现需处理含标准状况下2.24L Cl2的织锦物,理论上需要0.1mol/L Na2S2O3溶液的体积为_______ mL。
 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO 的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO
的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO 还原为N2。
还原为N2。(1)①配平方程式:_______Al+____NO
 +_____OH↑+____=_____[Al(OH)4] ↑+____N2↑
+_____OH↑+____=_____[Al(OH)4] ↑+____N2↑②上述反应中,还原剂与还原产物的物质的量之比是
(2)①已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
②Na2S2O3具有较强还原性,能作为织锦物漂白后的脱氯剂,脱氯后S2O
 转变为SO
转变为SO 。现需处理含标准状况下2.24L Cl2的织锦物,理论上需要0.1mol/L Na2S2O3溶液的体积为
。现需处理含标准状况下2.24L Cl2的织锦物,理论上需要0.1mol/L Na2S2O3溶液的体积为
您最近一年使用:0次
3 . 次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2 是一种一元中强酸,写出其电离方程式:_____ 。
(2)H3PO2 及 NaH2PO2 均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①利用 H3PO2 进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4︰1,则氧化产物为:____ (填化学式)
②NaH2PO2 是____ (填“正盐”或“酸式盐”),其溶液显_____ (填“弱酸性”、“中性”或者“弱碱性”),其溶液中离子浓度由大到小的顺序为_____
(3)H3PO2 的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成 PH3 气体和 Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式:_____ 。
(4)常温下将amol·L−1的醋酸与 b mol·L−1的Ba(OH)2溶液等体积混合,充分反应后溶液恰好呈中性,醋酸的电离常数Ka =______ (用含 a 和 b 的代数式表示)。
(1)H3PO2 是一种一元中强酸,写出其电离方程式:
(2)H3PO2 及 NaH2PO2 均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①利用 H3PO2 进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4︰1,则氧化产物为:
②NaH2PO2 是
(3)H3PO2 的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成 PH3 气体和 Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式:
(4)常温下将amol·L−1的醋酸与 b mol·L−1的Ba(OH)2溶液等体积混合,充分反应后溶液恰好呈中性,醋酸的电离常数Ka =
您最近一年使用:0次
11-12高三上·全国·单元测试
4 . 2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
___ MnO4-+ Fe2++ H+= Mn2++ Fe3++H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_____ mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为_________ g。
(4)混合物中Cu2S的质量分数为________________ 。
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为
(4)混合物中Cu2S的质量分数为
您最近一年使用:0次
11-12高三上·江西·阶段练习
5 . 钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物.
(1)钾和硝酸钾反应可制得氧化钾K+KNO3→K2O+N2(未配平),每生成9.4gK2O消耗的还原剂有___________ g
(2)超氧化钾和过氧化钾都能与二氧化碳反应均生成氧气和K2CO3,在医院、矿井、潜水、高空飞行中用作供氧剂.请尝试写出超氧化钾与二氧化碳反应的化学方程式____________ ,为了维持封闭环境气压稳定可以使用超氧化钾和过氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它们的物质的量之比为______
(3)KO2加热至600℃部分分解得到固态混合物 A.6.30g A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),如果产物A只含有两种化合物,写出所有可能组成的化学式组合,并计算A中两种化合物的物质的量之比._________________ 、________________________
(1)钾和硝酸钾反应可制得氧化钾K+KNO3→K2O+N2(未配平),每生成9.4gK2O消耗的还原剂有
(2)超氧化钾和过氧化钾都能与二氧化碳反应均生成氧气和K2CO3,在医院、矿井、潜水、高空飞行中用作供氧剂.请尝试写出超氧化钾与二氧化碳反应的化学方程式
(3)KO2加热至600℃部分分解得到固态混合物 A.6.30g A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),如果产物A只含有两种化合物,写出所有可能组成的化学式组合,并计算A中两种化合物的物质的量之比.
您最近一年使用:0次



