1 . 分类法是进行化学研究的重要方法。不同的标准可以把物质和反应分为不同的类别。回答下列问题:
(1)现有九种物质:①铜;②小苏打;③硫酸铁;④二氧化碳;⑤葡萄糖;⑥熔融氯化钠;⑦氢氧化铁胶体;⑧浓硫酸;⑨液氨;上述物质中,属于能导电的纯净物是___________ (填序号);属于非电解质的是___________ (填序号);③在水中的电离方程式为___________ 。
(2)下列物质属于如图所示化学概念交叉部分(阴影部分)的是___________ (填标号)。

A. B.HCl C.
B.HCl C. (乙醇) D.NaCl E.Hg
(乙醇) D.NaCl E.Hg
(3)氧化还原反应是一类重要化学反应,在生产生活中有重要应用。
①工业上,用 溶液“腐蚀”覆铜板制作印刷电路板,写出对应的离子方程式
溶液“腐蚀”覆铜板制作印刷电路板,写出对应的离子方程式___________ 。
②完善下面的化学方程式,并配平___________ 。

③利用盐酸酸化淀粉的KI溶液检验食盐中的碘元素( )。写出发生反应的离子方程式
)。写出发生反应的离子方程式___________ 。
(4)在20.00ml 溶液中加入0.195g锌粉,恰好完全反应,则还原产物可能是___________
溶液中加入0.195g锌粉,恰好完全反应,则还原产物可能是___________
(1)现有九种物质:①铜;②小苏打;③硫酸铁;④二氧化碳;⑤葡萄糖;⑥熔融氯化钠;⑦氢氧化铁胶体;⑧浓硫酸;⑨液氨;上述物质中,属于能导电的纯净物是
(2)下列物质属于如图所示化学概念交叉部分(阴影部分)的是

A.
 B.HCl C.
B.HCl C. (乙醇) D.NaCl E.Hg
(乙醇) D.NaCl E.Hg(3)氧化还原反应是一类重要化学反应,在生产生活中有重要应用。
①工业上,用
 溶液“腐蚀”覆铜板制作印刷电路板,写出对应的离子方程式
溶液“腐蚀”覆铜板制作印刷电路板,写出对应的离子方程式②完善下面的化学方程式,并配平

③利用盐酸酸化淀粉的KI溶液检验食盐中的碘元素(
 )。写出发生反应的离子方程式
)。写出发生反应的离子方程式(4)在20.00ml
 溶液中加入0.195g锌粉,恰好完全反应,则还原产物可能是___________
溶液中加入0.195g锌粉,恰好完全反应,则还原产物可能是___________A. | B.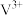 | C. | D.V |
您最近一年使用:0次
解题方法
2 . 硅酸盐材料具有硬度高、难溶于水、耐高温等特点。硅酸盐中常含有Al、K等元素,如钾长石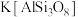 和钠长石
和钠长石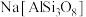 等。回答下列问题:
等。回答下列问题:
(1)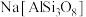 用氧化物形式表示为
用氧化物形式表示为_______ 。
(2)我国科学家发现在200℃熔盐体系中,采用金属Al还原钾长石等制备纳米硅材料的方法,将该材料应用于锂离子电池负极材料,展示出优异的电化学性能。配平下列方程式:_______ 。
______Al+______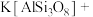 ______
______ →______Si+_____AlOCl+_____
→______Si+_____AlOCl+_____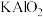 。
。
(3)将钾长石或钠长石用足量稀盐酸处理后,所得固体为_______ (填化学式)。
(4)将一定质量的铝粉和铁粉的混合物加入到一定量很稀的硝酸溶液中,充分反应,反应过程中无气体放出。向反应结束后的溶液中,逐滴加入5mol∙L-1的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量(n)关系如图所示:
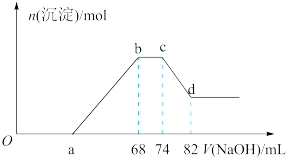
①根据关系图,写出Fe与稀硝酸反应的离子方程式:_______ 。
②样品中铝粉和铁粉的物质的量之比为_______ 。
③a点对应NaOH溶液的体积为_______ 。
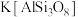 和钠长石
和钠长石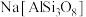 等。回答下列问题:
等。回答下列问题:(1)
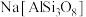 用氧化物形式表示为
用氧化物形式表示为(2)我国科学家发现在200℃熔盐体系中,采用金属Al还原钾长石等制备纳米硅材料的方法,将该材料应用于锂离子电池负极材料,展示出优异的电化学性能。配平下列方程式:
______Al+______
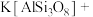 ______
______ →______Si+_____AlOCl+_____
→______Si+_____AlOCl+_____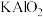 。
。(3)将钾长石或钠长石用足量稀盐酸处理后,所得固体为
(4)将一定质量的铝粉和铁粉的混合物加入到一定量很稀的硝酸溶液中,充分反应,反应过程中无气体放出。向反应结束后的溶液中,逐滴加入5mol∙L-1的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量(n)关系如图所示:

①根据关系图,写出Fe与稀硝酸反应的离子方程式:
②样品中铝粉和铁粉的物质的量之比为
③a点对应NaOH溶液的体积为
您最近一年使用:0次
名校
3 . 能基于物质的量认识物质的组成及其化学变化,是学生必备的学科素养。
(1)已知:①5.6LH2S(标准状况下)②1.204×1023个NH3分子③4.8gCH4④4℃时,5.4mL水,其中含有的氢原子数由大到小的顺序为__ 。
(2)同浓度的三种溶液:Na2SO4、MgSO4、Al2(SO4)3,其体积比为3:2:1,则SO 浓度之比为
浓度之比为__ 。
(3)在标准状况下,将VLHCl溶于0.1L水中,所得溶液的密度为dg·cm-3,则形成溶液的物质的量浓度为__ mol·L-1。
(4)某工厂废液中含有K2Cr2O7,排放废液前要将废液中的Cr2O 还原成Cr3+,取100mL此工厂的废液样品进行实验时,恰好消耗纯净NaHSO3固体3.12g。则此废液中含有K2Cr2O7的浓度为
还原成Cr3+,取100mL此工厂的废液样品进行实验时,恰好消耗纯净NaHSO3固体3.12g。则此废液中含有K2Cr2O7的浓度为__ mol·L-1。
(5)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。实验室中可用次氯酸钠溶液与氨气反应制备联氨(N2H4),反应的化学方程式为__ 。
(6)用零价铁(Fe)去除水体中的硝酸盐(NO )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。
实验研究表明,将足量铁粉投入 =2.5的水体中,经24小时测得水体中NO
=2.5的水体中,经24小时测得水体中NO 去除率为100%。已知:反应的铁元素以氧化物形式存在于溶液中,NO3-全部转化为NH
去除率为100%。已知:反应的铁元素以氧化物形式存在于溶液中,NO3-全部转化为NH ,反应0.1molNO
,反应0.1molNO 恰好消耗16.8gFe,则反应的离子方程式为
恰好消耗16.8gFe,则反应的离子方程式为__ 。
(1)已知:①5.6LH2S(标准状况下)②1.204×1023个NH3分子③4.8gCH4④4℃时,5.4mL水,其中含有的氢原子数由大到小的顺序为
(2)同浓度的三种溶液:Na2SO4、MgSO4、Al2(SO4)3,其体积比为3:2:1,则SO
 浓度之比为
浓度之比为(3)在标准状况下,将VLHCl溶于0.1L水中,所得溶液的密度为dg·cm-3,则形成溶液的物质的量浓度为
(4)某工厂废液中含有K2Cr2O7,排放废液前要将废液中的Cr2O
 还原成Cr3+,取100mL此工厂的废液样品进行实验时,恰好消耗纯净NaHSO3固体3.12g。则此废液中含有K2Cr2O7的浓度为
还原成Cr3+,取100mL此工厂的废液样品进行实验时,恰好消耗纯净NaHSO3固体3.12g。则此废液中含有K2Cr2O7的浓度为(5)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。实验室中可用次氯酸钠溶液与氨气反应制备联氨(N2H4),反应的化学方程式为
(6)用零价铁(Fe)去除水体中的硝酸盐(NO
 )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。实验研究表明,将足量铁粉投入
 =2.5的水体中,经24小时测得水体中NO
=2.5的水体中,经24小时测得水体中NO 去除率为100%。已知:反应的铁元素以氧化物形式存在于溶液中,NO3-全部转化为NH
去除率为100%。已知:反应的铁元素以氧化物形式存在于溶液中,NO3-全部转化为NH ,反应0.1molNO
,反应0.1molNO 恰好消耗16.8gFe,则反应的离子方程式为
恰好消耗16.8gFe,则反应的离子方程式为
您最近一年使用:0次
2020-10-24更新
|
225次组卷
|
4卷引用:河南省潢川第一中学2023-2024学年高三上学期第一次月考化学试题
河南省潢川第一中学2023-2024学年高三上学期第一次月考化学试题陕西省渭南市大荔县同州中学2021届高三上学期第一次月考化学试题(已下线)解密02 物质的量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密02 物质的量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
名校
解题方法
4 . 根据要求回答下列问题:
(1)氯气与氢氧化钠在70℃时反应,生成物中NaClO3和NaClO的物质的量之比为3:1的离子方程式_____________________________________________ 。
(2)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为____ 。
(3)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银
①H3PO2中,P元素的化合价为_______ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4 :1,则氧化产物为____ (填化学式)。
(4)取300mL 0.2mol/L 的KI溶液与一定量的酸性KMnO4 溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是__________ mol。
(5)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是_______________ ,又变为棕黄色的原因是_________ (用离子方程式解释)。
(1)氯气与氢氧化钠在70℃时反应,生成物中NaClO3和NaClO的物质的量之比为3:1的离子方程式
(2)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为
(3)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银
①H3PO2中,P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4 :1,则氧化产物为
(4)取300mL 0.2mol/L 的KI溶液与一定量的酸性KMnO4 溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是
(5)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是
您最近一年使用:0次
解题方法
5 . 配平下列方程并改写成离子方程式
(1)SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4___ ,___
(2)Cu+HNO3 → Cu(NO3)2+NO↑+H2O___ ,___
(1)SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
(2)Cu+HNO3 → Cu(NO3)2+NO↑+H2O
您最近一年使用:0次
10-11高三·河南信阳·阶段练习
解题方法
6 . 下表是某食用碘盐包装袋上的部分说明:
请回答下列问题:
(1)下列说法正确的是___________ 。
A.碘酸钾易挥发 B.高温会导致碘的损失
C.用淀粉就能直接检验碘盐中的碘酸钾 D.碘酸钾可氧化氯化钠
(2)碘酸钾与碘化钾在酸性条件下发生如下反应:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平),该化学方程式配平后系数依次为___________________ 。
w.该反应的还原剂为_____ ;1mol KIO3完全反应转移的电子总数为______ 。
(3)碘不能多也不能少。已知:I2+2S2O32-=2I-+S4O62-,我校化学兴趣小组测定某食用碘盐中碘的含量。其步骤为:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;③以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示)_________ mg/kg。
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
A.碘酸钾易挥发 B.高温会导致碘的损失
C.用淀粉就能直接检验碘盐中的碘酸钾 D.碘酸钾可氧化氯化钠
(2)碘酸钾与碘化钾在酸性条件下发生如下反应:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平),该化学方程式配平后系数依次为
w.该反应的还原剂为
(3)碘不能多也不能少。已知:I2+2S2O32-=2I-+S4O62-,我校化学兴趣小组测定某食用碘盐中碘的含量。其步骤为:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;③以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示)
您最近一年使用:0次
10-11高三·河南焦作·阶段练习
7 . 将KCl和CrCl3两种固体混合物共熔发生化合反应制得化合物X。将5.405gX中Cr元素全部氧化成Cr2O ,酸性的Cr2O
,酸性的Cr2O 可与过量的KI发生氧化还原反应氧化出7.62g I2,同时Cr2O
可与过量的KI发生氧化还原反应氧化出7.62g I2,同时Cr2O 被还原成Cr3+,如果取溶有X 5.405g的溶液,加入过量的AgNO3,可得12.915gAgCl沉淀。
被还原成Cr3+,如果取溶有X 5.405g的溶液,加入过量的AgNO3,可得12.915gAgCl沉淀。
(1)写出Cr2O 与I-反应的离子方程式
与I-反应的离子方程式__________________
(2)通过计算得出X的化学式__________________
 ,酸性的Cr2O
,酸性的Cr2O 可与过量的KI发生氧化还原反应氧化出7.62g I2,同时Cr2O
可与过量的KI发生氧化还原反应氧化出7.62g I2,同时Cr2O 被还原成Cr3+,如果取溶有X 5.405g的溶液,加入过量的AgNO3,可得12.915gAgCl沉淀。
被还原成Cr3+,如果取溶有X 5.405g的溶液,加入过量的AgNO3,可得12.915gAgCl沉淀。(1)写出Cr2O
 与I-反应的离子方程式
与I-反应的离子方程式(2)通过计算得出X的化学式
您最近一年使用:0次



