1 . 某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3(不溶于水)、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2→O2.
(1)写出该反应的化学方程式:_____ 。
(2)该反应中氧化剂是_____ ,氧化产物是_____ 。
(3)产生1个O2,转移的电子的个数为_____ 个。
(4)用单线桥标出该反应中电子转移情况:_____ 。
(1)写出该反应的化学方程式:
(2)该反应中氧化剂是
(3)产生1个O2,转移的电子的个数为
(4)用单线桥标出该反应中电子转移情况:
您最近一年使用:0次
名校
2 . 亚硫酸盐是一类很早即在世界范围内广泛使用的食品添加剂,可作为食品漂白剂,防腐剂;可抑制非酶褐变和酶促褐变,防止食品褐变,使水果不至黑变,还能防止鲜虾生成黑斑;在酸性介质中,还是十分有效的抗菌剂。
(1)亚硫酸钠中,阴离子的空间结构为___________ 。
(2)常温下, 溶液呈碱性,原因是
溶液呈碱性,原因是___________ (用离子方程式表示)。
(3)常温下,已知 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
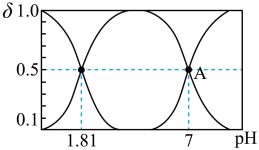
①A点溶液中离子浓度大小关系为___________ 。
②常温下, 溶液呈
溶液呈___________ 性。
(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是___________ (用离子方程式表示)。常温处理后,再调节 使
使 浓度不高于
浓度不高于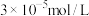 即可排放,调节
即可排放,调节 应不低于
应不低于___________ 。[已知Ksp[Cr(OH)3]=3×10-32]
(1)亚硫酸钠中,阴离子的空间结构为
(2)常温下,
 溶液呈碱性,原因是
溶液呈碱性,原因是(3)常温下,已知
 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
①A点溶液中离子浓度大小关系为
②常温下,
 溶液呈
溶液呈(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性
 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是 使
使 浓度不高于
浓度不高于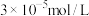 即可排放,调节
即可排放,调节 应不低于
应不低于
您最近一年使用:0次
名校
3 . 下表列出了五种燃煤烟气脱硫的方法。
(1)方法Ⅰ中吸收 后的溶液通过
后的溶液通过___________ (填字母)可使吸收液再生。
a.加热 b.加入适量NaOH c.通入
(2)方法Ⅱ中CO还原 反应的化学方程式为
反应的化学方程式为___________ 。
(3)方法Ⅲ在脱硫塔中进行,在脱硫的同时可得到产品硫酸。由于 对热不稳定,且硫酸浓度大也会导致其分解产生
对热不稳定,且硫酸浓度大也会导致其分解产生 ,需定时向脱硫塔中补充
,需定时向脱硫塔中补充___________ 以减少这种影响。
(4)方法Ⅳ按如图所示方式,将含有 烟气和NaClO碱性溶液通入反应釜。
烟气和NaClO碱性溶液通入反应釜。

①该反应中的离子方程式为___________ 。
②反应釜中采用“气-液逆流”接触吸收法的优点是___________ 。
(5)雌黄( )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。
 和
和 可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移
可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移 电子,则物质
电子,则物质 为
为___________ ,消耗氧气___________  。
。

| 方法Ⅰ | 用 溶液吸收 溶液吸收 |
| 方法Ⅱ | 用生物质热解气(主要成分为CO、 、 、 )将 )将 在高温下还原成S 在高温下还原成S |
| 方法Ⅲ | 用 溶液吸收 溶液吸收 |
| 方法Ⅳ | 用NaClO碱性溶液吸收 |
| 方法Ⅴ | 石灰-石膏法吸收 |
 后的溶液通过
后的溶液通过a.加热 b.加入适量NaOH c.通入

(2)方法Ⅱ中CO还原
 反应的化学方程式为
反应的化学方程式为(3)方法Ⅲ在脱硫塔中进行,在脱硫的同时可得到产品硫酸。由于
 对热不稳定,且硫酸浓度大也会导致其分解产生
对热不稳定,且硫酸浓度大也会导致其分解产生 ,需定时向脱硫塔中补充
,需定时向脱硫塔中补充(4)方法Ⅳ按如图所示方式,将含有
 烟气和NaClO碱性溶液通入反应釜。
烟气和NaClO碱性溶液通入反应釜。
①该反应中的离子方程式为
②反应釜中采用“气-液逆流”接触吸收法的优点是
(5)雌黄(
 )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。 和
和 可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移
可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移 电子,则物质
电子,则物质 为
为 。
。
您最近一年使用:0次
名校
解题方法
4 . 氮的化合物研究是环境科学的热点课题之一。
金属与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系下图所示:
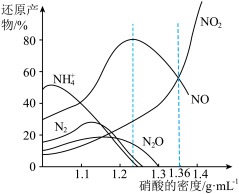
(1)当硝酸溶液的密度为1.36g.cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号)________________ 。
A.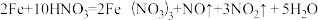
B.
C.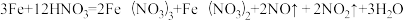
(2)现有一定量铝粉和铜粉的混合物与一定量很稀的硝酸溶液充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5mo/L的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如下图所示:
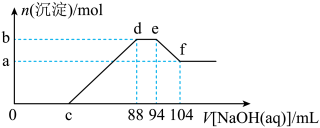
①c点对应NaOH溶液的体积为________________ mL;
②ef段发生反应的离子方程式为________________ 。
(3)研究表明硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的HNO2再氧化成HNO3,如图为金属在不同浓度的HNO3-H2O2混合溶液中的溶解速率和生成NOx的体积V的变化示意图:

①最佳溶解金属的混合溶液中HNO3的质量分数________________ 。
②H2O2与HNO2反应的化学方程式为________________ 。
(4)NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NOx的储存和还原在不同时段交替进行,如图1所示:若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。

①根据图1分析可以得出BaO的作用是________________ 。
②根据图2分析用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,第一步反应的化学方程为________________ 。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有O2条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。请写出该反应的化学方程式________________ 。
金属与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系下图所示:

(1)当硝酸溶液的密度为1.36g.cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号)
A.
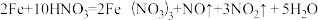
B.

C.
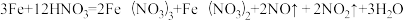
(2)现有一定量铝粉和铜粉的混合物与一定量很稀的硝酸溶液充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5mo/L的NaOH溶液,所加NaOH溶液的体积与产生沉淀的物质的量关系如下图所示:

①c点对应NaOH溶液的体积为
②ef段发生反应的离子方程式为
(3)研究表明硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的HNO2再氧化成HNO3,如图为金属在不同浓度的HNO3-H2O2混合溶液中的溶解速率和生成NOx的体积V的变化示意图:

①最佳溶解金属的混合溶液中HNO3的质量分数
②H2O2与HNO2反应的化学方程式为
(4)NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NOx的储存和还原在不同时段交替进行,如图1所示:若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。

①根据图1分析可以得出BaO的作用是
②根据图2分析用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,第一步反应的化学方程为
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有O2条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。请写出该反应的化学方程式
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.钠的化合物广泛应用于工业生产。
(1) 能与水剧烈反应,反应方程式为
能与水剧烈反应,反应方程式为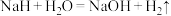 ,
, 与液氨也有类似的反应,写出反应的化学方程式
与液氨也有类似的反应,写出反应的化学方程式___________ 。
(2)在高温下氢化钠( )可将四氯化钛(
)可将四氯化钛( )还原成金属钛,写出该反应的化学方程式
)还原成金属钛,写出该反应的化学方程式___________ 。
(3)硼氢化钠( )与
)与 反应生成
反应生成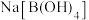 和
和 (已知反应过程中
(已知反应过程中 的化合价不变)。写出该反应的化学方程式
的化合价不变)。写出该反应的化学方程式___________ 。
(4)现有由两种含钠化合物组成的混合物,溶于水后,逐滴加入某浓度盐酸,所得 的粒子数目与所耗
的粒子数目与所耗 的粒子数目关系如图,两种含钠化合物的化学式和粒子数目之比为
的粒子数目关系如图,两种含钠化合物的化学式和粒子数目之比为___________ 、___________ 。

(1)
 能与水剧烈反应,反应方程式为
能与水剧烈反应,反应方程式为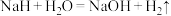 ,
, 与液氨也有类似的反应,写出反应的化学方程式
与液氨也有类似的反应,写出反应的化学方程式(2)在高温下氢化钠(
 )可将四氯化钛(
)可将四氯化钛( )还原成金属钛,写出该反应的化学方程式
)还原成金属钛,写出该反应的化学方程式(3)硼氢化钠(
 )与
)与 反应生成
反应生成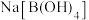 和
和 (已知反应过程中
(已知反应过程中 的化合价不变)。写出该反应的化学方程式
的化合价不变)。写出该反应的化学方程式(4)现有由两种含钠化合物组成的混合物,溶于水后,逐滴加入某浓度盐酸,所得
 的粒子数目与所耗
的粒子数目与所耗 的粒子数目关系如图,两种含钠化合物的化学式和粒子数目之比为
的粒子数目关系如图,两种含钠化合物的化学式和粒子数目之比为
您最近一年使用:0次
解题方法
6 . 将氟气通入氢氧化钠溶液中,可得OF2.OF2是一种无色、几乎无味的剧毒气体,主要用于氧化氟化反应、火箭工程助燃剂等。请回答下列问题:
(1)OF2中O的化合价为_______ ,OF2中O原子的杂化轨道类型是_______ ,OF2分子的空间构型为_______ 。
(2)与H2O分子相比,OF2分子的键角更_______ (填“大”或“小”)。
(3)与H2O分子相比,OF2分子的极性更_______ (填“大” 或“小”),原因是_______ ;
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)_______ 。
(1)OF2中O的化合价为
(2)与H2O分子相比,OF2分子的键角更
(3)与H2O分子相比,OF2分子的极性更
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)
您最近一年使用:0次
2023-11-22更新
|
350次组卷
|
2卷引用:江西省赣州市厚德外国语学校2023-2024学年高三上学期11月月考化学试卷
名校
7 . Ⅰ. 可用作清洁剂、防腐剂等。请按要求回答下列问题:
可用作清洁剂、防腐剂等。请按要求回答下列问题:
(1)下列关于 的说法正确的是______。
的说法正确的是______。
(2)将 溶液滴加到
溶液滴加到 溶液中至溶液呈中性时,发生反应的离子方程式为
溶液中至溶液呈中性时,发生反应的离子方程式为______ 。
Ⅱ.请按要求回答下列问题:
(3) 溶液与
溶液与 溶液反应的离子方程为
溶液反应的离子方程为______ 。
(4)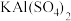 的电离方程式
的电离方程式______ 。
(5)工业上制取 用
用 与C、
与C、 在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是
在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是______ 。
(6)反应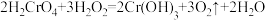 中
中 的变化
的变化
①该反应的氧化产物是______ (填化学式)。
②在该反应方程式中用单线桥法标明电子转移的方向和数目______ 。
 可用作清洁剂、防腐剂等。请按要求回答下列问题:
可用作清洁剂、防腐剂等。请按要求回答下列问题:(1)下列关于
 的说法正确的是______。
的说法正确的是______。A. 固体能导电 固体能导电 |
B. 溶液的导电性一定强于 溶液的导电性一定强于 溶液 溶液 |
C. 属于强电解质 属于强电解质 |
D. 溶液显酸性 溶液显酸性 |
 溶液滴加到
溶液滴加到 溶液中至溶液呈中性时,发生反应的离子方程式为
溶液中至溶液呈中性时,发生反应的离子方程式为Ⅱ.请按要求回答下列问题:
(3)
 溶液与
溶液与 溶液反应的离子方程为
溶液反应的离子方程为(4)
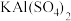 的电离方程式
的电离方程式(5)工业上制取
 用
用 与C、
与C、 在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是
在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是(6)反应
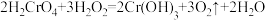 中
中 的变化
的变化
①该反应的氧化产物是
②在该反应方程式中用单线桥法标明电子转移的方向和数目
您最近一年使用:0次
名校
8 . 氮的化合物研究是环境科学的热点课题之一。
(1)锌与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系如图1所示,下列说法不正确的是_______ (填序号)。

A.一般来说,不同密度硝酸与锌反应的还原产物不是单一的
B.足量锌与一定量密度为1.36g/mL的硝酸反应,还原产物始终是NO和NO2
C.硝酸的密度越大,其还原产物中高价态的成分所占比例越多
(2)某容器中发生一个化学反应,已知反应物和生成物是由Fe2+、NO 、Fe3+、NH
、Fe3+、NH 、H+和H2O六种粒子组成的。在反应过程中测得Fe3+、NO
、H+和H2O六种粒子组成的。在反应过程中测得Fe3+、NO 的含量随时间变化的曲线如图2所示,该反应氧化剂为
的含量随时间变化的曲线如图2所示,该反应氧化剂为_______ (填写粒子符号),写出该反应的离子方程式_______ 。

(3)向空气中排放NO2会破坏臭氧层,同时NO2转化成N2O5并放出O2,还原产物是________ (填化学式),写出反应的化学方程式,并用单线桥法标出该反应电子转移的方向和数目_______ 。
(4)如图3是氮氧化物NOx的储存还原的工作原理:NOx的储存过程与还原过程在不同时刻是交替进行的。若还原过程中还原性气体为H2,则参加反应的H2与生成的N2的质量之比为_________ 。

(5)在铂原子表面H2还原NO的历程如图4所示。

在Pt-HY界面生成N2O的反应化学方程________ 。
(1)锌与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系如图1所示,下列说法不正确的是

A.一般来说,不同密度硝酸与锌反应的还原产物不是单一的
B.足量锌与一定量密度为1.36g/mL的硝酸反应,还原产物始终是NO和NO2
C.硝酸的密度越大,其还原产物中高价态的成分所占比例越多
(2)某容器中发生一个化学反应,已知反应物和生成物是由Fe2+、NO
 、Fe3+、NH
、Fe3+、NH 、H+和H2O六种粒子组成的。在反应过程中测得Fe3+、NO
、H+和H2O六种粒子组成的。在反应过程中测得Fe3+、NO 的含量随时间变化的曲线如图2所示,该反应氧化剂为
的含量随时间变化的曲线如图2所示,该反应氧化剂为
(3)向空气中排放NO2会破坏臭氧层,同时NO2转化成N2O5并放出O2,还原产物是
(4)如图3是氮氧化物NOx的储存还原的工作原理:NOx的储存过程与还原过程在不同时刻是交替进行的。若还原过程中还原性气体为H2,则参加反应的H2与生成的N2的质量之比为

(5)在铂原子表面H2还原NO的历程如图4所示。

在Pt-HY界面生成N2O的反应化学方程
您最近一年使用:0次
名校
解题方法
9 . 氧化还原反应在高中化学中是一类重要的反应类型。 、
、 、
、 、
、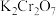 是中学化学中常用的氧化剂。回答下列问题:
是中学化学中常用的氧化剂。回答下列问题:
(1)下列基本反应类型中一定属于氧化还原反应的是___________(填字母)。
(2)实验室迅速制备少量氯气可利用如下反应:
 。上述反应中被氧化的元素为
。上述反应中被氧化的元素为___________ (填元素符号);还原产物为___________ (填化学式)。
(3) 溶液能与Cu反应制作印刷电路板,其制作原理可用
溶液能与Cu反应制作印刷电路板,其制作原理可用 表示。
表示。
①上式中X的化学式为___________ 。
②若有32g铜被氧化,则参与反应的 的质量为
的质量为___________ g。
③该反应的离子方程式为___________ 。
(4)已知方程式: 。用双线桥法标出电子转移的方向和数目
。用双线桥法标出电子转移的方向和数目___________ 。
(5)某反应的反应物与生成物有 、KCl、
、KCl、 、
、 、HCl(浓)、
、HCl(浓)、 ,已知氧化性:
,已知氧化性: ,写出并配平该化学方程式:
,写出并配平该化学方程式:___________ 。
 、
、 、
、 、
、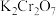 是中学化学中常用的氧化剂。回答下列问题:
是中学化学中常用的氧化剂。回答下列问题:(1)下列基本反应类型中一定属于氧化还原反应的是___________(填字母)。
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |

 。上述反应中被氧化的元素为
。上述反应中被氧化的元素为(3)
 溶液能与Cu反应制作印刷电路板,其制作原理可用
溶液能与Cu反应制作印刷电路板,其制作原理可用 表示。
表示。①上式中X的化学式为
②若有32g铜被氧化,则参与反应的
 的质量为
的质量为③该反应的离子方程式为
(4)已知方程式:
 。用双线桥法标出电子转移的方向和数目
。用双线桥法标出电子转移的方向和数目(5)某反应的反应物与生成物有
 、KCl、
、KCl、 、
、 、HCl(浓)、
、HCl(浓)、 ,已知氧化性:
,已知氧化性: ,写出并配平该化学方程式:
,写出并配平该化学方程式:
您最近一年使用:0次
2023-10-14更新
|
191次组卷
|
2卷引用:江西省名校联盟2023-2024学年高一上学期10月质量检测化学试题
10 . 高铁酸钾( 极易溶于水)是常见的水处理剂,其原理如图所示。
极易溶于水)是常见的水处理剂,其原理如图所示。
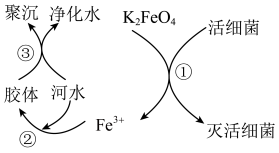
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。请回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为___________ 价。
(2)过程①中活细菌表现了___________ (填“氧化”或“还原”)性。
(3)净水利用了 胶体聚沉作用,请写出
胶体聚沉作用,请写出 胶体制备化学方程式
胶体制备化学方程式___________ 。
(4)根据上述原理分析,作水处理剂时, 的作用有
的作用有___________ 和净水剂。
(5)制备高铁酸钾常用的反应原理为 (反应未配平)。配平该反应的化学方程式
(反应未配平)。配平该反应的化学方程式___________ 。
(6)还可用干法制备高铁酸钠,主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是___________ 。(填化学式)
(7)已知铁与水蒸气发生如下反应: ,请用单线桥法表示电子转移的方向和数目:
,请用单线桥法表示电子转移的方向和数目:___________ 。
 极易溶于水)是常见的水处理剂,其原理如图所示。
极易溶于水)是常见的水处理剂,其原理如图所示。
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。请回答下列问题:
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)过程①中活细菌表现了
(3)净水利用了
 胶体聚沉作用,请写出
胶体聚沉作用,请写出 胶体制备化学方程式
胶体制备化学方程式(4)根据上述原理分析,作水处理剂时,
 的作用有
的作用有(5)制备高铁酸钾常用的反应原理为
 (反应未配平)。配平该反应的化学方程式
(反应未配平)。配平该反应的化学方程式(6)还可用干法制备高铁酸钠,主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(7)已知铁与水蒸气发生如下反应:
 ,请用单线桥法表示电子转移的方向和数目:
,请用单线桥法表示电子转移的方向和数目:
您最近一年使用:0次
2023-10-10更新
|
204次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高一上学期10月月考化学试题



