陕西省榆林市第十中学2023-2024学年高二下学期第一次质量检测化学试题
陕西
高二
阶段练习
2024-05-26
39次
整体难度:
容易
考查范围:
物质结构与性质、认识化学科学
陕西省榆林市第十中学2023-2024学年高二下学期第一次质量检测化学试题
陕西
高二
阶段练习
2024-05-26
39次
整体难度:
容易
考查范围:
物质结构与性质、认识化学科学
一、单选题 添加题型下试题
单选题
|
容易(0.94)
名校
解题方法
1. 下列分子中心原子的杂化方式不为 的是
的是
 的是
的是A. | B. | C. | D. |
您最近一年使用:0次
2023-12-26更新
|
543次组卷
|
10卷引用:青海省海南州高级中学、共和县高级中学2023-2024学年高二上学期期中联考化学试题
青海省海南州高级中学、共和县高级中学2023-2024学年高二上学期期中联考化学试题辽宁省朝阳市建平县实验中学2023-2024学年高二上学期期末化学试题(已下线)2.2.2 杂化轨道理论(基础)河北省沧州市十校2023-2024学年高二下学期3月月考化学试题黑龙江省绥化市绥棱县第一中学2023-2024学年高二下学期开学化学试题黑龙江省佳木斯市三校联考2023-2024学年高二下学期4月期中考试化学试题甘肃省武威市2023-2024学年高二下学期期中考试化学试卷陕西省榆林市第十中学2023-2024学年高二下学期第一次质量检测化学试题河南省商丘市二十校2023-2024学年高二下学期期中联考化学试卷黑龙江省齐齐哈尔市五校 黑河市四校2023-2024学年高二下学期4月期中联考化学试题
2. 下列说法中错误的是
| A.根据对角线规则,B和Si的性质具有相似性 |
| B.电负性越大的原子,对键合电子的吸引力越大 |
C.气体单质分子中,一定含有 键 键 |
| D.金属焰色试验的原理是电子跃迁释放能量 |
您最近一年使用:0次
2023-12-26更新
|
340次组卷
|
2卷引用:陕西师范大学附属中学2023-2024学年高二上学期期中考试化学试题
单选题
|
容易(0.94)
3. 若以E表示某能级的能量,下列能量大小顺序中正确的是
| A.E(3s)>E(2s)>E(1s) | B.E(3s)>E(3p)>E(3d) |
| C.E(4f)>E(4s)>E(4d) | D.E(5s)>E(4s)>E(5f) |
您最近一年使用:0次
2023-08-14更新
|
496次组卷
|
4卷引用:1.1原子结构模型(课前)-鲁科版选择性必修2
单选题
|
较易(0.85)
名校
4. 下列化学用语表述正确的是
A.中子数为20的Cl原子: |
B.BCl3的电子式: |
C.SO3分子的VSEPR模型: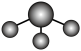 |
D.基态Cr原子的价层电子排布图: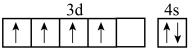 |
您最近一年使用:0次
2024-01-03更新
|
243次组卷
|
4卷引用:河北省石家庄市第四十三中学2023-2024学年高三上学期12月月考化学试题
单选题
|
较易(0.85)
名校
解题方法
5. 下列说法中,正确的是
| A.同一原子中,s电子的能量总是低于p电子的能量 |
| B.任何s轨道形状均是球形,只是能层不同,球的半径大小不同而已 |
| C.2p、3p、4p能级的轨道数依次增多 |
| D.原子核外电子排布,先排满K层再排L层,排满M层再排N层,满足能量最低原理 |
您最近一年使用:0次
2023-11-01更新
|
218次组卷
|
3卷引用:上海市育才中学2023-2024学年高三上学期10月第一次质量调研(等级考)化学试题
上海市育才中学2023-2024学年高三上学期10月第一次质量调研(等级考)化学试题(已下线)1.1.3 泡利原理、洪特规则、能量最低原理(巩固)陕西省榆林市第十中学2023-2024学年高二下学期第一次质量检测化学试题
单选题
|
适中(0.65)
名校
6. 前四周期主族元素X、Y、Z、W的原子序数依次增大。X与Z同主族,且基态X原子中p能级和s能级上的电子数相同。Y、Z同周期,Y位于第ⅢA族,W最外层有2个电子。下列说法正确的是
A.原子半径: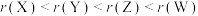 |
| B.最高价氧化物对应水化物的碱性:W<Y |
| C.Y的简单离子与Z的简单离子在溶液中不能大量共存 |
| D.基态W原子内层原子轨道均已充满电子 |
您最近一年使用:0次
2023-12-12更新
|
626次组卷
|
6卷引用:辽宁省沈阳市第二中学2023-2024学年高二上学期第二次月考化学试题
单选题
|
适中(0.65)
名校
7. 下列事实与氢键无关的是
A. 的沸点低于 的沸点低于 | B. 的熔点高于 的熔点高于 |
C. 的沸点高于 的沸点高于 | D. 比 比 更易溶于水 更易溶于水 |
【知识点】 含有氢键的物质解读 氢键对物质性质的影响解读
您最近一年使用:0次
2023-12-26更新
|
144次组卷
|
6卷引用:青海省海南州高级中学、共和县高级中学2023-2024学年高二上学期期中联考化学试题
单选题
|
适中(0.65)
解题方法
8. 下列说法中不正确的是
A. 分子中的σ键和π键的比为2∶1 分子中的σ键和π键的比为2∶1 |
B. 、 、 、 、 的空间结构都是三角锥 的空间结构都是三角锥 |
C. 、 、 都是由极性键构成的非极性分子 都是由极性键构成的非极性分子 |
D. 、 、 、 、 的中心原子都是 的中心原子都是 杂化 杂化 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
9. 人们对原子结构的认识为元素周期律找到了理论依据。下列关于原子结构的说法正确的是
| A.光是电子跃迁吸收能量的重要形式 |
B.基态 原子的电子排布式 原子的电子排布式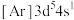 遵循构造原理 遵循构造原理 |
C.轨道表示式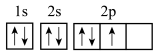 违背了洪特规则 违背了洪特规则 |
| D.某种基态原子中可能存在运动状态完全相同的电子 |
您最近一年使用:0次
2023-07-28更新
|
228次组卷
|
2卷引用:山西省运城市新绛县2022-2023学年高二下学期4月期中考试化学试题
单选题
|
适中(0.65)
名校
10. 下列元素或化合物的性质变化顺序不正确的是
| A.共价键的极性:HF>HCl>HBr>HI | B.元素的第一电离能:Cl>S>P>Si |
| C.卤素单质的熔点:I2>Br2>Cl2>F2 | D.碱性:CsOH>KOH>NaOH>LiOH |
【知识点】 同主族元素性质递变规律 电离能变化规律解读
您最近一年使用:0次
2023-12-28更新
|
157次组卷
|
2卷引用:北京市中国人民大学附属中学2021-2022学年高三下学期开学考试化学试卷
二、多选题 添加题型下试题
多选题
|
较易(0.85)
名校
解题方法
11. 能够用键能的大小解释的是
| A.氯化氢极易溶于水,甲烷不易溶于水 |
| B.氮气在常温下很稳定,化学性质不活泼 |
| C.硝酸是挥发性酸,硫酸是难挥发性酸 |
| D.金属钠的硬度小,可用小刀切割 |
【知识点】 分子的性质 键能、键长、键角及应用解读
您最近一年使用:0次
2023-05-07更新
|
72次组卷
|
3卷引用:甘肃省永昌县第一高级中学2022-2023学年高二下学期期中考试化学试题
三、单选题 添加题型下试题
单选题
|
容易(0.94)
名校
解题方法
12. 与NO 互为等电子体的是
互为等电子体的是
 互为等电子体的是
互为等电子体的是| A.SO2 | B.BF3 | C.CH4 | D.NO2 |
【知识点】 化学键与分子间作用力解读
您最近一年使用:0次
2021-03-09更新
|
296次组卷
|
7卷引用:云南省景谷一中2018-2019学年高二下学期期末考试化学试题
云南省景谷一中2018-2019学年高二下学期期末考试化学试题(已下线)第二单元 化学键与分子间作用力(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)宁夏青铜峡市高级中学2020-2021学年高二下学期期中考试化学试题新疆疏勒县实验学校2021-2022学年高二下学期期中考试化学试题四川省绵阳市南山中学实验学校2022-2023学年高二下学期3月月考化学试题黑龙江省鸡西市密山市第四中学2023-2024学年高二上学期11月月考化学试题陕西省榆林市第十中学2023-2024学年高二下学期第一次质量检测化学试题
四、多选题 添加题型下试题
多选题
|
适中(0.65)
13. 分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是
| A.SO2 | B. | C.H2S | D.CS2 |
您最近一年使用:0次
多选题
|
适中(0.65)
名校
解题方法
14. 锶(Sr)位于元素周期表的第5周期ⅡA族,关于锶及其化合物的叙述中,错误的是
| A.锶的金属性比镁强 | B.氢氢化锶呈两性 |
| C.锶在化合物中呈+2价 | D.锶在自然界中以游离态存在 |
【知识点】 同主族元素性质递变规律理解及应用解读
您最近一年使用:0次
2023-04-28更新
|
107次组卷
|
3卷引用:上海市第四中学2022-2023学年高一下学期4月期中考试化学试题
多选题
|
适中(0.65)
名校
解题方法
15. 已知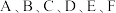 是原子序数依次增大的前四周期元素。其中
是原子序数依次增大的前四周期元素。其中 是宇宙中含量最多的元素;
是宇宙中含量最多的元素; 元素原子最高能级的不同轨道都有电子,并且自旋方向相同;
元素原子最高能级的不同轨道都有电子,并且自旋方向相同; 元素原子的价层电子排布式为
元素原子的价层电子排布式为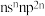 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子; 与
与 的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
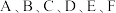 是原子序数依次增大的前四周期元素。其中
是原子序数依次增大的前四周期元素。其中 是宇宙中含量最多的元素;
是宇宙中含量最多的元素; 元素原子最高能级的不同轨道都有电子,并且自旋方向相同;
元素原子最高能级的不同轨道都有电子,并且自旋方向相同; 元素原子的价层电子排布式为
元素原子的价层电子排布式为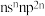 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子; 与
与 的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是
的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。下列说法正确的是A.A、B、C三种元素的电负性: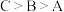 |
B.B、C、D、E四种元素的第一电离能: |
C.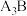 的稳定性大于 的稳定性大于 |
D. 的常见离子的核外电子排布图为 的常见离子的核外电子排布图为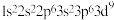 |
您最近一年使用:0次
2023-09-17更新
|
212次组卷
|
2卷引用:江西省九江市庐山市第一中学2022-2023学年高二上学期期末考试化学试题
五、解答题 添加题型下试题
解答题-结构与性质
|
适中(0.65)
解题方法
16. 金属元素及其化合物在生活生产中应用十分广泛。
(1)磷酸亚铁锂( )和锰酸锂(
)和锰酸锂( )均可用作锂离子电池正极材料。在元素周期表中,与Li化学性质最相似的邻族元素是
)均可用作锂离子电池正极材料。在元素周期表中,与Li化学性质最相似的邻族元素是______ (填元素符号),基态Fe原子的价电子排布式为______ 。
(2)原子核外电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为_______ 。
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如表:
锰元素位于第_______ 周期_______ 族_______ 区;比较两元素的 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,原因是
再失去1个电子难,原因是_______ 。
(4)铍由于重量轻、弹性模数高和热稳定性好,已成为引人注目的飞机和导弹结构材料。铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的是_______(填字母)。
(5)写出氧化铍和NaOH溶液反应生成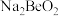 的离子方程式:
的离子方程式:_______ 。
(6)下列事实能说明氯与氧两元素非金属性相对强弱的有_______(填字母)。
(7)下列分子或离子:① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ 中,键角由大到小的排列顺序是
中,键角由大到小的排列顺序是_______ (用序号表示)。
(1)磷酸亚铁锂(
 )和锰酸锂(
)和锰酸锂( )均可用作锂离子电池正极材料。在元素周期表中,与Li化学性质最相似的邻族元素是
)均可用作锂离子电池正极材料。在元素周期表中,与Li化学性质最相似的邻族元素是(2)原子核外电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如表:
| 元素 | Mn | Fe | |
电离能 |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,原因是
再失去1个电子难,原因是(4)铍由于重量轻、弹性模数高和热稳定性好,已成为引人注目的飞机和导弹结构材料。铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的是_______(填字母)。
| A.都属于轻金属 | B.失电子的能力都比镁弱 |
| C.原子核外电子云形状都是2种 | D.氯化物的水溶液pH均小于7 |
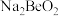 的离子方程式:
的离子方程式:(6)下列事实能说明氯与氧两元素非金属性相对强弱的有_______(填字母)。
| A.Cl原子最外层电子数比O多 | B.酸性: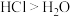 |
C. 中氯元素为+4价,氧元素为-2价 中氯元素为+4价,氧元素为-2价 | D.沸点: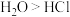 |
 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ 中,键角由大到小的排列顺序是
中,键角由大到小的排列顺序是
您最近一年使用:0次
六、填空题 添加题型下试题
填空题
|
较易(0.85)
名校
解题方法
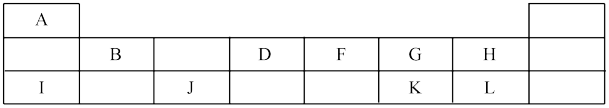
17. 下表为元素周期表中的短周期元素部分,A~L分别为短周期元素。_______ 。
(2)F、G、H三种元素的原子半径最大的是_______ (填元素名称);元素G、K形成的简单气态氢化物中,稳定性较强的是_______ (填氢化物化学式)。
(3)A~L元素中金属性最强元素的是_______ (填元素符号);请画出表中非金属性最强的元素的原子结构示意图_______ 。
(4)已知I、J的最高价氧化物的水化物能相互反应,其离子方程式为_______ 。
(5)原子序数比元素I大8的元素,其单质及化合物在灼烧时,透过蓝色的钴玻璃,火焰呈_______ 色。
(2)F、G、H三种元素的原子半径最大的是
(3)A~L元素中金属性最强元素的是
(4)已知I、J的最高价氧化物的水化物能相互反应,其离子方程式为
(5)原子序数比元素I大8的元素,其单质及化合物在灼烧时,透过蓝色的钴玻璃,火焰呈
【知识点】 “位构性”关系理解及应用解读
您最近一年使用:0次
2023-12-27更新
|
134次组卷
|
3卷引用:广东省云浮市罗定中学2023-2024学年高一上学期12月月考化学试题
填空题
|
适中(0.65)
解题方法
18. 完成下列问题。
(1)已知氯与硫均有多种含氧微粒,S有:SO2、 、SO3、
、SO3、 ;Cl有:HClO、
;Cl有:HClO、 、
、 、
、 ,其中立体构型为V形的微粒有
,其中立体构型为V形的微粒有_______ ;为三角锥形的有_______ ;为平面正三角形的有_______ ;为正四面体形的有_______ 。
(2)①SiH4、PH3、H2S分子中H-Si-H、H-P-H、H-S-H的键角大小顺序为:_______ 。
②SnBr2分子中Br—Sn—Br的键角_______ 120°;
③PCl3分子中,Cl—P—Cl的键角_______ 109.5°。
④俗称光气的氯代甲酰氯分子(COCl2)形状为:_______ ,其分子中有两种键角:124.3°、111.4°,其中Cl—C—Cl的键角为_______ 。
(1)已知氯与硫均有多种含氧微粒,S有:SO2、
 、SO3、
、SO3、 ;Cl有:HClO、
;Cl有:HClO、 、
、 、
、 ,其中立体构型为V形的微粒有
,其中立体构型为V形的微粒有(2)①SiH4、PH3、H2S分子中H-Si-H、H-P-H、H-S-H的键角大小顺序为:
②SnBr2分子中Br—Sn—Br的键角
③PCl3分子中,Cl—P—Cl的键角
④俗称光气的氯代甲酰氯分子(COCl2)形状为:
【知识点】 价层电子对互斥理论的应用解读
您最近一年使用:0次
2023-11-22更新
|
423次组卷
|
2卷引用:江西省赣州市厚德外国语学校2023-2024学年高三上学期11月月考化学试卷
填空题
|
适中(0.65)
名校
解题方法
19. 钇及其化合物在航天、电子、超导等方面有着广泛的应用,工业上以硅铍钇矿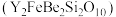 为原料生产氧化钇(
为原料生产氧化钇( )。
)。
(1)钇(Y)与钪同族,位于元素周期表中钪(Sc)的下一周期,基态钇(Y)原子的价电子排布图为______ ,与 元素同周期的基态原子中,未成对电子数与
元素同周期的基态原子中,未成对电子数与 原子相同的元素还有种
原子相同的元素还有种________ 。
(2)在元素周期表中, 和
和 处于第二周期和第三周期的对角线位置,化学性质相似。
处于第二周期和第三周期的对角线位置,化学性质相似。
①写出 的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:
的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:___________ 。
②已知 元素和
元素和 元素的电负性分别为1.5和4.0,则它们形成的化合物是
元素的电负性分别为1.5和4.0,则它们形成的化合物是_______ (填“离子化合物”或“共价化合物”)。
(3) 与
与 均为第二周期元素:
均为第二周期元素:
① 元素的原子核外共有
元素的原子核外共有____ 种不同空间运动状态的电子。
②电离能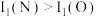 ,原因是
,原因是__________ 。
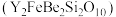 为原料生产氧化钇(
为原料生产氧化钇( )。
)。(1)钇(Y)与钪同族,位于元素周期表中钪(Sc)的下一周期,基态钇(Y)原子的价电子排布图为
 元素同周期的基态原子中,未成对电子数与
元素同周期的基态原子中,未成对电子数与 原子相同的元素还有种
原子相同的元素还有种(2)在元素周期表中,
 和
和 处于第二周期和第三周期的对角线位置,化学性质相似。
处于第二周期和第三周期的对角线位置,化学性质相似。①写出
 的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:
的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:②已知
 元素和
元素和 元素的电负性分别为1.5和4.0,则它们形成的化合物是
元素的电负性分别为1.5和4.0,则它们形成的化合物是(3)
 与
与 均为第二周期元素:
均为第二周期元素:①
 元素的原子核外共有
元素的原子核外共有②电离能
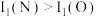 ,原因是
,原因是
您最近一年使用:0次
2024-01-06更新
|
370次组卷
|
3卷引用:吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高二上学期1月期末化学试题
填空题
|
较难(0.4)
解题方法
20. 将氟气通入氢氧化钠溶液中,可得OF2.OF2是一种无色、几乎无味的剧毒气体,主要用于氧化氟化反应、火箭工程助燃剂等。请回答下列问题:
(1)OF2中O的化合价为_______ ,OF2中O原子的杂化轨道类型是_______ ,OF2分子的空间构型为_______ 。
(2)与H2O分子相比,OF2分子的键角更_______ (填“大”或“小”)。
(3)与H2O分子相比,OF2分子的极性更_______ (填“大” 或“小”),原因是_______ ;
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)_______ 。
(1)OF2中O的化合价为
(2)与H2O分子相比,OF2分子的键角更
(3)与H2O分子相比,OF2分子的极性更
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)
您最近一年使用:0次
2023-11-22更新
|
350次组卷
|
2卷引用:江西省赣州市厚德外国语学校2023-2024学年高三上学期11月月考化学试卷
试卷分析
整体难度:适中
考查范围:物质结构与性质、认识化学科学
试卷题型(共 20题)
题型
数量
单选题
11
多选题
4
解答题
1
填空题
4
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 价层电子对互斥理论的应用 利用杂化轨道理论判断化学键杂化类型 | |
| 2 | 0.94 | 对角线规律 化学键概念理解及判断 光谱 电负性概念 | |
| 3 | 0.94 | 能级间能量大小比较 | |
| 4 | 0.85 | 共价化合物的结构及形成过程 原子中相关数值及其之间的相互关系 轨道表示式 利用杂化轨道理论判断分子的空间构型 | |
| 5 | 0.85 | 能级间能量大小比较 能量最低原理 | |
| 6 | 0.65 | 电子排布式 轨道表示式 | |
| 7 | 0.65 | 含有氢键的物质 氢键对物质性质的影响 | |
| 8 | 0.65 | 利用杂化轨道理论判断分子的空间构型 利用杂化轨道理论判断化学键杂化类型 极性分子和非极性分子 | |
| 9 | 0.65 | 能层与能级 洪特规则 电子排布式 轨道表示式 | |
| 10 | 0.65 | 同主族元素性质递变规律 电离能变化规律 | |
| 12 | 0.94 | 化学键与分子间作用力 | |
| 二、多选题 | |||
| 11 | 0.85 | 分子的性质 键能、键长、键角及应用 | |
| 13 | 0.65 | 共价键的形成及主要类型 价层电子对互斥理论 利用杂化轨道理论判断分子的空间构型 | |
| 14 | 0.65 | 同主族元素性质递变规律理解及应用 | |
| 15 | 0.65 | 根据原子结构进行元素种类推断 电子排布式 电离能变化规律 元素性质与电负性的关系 | |
| 三、解答题 | |||
| 16 | 0.65 | 元素金属性强弱的比较方法 电子排布式 电离能变化规律 利用杂化轨道理论判断分子的空间构型 | 结构与性质 |
| 四、填空题 | |||
| 17 | 0.85 | “位构性”关系理解及应用 | |
| 18 | 0.65 | 价层电子对互斥理论的应用 | |
| 19 | 0.65 | 对角线规律 轨道表示式 电离能变化规律 电负性概念 | |
| 20 | 0.4 | 氧化还原反应方程式的书写与配平 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 极性分子和非极性分子 | |



