1 . 化学与人类生活、生产密切相关。请根据题意填空:
(1)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维,用于制造光导纤维的基本原料是___________ (填“SiO2”或“Si”);
(2)“84”消毒液在新冠肺炎疫情防控中发挥了很大的作用,已知“84”消毒液的制备原理为Cl2+2NaOH=NaCl+NaClO+H2O,则“84”消毒液的有效成分为___________ (填“NaCl”或“NaClO”);
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质,请完成该反应的化学方程式:2CO+2NO 2CO2+
2CO2+___________ 。
(1)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维,用于制造光导纤维的基本原料是
(2)“84”消毒液在新冠肺炎疫情防控中发挥了很大的作用,已知“84”消毒液的制备原理为Cl2+2NaOH=NaCl+NaClO+H2O,则“84”消毒液的有效成分为
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质,请完成该反应的化学方程式:2CO+2NO
 2CO2+
2CO2+
您最近一年使用:0次
名校
解题方法
2 . 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。河南焦作的山药富含硒( ),有抗癌、抗衰老等重要功能。请回答下列问题。
),有抗癌、抗衰老等重要功能。请回答下列问题。
(1) 的原子结构示意图为
的原子结构示意图为______________ ,其在周期表中的位置为______________ 。
(2)氧、硫、硒位于同一主族,其性质具有一定的递变性。
①下列说法正确的是______________ (填标号)。
A.还原性: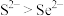
B.浓硒酸可能具有强氧化性、吸水性
C.稳定性: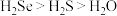
D.氧化性: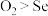
② 通入
通入 的水溶液中会生成不溶于水的
的水溶液中会生成不溶于水的 ,该反应的化学方程式为
,该反应的化学方程式为______________ ; 能与浓硫酸反应生成
能与浓硫酸反应生成 和
和 ,则浓硫酸、
,则浓硫酸、 和
和 三者中,氧化性最弱的为
三者中,氧化性最弱的为______________ 。
(3)某混合物中硒主要以 和
和 的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
ⅰ.将该混合物与浓硫酸混合焙烧,产生 、
、 的烟气
的烟气
ⅱ.用水吸收ⅰ中烟气,可得 固体
固体
已知: 的熔点为315℃,沸点为684.9℃。
的熔点为315℃,沸点为684.9℃。
①可用足量 溶液吸收烟气中的
溶液吸收烟气中的 ,二者反应生成一种盐,该盐的化学式为
,二者反应生成一种盐,该盐的化学式为__________ 。
② 中
中 的化合价为
的化合价为_________ 价;焙烧时, 与浓
与浓 反应的化学方程式为
反应的化学方程式为_________________ ,理论上该反应每转移1 电子,得到的
电子,得到的 的质量为
的质量为_________ g。
 ),有抗癌、抗衰老等重要功能。请回答下列问题。
),有抗癌、抗衰老等重要功能。请回答下列问题。(1)
 的原子结构示意图为
的原子结构示意图为(2)氧、硫、硒位于同一主族,其性质具有一定的递变性。
①下列说法正确的是
A.还原性:
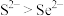
B.浓硒酸可能具有强氧化性、吸水性
C.稳定性:
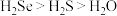
D.氧化性:
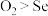
②
 通入
通入 的水溶液中会生成不溶于水的
的水溶液中会生成不溶于水的 ,该反应的化学方程式为
,该反应的化学方程式为 能与浓硫酸反应生成
能与浓硫酸反应生成 和
和 ,则浓硫酸、
,则浓硫酸、 和
和 三者中,氧化性最弱的为
三者中,氧化性最弱的为(3)某混合物中硒主要以
 和
和 的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:ⅰ.将该混合物与浓硫酸混合焙烧,产生
 、
、 的烟气
的烟气ⅱ.用水吸收ⅰ中烟气,可得
 固体
固体已知:
 的熔点为315℃,沸点为684.9℃。
的熔点为315℃,沸点为684.9℃。①可用足量
 溶液吸收烟气中的
溶液吸收烟气中的 ,二者反应生成一种盐,该盐的化学式为
,二者反应生成一种盐,该盐的化学式为②
 中
中 的化合价为
的化合价为 与浓
与浓 反应的化学方程式为
反应的化学方程式为 电子,得到的
电子,得到的 的质量为
的质量为
您最近一年使用:0次
2024-04-21更新
|
228次组卷
|
3卷引用:湖南省衡阳市衡阳县三校2023-2024学年高一下学期三月联考化学试题
名校
3 . 汽车尾气(含 、
、 、CO、
、CO、 、
、 等)是城市空气的污染源之一、
等)是城市空气的污染源之一、
(1)汽车尾气对环境的危害主要有温室效应、雾霾、_______ 等。
(2)在三元催化装置的作用下,汽车尾气可转化为无污染的物质。写出CO与 在此条件下反应的化学方程式:
在此条件下反应的化学方程式:_______ ,消耗14gCO时,转移电子的物质的量是_______ mol。
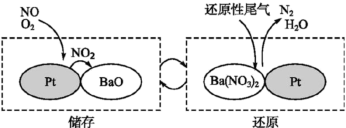
(3) 储存还原技术可有效降低柴油发动机在空气过量条件下
储存还原技术可有效降低柴油发动机在空气过量条件下 的排放。如图所示,
的排放。如图所示, 的储存和还原在不同时段交替进行,通过BaO和
的储存和还原在不同时段交替进行,通过BaO和 的相互转化实现
的相互转化实现 的储存和还原。储存
的储存和还原。储存 的物质是
的物质是_______ 。
(4) 也可以用于催化转化NOx,减少空气污染。请写出实验室用铵盐制备
也可以用于催化转化NOx,减少空气污染。请写出实验室用铵盐制备 的反应方程式
的反应方程式_______ 。
(5)若将 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有_______ (填离子符号)。
 、
、 、CO、
、CO、 、
、 等)是城市空气的污染源之一、
等)是城市空气的污染源之一、(1)汽车尾气对环境的危害主要有温室效应、雾霾、
(2)在三元催化装置的作用下,汽车尾气可转化为无污染的物质。写出CO与
 在此条件下反应的化学方程式:
在此条件下反应的化学方程式:(3)
 储存还原技术可有效降低柴油发动机在空气过量条件下
储存还原技术可有效降低柴油发动机在空气过量条件下 的排放。如图所示,
的排放。如图所示, 的储存和还原在不同时段交替进行,通过BaO和
的储存和还原在不同时段交替进行,通过BaO和 的相互转化实现
的相互转化实现 的储存和还原。储存
的储存和还原。储存 的物质是
的物质是
(4)
 也可以用于催化转化NOx,减少空气污染。请写出实验室用铵盐制备
也可以用于催化转化NOx,减少空气污染。请写出实验室用铵盐制备 的反应方程式
的反应方程式(5)若将
 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有
您最近一年使用:0次
名校
解题方法
4 . NOx是污染性气体,其性质的掌握及防污处理很重要。回答下列问题:
(1)写出NO2与水反应的离子方程式:___________ ,该反应中氧化剂与还原剂的质量比为____________ 。
(2)相同条件下,将10mL装满NO2与O2的试管倒扣在水槽中,充分反应。若试管中还剩余2mL无色气体,则原试管中NO2的体积可能为___________ mL(答出所有可能)。
(3)NaOH溶液可吸收硝酸工业尾气(含NO、NO2),并获得副产品。
已知: 、
、 。要使硝酸的工业尾气完全被吸收,
。要使硝酸的工业尾气完全被吸收, 的比值应满足
的比值应满足__________ 。
(4)尿素水溶液热解产生的NH3可去除汽车尾气中的NOx,流程如下:

①尿素[CO(NH2)2]中氮元素的化合价为_______________ 。
②写出“催化反应”过程中NH3还原NOx的化学方程式:__________ 。
③“催化反应”过程中需控制温度在250~380℃之间,温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和_____________________ 。
(1)写出NO2与水反应的离子方程式:
(2)相同条件下,将10mL装满NO2与O2的试管倒扣在水槽中,充分反应。若试管中还剩余2mL无色气体,则原试管中NO2的体积可能为
(3)NaOH溶液可吸收硝酸工业尾气(含NO、NO2),并获得副产品。
已知:
 、
、 。要使硝酸的工业尾气完全被吸收,
。要使硝酸的工业尾气完全被吸收, 的比值应满足
的比值应满足(4)尿素水溶液热解产生的NH3可去除汽车尾气中的NOx,流程如下:

①尿素[CO(NH2)2]中氮元素的化合价为
②写出“催化反应”过程中NH3还原NOx的化学方程式:
③“催化反应”过程中需控制温度在250~380℃之间,温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和
您最近一年使用:0次
名校
解题方法
5 . 控制、治理氮氧化物对大气的污染是改善大气质量的证要方面。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物( ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(2)在一密闭容器中发生反应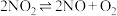 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
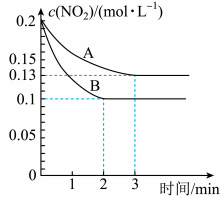
①依曲线A,反应在前3min内氧气的平均反应速率为___________ 。(保留三位有效数字)
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是___________ 。(填“浓度”、“压强”、“温度”或“催化剂”)
③曲线A、B分别对应的反应平衡常数的大小关系是
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(3)一定温度下,密闭容器中 可发生以下反应:
可发生以下反应:
 I
I
 Ⅱ
Ⅱ
那么反应I的平衡常数表达式为___________ 。假设达平衡时, ,
,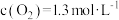 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为___________ , (g)的起始浓度不低于
(g)的起始浓度不低于___________  。
。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物(
 ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为(2)在一密闭容器中发生反应
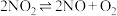 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是
③曲线A、B分别对应的反应平衡常数的大小关系是

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(3)一定温度下,密闭容器中
 可发生以下反应:
可发生以下反应: I
I Ⅱ
Ⅱ那么反应I的平衡常数表达式为
 ,
,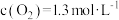 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为 (g)的起始浓度不低于
(g)的起始浓度不低于 。
。
您最近一年使用:0次
2024-04-05更新
|
69次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三下学期3月月考化学试题
解题方法
6 . 过氧化氢(H2O2,俗名为双氧水)、过氧化银(Ag2O2)广泛应用于抗菌消毒和化学能源等领域。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为_____ 。
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为_____ 。
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:_____ 。
(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为_____ ,Ag2O2中O的化合价为_____ 。
②写出上述反应的化学方程式:_____ 。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn
 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为
②写出上述反应的化学方程式:
您最近一年使用:0次
2024-03-23更新
|
52次组卷
|
2卷引用:湖南省衡阳市衡阳县第四中学2023-2024学年高一上学期10月月考化学试卷
名校
7 . 下表列出了五种燃煤烟气脱硫的方法。
(1)方法Ⅰ中吸收 后的溶液通过
后的溶液通过___________ (填字母)可使吸收液再生。
a.加热 b.加入适量NaOH c.通入
(2)方法Ⅱ中CO还原 反应的化学方程式为
反应的化学方程式为___________ 。
(3)方法Ⅲ在脱硫塔中进行,在脱硫的同时可得到产品硫酸。由于 对热不稳定,且硫酸浓度大也会导致其分解产生
对热不稳定,且硫酸浓度大也会导致其分解产生 ,需定时向脱硫塔中补充
,需定时向脱硫塔中补充___________ 。
(4)方法Ⅳ按如图所示方式,将含有 烟气和NaClO碱性溶液通入反应釜。
烟气和NaClO碱性溶液通入反应釜。___________ 。
②反应釜中采用“气-液逆流”接触吸收法的优点是___________ 。
(5)工业上方法Ⅴ的转化流程如下:___________ 。
②若用NaOH溶液代替 悬浊液,增加了生产成本,但可以防止
悬浊液,增加了生产成本,但可以防止___________ 。
| 方法Ⅰ | 用 溶液吸收 溶液吸收 |
| 方法Ⅱ | 用生物质热解气(主要成分为CO、 、 、 )将 )将 在高温下还原成S 在高温下还原成S |
| 方法Ⅲ | 用 溶液吸收 溶液吸收 |
| 方法Ⅳ | 用NaClO碱性溶液吸收 |
| 方法Ⅴ | 石灰-石膏法吸收 |
(1)方法Ⅰ中吸收
 后的溶液通过
后的溶液通过a.加热 b.加入适量NaOH c.通入

(2)方法Ⅱ中CO还原
 反应的化学方程式为
反应的化学方程式为(3)方法Ⅲ在脱硫塔中进行,在脱硫的同时可得到产品硫酸。由于
 对热不稳定,且硫酸浓度大也会导致其分解产生
对热不稳定,且硫酸浓度大也会导致其分解产生 ,需定时向脱硫塔中补充
,需定时向脱硫塔中补充(4)方法Ⅳ按如图所示方式,将含有
 烟气和NaClO碱性溶液通入反应釜。
烟气和NaClO碱性溶液通入反应釜。
②反应釜中采用“气-液逆流”接触吸收法的优点是
(5)工业上方法Ⅴ的转化流程如下:

②若用NaOH溶液代替
 悬浊液,增加了生产成本,但可以防止
悬浊液,增加了生产成本,但可以防止
您最近一年使用:0次
2024-01-24更新
|
314次组卷
|
2卷引用:湖南省常德市津市市第一中学2023-2024学年高一下学期4月份月考化学试卷
名校
解题方法
8 . 化学上用分类法学习化学物质的共性,用比较法学习化学物质的特性,物质的氧化性与还原性尤为重要。回答下列问题:
(1)磷元素的含氧酸有H3PO4、H3PO3(亚磷酸)、H3PO2(次磷酸)等多种,其中已知:H3PO3+2NaOH(过量)=Na2HPO3+2H2O。H3PO3属于___________ (填“一”“二”或“三”)元酸。Na2HPO3属于___________ (填“正盐”或“酸式盐”)。
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式。___________
______Fe(OH)3+______CH4+______H+ ______Fe2++______HCO
______Fe2++______HCO +_______。
+_______。
(3)强酸反应体系中发生的一个离子反应中,反应物和生成物共六种微粒:Fe2+、NO 、Fe3+、NH
、Fe3+、NH 、H+和H2O,写出该反应的离子方程式
、H+和H2O,写出该反应的离子方程式___________ 。
(4)NaBH4(B为+3价)常用作还原剂,H2也是常见的还原剂。与相同氧化剂反应时,1 mol NaBH4的还原能力相当于___________ mol H2的还原能力。ClO2是一种新型消毒剂,其消毒效率(单位质量得电子的能力)是Cl2的___________ 倍。(保留2位小数)
(1)磷元素的含氧酸有H3PO4、H3PO3(亚磷酸)、H3PO2(次磷酸)等多种,其中已知:H3PO3+2NaOH(过量)=Na2HPO3+2H2O。H3PO3属于
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式。
______Fe(OH)3+______CH4+______H+
 ______Fe2++______HCO
______Fe2++______HCO +_______。
+_______。(3)强酸反应体系中发生的一个离子反应中,反应物和生成物共六种微粒:Fe2+、NO
 、Fe3+、NH
、Fe3+、NH 、H+和H2O,写出该反应的离子方程式
、H+和H2O,写出该反应的离子方程式(4)NaBH4(B为+3价)常用作还原剂,H2也是常见的还原剂。与相同氧化剂反应时,1 mol NaBH4的还原能力相当于
您最近一年使用:0次
9 . 按要求填空。
(1)反应 在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。该反应中,
在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。该反应中,___________ (填分子式,下同)是氧化剂,___________ 是还原产物。
(2)适量服用维生素C有利于铁元素的吸收,原因是维生素C可以将 转变为
转变为 。这说明维生素C具有:
。这说明维生素C具有:___________ (填“氧化性”或“还原性”)。
(3)已知有 ,
,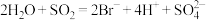 ,根据上述反应可判断
,根据上述反应可判断 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为___________ 。
(4)含氮废水不仅会引起水体富营养化而导致黑臭,而且对人群及其他生物产生毒害作用。现采用铝还原法来将 还原为
还原为 。请配平该化学反应方程式并在该反应方程式上用单线桥表示该反应中电子转移情况:
。请配平该化学反应方程式并在该反应方程式上用单线桥表示该反应中电子转移情况:________
___________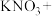 ___________Al+___________
___________Al+___________ ___________
___________ ___________
___________ ___________KOH
___________KOH
(5)元素G的一种含氧酸化学式为 ,属于二元酸,则
,属于二元酸,则 与过量氢氧化钠溶液反应生成的产物
与过量氢氧化钠溶液反应生成的产物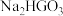 为
为___________ (填“酸式盐”或“正盐”)。
(1)反应
 在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。该反应中,
在化学上被称为“铝热反应”,人们可利用该反应来焊接铁轨。该反应中,(2)适量服用维生素C有利于铁元素的吸收,原因是维生素C可以将
 转变为
转变为 。这说明维生素C具有:
。这说明维生素C具有:(3)已知有
 ,
,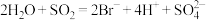 ,根据上述反应可判断
,根据上述反应可判断 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为(4)含氮废水不仅会引起水体富营养化而导致黑臭,而且对人群及其他生物产生毒害作用。现采用铝还原法来将
 还原为
还原为 。请配平该化学反应方程式并在该反应方程式上用单线桥表示该反应中电子转移情况:
。请配平该化学反应方程式并在该反应方程式上用单线桥表示该反应中电子转移情况:___________
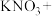 ___________Al+___________
___________Al+___________ ___________
___________ ___________
___________ ___________KOH
___________KOH(5)元素G的一种含氧酸化学式为
 ,属于二元酸,则
,属于二元酸,则 与过量氢氧化钠溶液反应生成的产物
与过量氢氧化钠溶液反应生成的产物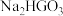 为
为
您最近一年使用:0次
名校
解题方法
10 . Ⅰ.氧化还原反应是一类重要的化学反应,广泛存在于生产和生活中。请结合相关化学知识回答下列问题:
(1)黑火药由硫黄、硝酸钾和木炭按一定比例混合而成,爆炸时的反应为S+2KNO3+3C K2S+N2↑+3CO2↑,反应中被还原的物质是
K2S+N2↑+3CO2↑,反应中被还原的物质是___________ (填化学式)。
(2)NaH可在野外作生氢剂,NaH+H2O=NaOH+H2↑,该反应中氧化产物和还原产物的质量比为___________ 。
(3)在汽车的排气管上装一个催化转化器,可有效降低氮氧化物的排放,其中一个反应为2CO+2NO N2+2CO2.用单线桥法表示出电子转移的方向和数目:
N2+2CO2.用单线桥法表示出电子转移的方向和数目:___________ 。
(4)工业废水中的 有毒,常在酸性条件下用Fe2+做处理剂,将
有毒,常在酸性条件下用Fe2+做处理剂,将 还原为Cr3+,Fe2+被氧化成Fe3+。反应的离子方程式为
还原为Cr3+,Fe2+被氧化成Fe3+。反应的离子方程式为___________ 。
II.配制200mL1.0mol/LH2SO4溶液。
(5)计算:现有500mL密度为1.84g/cm3,质量分数为98%的浓硫酸,若换算成物质的量浓度为___________ mol/L。若配制200mL1.0mol/L稀H2SO4溶液。需要取上述这种浓H2SO4溶液___________ mL来(计算结果精确到小数点后一位)。
(6)配制过程中的正确操作顺序是:b、d、___________ 、e(填“字母”)。
a.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b.用量筒量取所需体积的18mol/LH2SO4溶液注入盛有约50mL蒸馏水的烧杯。
c.用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d.用玻璃棒慢慢搅动,混合均匀。
e.盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f.将稀释后的H2SO4溶液沿玻璃棒注入250mL容量瓶。
g.往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(7)下列操作将导致所配制的H2SO4溶液浓度偏大的是___________ (填“字母”)。
a.移液过程有H2SO4溶液溅出瓶外 b.移液后未洗涤烧杯和玻璃棒
c.定容时俯视容量瓶刻度线 d.加水超过刻度线,用胶头滴管吸出多余液体
(1)黑火药由硫黄、硝酸钾和木炭按一定比例混合而成,爆炸时的反应为S+2KNO3+3C
 K2S+N2↑+3CO2↑,反应中被还原的物质是
K2S+N2↑+3CO2↑,反应中被还原的物质是(2)NaH可在野外作生氢剂,NaH+H2O=NaOH+H2↑,该反应中氧化产物和还原产物的质量比为
(3)在汽车的排气管上装一个催化转化器,可有效降低氮氧化物的排放,其中一个反应为2CO+2NO
 N2+2CO2.用单线桥法表示出电子转移的方向和数目:
N2+2CO2.用单线桥法表示出电子转移的方向和数目:(4)工业废水中的
 有毒,常在酸性条件下用Fe2+做处理剂,将
有毒,常在酸性条件下用Fe2+做处理剂,将 还原为Cr3+,Fe2+被氧化成Fe3+。反应的离子方程式为
还原为Cr3+,Fe2+被氧化成Fe3+。反应的离子方程式为II.配制200mL1.0mol/LH2SO4溶液。
(5)计算:现有500mL密度为1.84g/cm3,质量分数为98%的浓硫酸,若换算成物质的量浓度为
(6)配制过程中的正确操作顺序是:b、d、
a.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b.用量筒量取所需体积的18mol/LH2SO4溶液注入盛有约50mL蒸馏水的烧杯。
c.用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d.用玻璃棒慢慢搅动,混合均匀。
e.盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f.将稀释后的H2SO4溶液沿玻璃棒注入250mL容量瓶。
g.往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(7)下列操作将导致所配制的H2SO4溶液浓度偏大的是
a.移液过程有H2SO4溶液溅出瓶外 b.移液后未洗涤烧杯和玻璃棒
c.定容时俯视容量瓶刻度线 d.加水超过刻度线,用胶头滴管吸出多余液体
您最近一年使用:0次
2023-12-30更新
|
99次组卷
|
2卷引用: 湖南省怀化市第一中学2023-2024学年高一上学期12月月考化学试题



