1 . 危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3=4N2↑+2HNO3+9H2O,则被氧化和被还原的氮元素质量之比为_____________ ;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂,1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________ mol;
(3)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:__________________ 。处理CN一还常用的一种方法是:用ClO一氧化处理生成CNO一,反应的离子方程式如下;aCN-+bClO-+ 2cOH一=dCNO-+eN2↑+fCO32-+bCl-+cH2O;上述化学方程式可能的配平化学计量数有多组,回答下列问题:
①方程式中e:f的值为_________ (填字母);
A.1 B.1/2 C.2 D.不能确定
②若d=e=l,则b=_________ 。
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3=4N2↑+2HNO3+9H2O,则被氧化和被还原的氮元素质量之比为
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂,1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为
(3)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:
①方程式中e:f的值为
A.1 B.1/2 C.2 D.不能确定
②若d=e=l,则b=
您最近一年使用:0次
2017-04-05更新
|
885次组卷
|
3卷引用:湖南省长沙市第一中学2018届高三上学期无机化合物综合练习(一)化学试题
湖南省长沙市第一中学2018届高三上学期无机化合物综合练习(一)化学试题2016-2017学年湖南省长沙市第一中学高一下学期第一次月考化学试卷(已下线)【南昌新东方】2019 南昌五中 高一下 第一次月考
名校
2 . 为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
(1)固体I中主要成分为__________ ,捕获剂所捕获的气体主要是_________ 。
(2)处理含NH4+废水时,发生反应的离子方程式为___________ 。
(3)若X为适量空气,严格控制空气用量的原因是____________ 。
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________________ 。增加压强,NO的转化率__________ (填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________ (填“增大”、“不变”或“减小”)。
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______________ 。
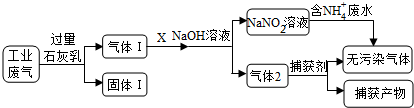
(1)固体I中主要成分为
(2)处理含NH4+废水时,发生反应的离子方程式为
(3)若X为适量空气,严格控制空气用量的原因是
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式
②随着吸收反应的进行,吸收剂溶液的pH逐渐
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是
您最近一年使用:0次
2017-03-19更新
|
483次组卷
|
2卷引用:湖南省长沙市第一中学2018届高三上学期晚自习测试(一)化学试题



