1 . 硫脲 在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备 ,然后
,然后 再与
再与 合成
合成 ,实验装置(夹持及加热装置略)如图所示。回答下列问题:
,实验装置(夹持及加热装置略)如图所示。回答下列问题: 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成 。
。
实验(一):制备硫脲。
(1)装置B中饱和NaHS溶液的作用是_______ 。
(2)检查装置气密性后加入药品,打开 ,通入一段时间
,通入一段时间 ,再打开
,再打开 ,当观察到
,当观察到_______ 时,再打开 。
。
(3)完成(2)中操作后,水浴加热装置D,在80℃条件下合成硫脲,控制温度在880℃的原因是_______ ;装置D中除生成硫脲外,还生成一种碱,写出该过程D中发生反应的化学方程式:_______ 。
实验(二):探究硫脲的性质。
(4)①取少量 溶于水,加热至150℃,一段时间后再冷却至室温,滴加
溶于水,加热至150℃,一段时间后再冷却至室温,滴加_______ ,可检验是否有 生成。
生成。
②取少量 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤,洗涤,得到黑色固体,由此推知,
溶液,过滤,洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成_______ (填离子符号)。
③取少量 溶液通过如图实验验证
溶液通过如图实验验证 被酸性
被酸性 溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性
溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性 溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有
溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有 生成,则石墨电极上的反应式为
生成,则石墨电极上的反应式为_______ 。
(5)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用cmol/L酸性 标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为_______ (用含m、c、V的代数式表示)。
 在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备 ,然后
,然后 再与
再与 合成
合成 ,实验装置(夹持及加热装置略)如图所示。回答下列问题:
,实验装置(夹持及加热装置略)如图所示。回答下列问题: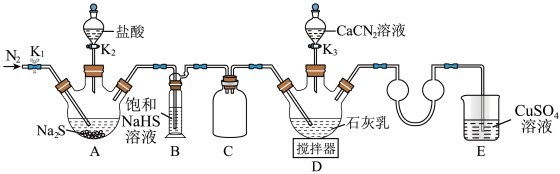
 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成 。
。实验(一):制备硫脲。
(1)装置B中饱和NaHS溶液的作用是
(2)检查装置气密性后加入药品,打开
 ,通入一段时间
,通入一段时间 ,再打开
,再打开 ,当观察到
,当观察到 。
。(3)完成(2)中操作后,水浴加热装置D,在80℃条件下合成硫脲,控制温度在880℃的原因是
实验(二):探究硫脲的性质。
(4)①取少量
 溶于水,加热至150℃,一段时间后再冷却至室温,滴加
溶于水,加热至150℃,一段时间后再冷却至室温,滴加 生成。
生成。②取少量
 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤,洗涤,得到黑色固体,由此推知,
溶液,过滤,洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成③取少量
 溶液通过如图实验验证
溶液通过如图实验验证 被酸性
被酸性 溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性
溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性 溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有
溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有 生成,则石墨电极上的反应式为
生成,则石墨电极上的反应式为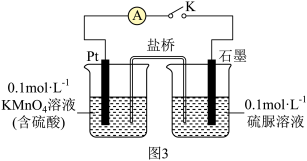
(5)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用cmol/L酸性
 标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
您最近一年使用:0次
2 . 唐朝初年,瘟疫频发,人们把它归因于一种叫“年”的怪兽。一位叫李田的人就把硝石、硫磺和木炭装在竹筒里,点燃后驱赶怪兽。后来人们靠此驱散了山林瘴气,战胜了疫情。中国古代四大发明之一的“黑火药”是由“一硫二硝三木炭”混合而成。
(1)写出“黑火药”爆炸的化学反应方程式_______ 。
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的SO2气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是_______ (用文字表述,任写一条合理途径)。
(3)古代曾用硝土[含有 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:

①“反应”过程中的离子反应方程式为_______ 。
②“过滤”操作必须用到的玻璃仪器有烧杯、玻璃棒和_______ ;
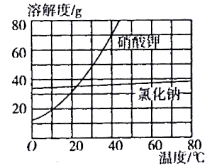
③如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液_______ 、过滤洗涤、干燥等步骤。
(4)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油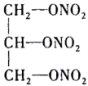 (
(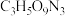 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为_______ ;
②实验室制备硝化甘油的化学方程式为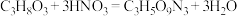 ,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
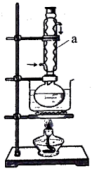
该装置中仪器a名称为_______ ,采用水浴加热而不用酒精灯直接加热的原因是_______ ,从反应后混合溶液中分离硝化甘油的简单方法是_______ 。
(1)写出“黑火药”爆炸的化学反应方程式
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的SO2气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是
(3)古代曾用硝土[含有
 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:
①“反应”过程中的离子反应方程式为
②“过滤”操作必须用到的玻璃仪器有烧杯、玻璃棒和
③如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液

(4)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油
 (
(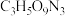 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为
②实验室制备硝化甘油的化学方程式为
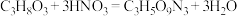 ,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
该装置中仪器a名称为
您最近一年使用:0次
3 . 化学是一门实用性很强的科学,请根据题意填空:
(1)铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以盛装_______ (填“浓硫酸”或“浓盐酸”)。
(2)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维。用于制造光导纤维的基本原料是_______ (填“SiO2”或“Na2SiO3”)。
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质。请完成一定条件该反应的化学方程式:2CO+2NO 2CO2 +
2CO2 +_______ 。
(1)铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以盛装
(2)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维。用于制造光导纤维的基本原料是
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质。请完成一定条件该反应的化学方程式:2CO+2NO
 2CO2 +
2CO2 +
您最近一年使用:0次
4 . 硫的化合物在化工生产等领域应用广泛。
(1)Na2S2可作制革工业中原皮的脱毛剂,其中硫元素的化合价是________ 。
(2)含硫煤燃烧会产生大气污染物,设计了如下图所示的工艺流程进行治污。写出图中过程I反应的离子方程式__________________ ,该工艺流程得到的化工产品是____________ (填化学式)。

(3)25℃时,实验测得NH4HSO3溶液中 =1 500,则该溶液的pH为
=1 500,则该溶液的pH为_____ (已知25℃时,H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(1)Na2S2可作制革工业中原皮的脱毛剂,其中硫元素的化合价是
(2)含硫煤燃烧会产生大气污染物,设计了如下图所示的工艺流程进行治污。写出图中过程I反应的离子方程式

(3)25℃时,实验测得NH4HSO3溶液中
 =1 500,则该溶液的pH为
=1 500,则该溶液的pH为
您最近一年使用:0次
名校
5 . 研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式:_____________ 。
(2)在海洋循环中,通过如图所示的途径固碳。

①写出钙化作用的离子方程式:_____________ 。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整:_____________+_____________=(CH2O)x+x18O2+xH2O,_____________
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如图所示),将虚线框中的装置补充完整并标出所用试剂。_____________

②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymLHCl溶液,海水中溶解无机碳的浓度=_____________ mol/L。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式:
(2)在海洋循环中,通过如图所示的途径固碳。

①写出钙化作用的离子方程式:
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整:_____________+_____________=(CH2O)x+x18O2+xH2O,
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如图所示),将虚线框中的装置补充完整并标出所用试剂。

②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymLHCl溶液,海水中溶解无机碳的浓度=
您最近一年使用:0次
2020-05-13更新
|
291次组卷
|
4卷引用:湖南省株洲市2020年高中毕业班教学质量监测卷理科综合化学试题
湖南省株洲市2020年高中毕业班教学质量监测卷理科综合化学试题河北省石家庄市第二中学2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分(已下线)第11讲 碳、硅及无机非金属材料(精练)-2022年高考化学一轮复习讲练测(已下线)第11讲 碳、硅及无机非金属材料(练)-2023年高考化学一轮复习讲练测(全国通用)
名校
6 . “钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。
(1)请写出金属钒与浓硝酸反应的离子方程式:__________________________________ ,
(2)灼烧NH4VO3时可生成钒的氧化物V2O5,请写出该反应的化学方程式:___________ 。
(3)V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:______________________________________ 。
(4)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:______ 、______ 。
(5)工业上用接触法制硫酸时要用到V2O5。在氧化SO2的过程中,450℃时发生V2O5与VO2之间的转化:V2O5+SO2=2VO2+SO3、4VO2+O2=2V2O5,说明V2O5在接触法制硫酸过程中所起的作用是_________ 。
(1)请写出金属钒与浓硝酸反应的离子方程式:
(2)灼烧NH4VO3时可生成钒的氧化物V2O5,请写出该反应的化学方程式:
(3)V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:
(4)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:
(5)工业上用接触法制硫酸时要用到V2O5。在氧化SO2的过程中,450℃时发生V2O5与VO2之间的转化:V2O5+SO2=2VO2+SO3、4VO2+O2=2V2O5,说明V2O5在接触法制硫酸过程中所起的作用是
您最近一年使用:0次
2018-01-18更新
|
983次组卷
|
7卷引用:湖南省株洲市2018届高三教学质量统一检测(一)化学试题
湖南省株洲市2018届高三教学质量统一检测(一)化学试题(已下线)2019年高考化学一轮复习讲练测 2.4 氧化还原反应的规律及应用 讲山西省运城市临猗中学2019届高三上学期第一次月考化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题11-2020年北京新高考化学模拟试题(已下线)第08讲 氧化还原反应的基本概念和规律(精练)——2021年高考化学一轮复习讲练测(已下线)第4单元 氧化还原反应(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)第01章 物质及其变化(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
7 . 过氧化氢(H2O2)为淡蓝色粘稠液体,是中学常见试剂。
(1)H2O2含有的共价键类型为___________________ 。
(2)H2O2能与水任意比混合,且纯净的H2O2具有较高的沸点,这可能与H2O2与水以及H2O2分子间能形成_________ 有关。
(3)实验室可用稀硫酸与BaO2反应来制取H2O2,该反应的化学方程式为:________________
(4)经测定H2O2为二元弱酸,酸性比碳酸还弱,不稳定易分解。已知Na2O2中通入干燥的CO2不反应,但通入潮湿的CO2却可以产O2,试用化学方程式表示这一过程:__________________ 。
(5)现有一份H2O2溶液,某学习小组想测定其浓度,查阅资料得知方法如下:用移液管吸取10.00mL的H2O2样品,置于l00mL)容量瓶中,加水稀释至刻度线,取25.00mL溶液置于锥形瓶再加入l0mL 3mol/L的稀硫酸(过量),用0.02mol/L的标准浓度的KMnO4溶液滴定,所用体积为20.00mL,则上述滴定过程发生的离子反应方程式为:___________ ,原H2O2溶液的浓度为____________ g/L。
(1)H2O2含有的共价键类型为
(2)H2O2能与水任意比混合,且纯净的H2O2具有较高的沸点,这可能与H2O2与水以及H2O2分子间能形成
(3)实验室可用稀硫酸与BaO2反应来制取H2O2,该反应的化学方程式为:
(4)经测定H2O2为二元弱酸,酸性比碳酸还弱,不稳定易分解。已知Na2O2中通入干燥的CO2不反应,但通入潮湿的CO2却可以产O2,试用化学方程式表示这一过程:
(5)现有一份H2O2溶液,某学习小组想测定其浓度,查阅资料得知方法如下:用移液管吸取10.00mL的H2O2样品,置于l00mL)容量瓶中,加水稀释至刻度线,取25.00mL溶液置于锥形瓶再加入l0mL 3mol/L的稀硫酸(过量),用0.02mol/L的标准浓度的KMnO4溶液滴定,所用体积为20.00mL,则上述滴定过程发生的离子反应方程式为:
您最近一年使用:0次
2016-12-09更新
|
224次组卷
|
2卷引用:2016届湖南省祁阳县高三下学期二模理综化学试卷
8 . “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:

(1)写出过程(a)的化学反应方程式:___________ .
(2)人们还可利用特定的细菌,用Fe2(SO4)3溶液作氧化剂溶解铜矿石(Cu2S),得到透明的酸性溶液,再向溶液中加入足量铁屑得到铜,请写出整个过程中的离子反应方程式:
①______________________
②______________________
③______________________
(3)下列不属于“细菌冶金”的优点的是______ (填写字母).
A、对贫矿、尾矿的开采更有价值
B、在细菌的作用下,副产物FeSO4和S可再次被空气氧化为Fe2(SO4)3和H2SO4,Fe2(SO4)3可循环使用
C、所用细菌来源广泛,很容易找到并大规模培养
D、能大大降低能源消耗,有利于减少污染
(4)工业上可利用粗铜(含Zn、Ag、Au等)经电解制得纯铜(电解铜).电解过程中,粗铜接电源_____ 极(填“正”或“负”),纯铜上的电极反应式为_______ .
(5)某工厂按上述(4)原理,平均每秒生产b mol纯铜,(设阿伏加德罗常数为N,每个电子带电量为e C)求电解槽中平均电流强度为_______ A(用代数式表示)

(1)写出过程(a)的化学反应方程式:
(2)人们还可利用特定的细菌,用Fe2(SO4)3溶液作氧化剂溶解铜矿石(Cu2S),得到透明的酸性溶液,再向溶液中加入足量铁屑得到铜,请写出整个过程中的离子反应方程式:
①
②
③
(3)下列不属于“细菌冶金”的优点的是
A、对贫矿、尾矿的开采更有价值
B、在细菌的作用下,副产物FeSO4和S可再次被空气氧化为Fe2(SO4)3和H2SO4,Fe2(SO4)3可循环使用
C、所用细菌来源广泛,很容易找到并大规模培养
D、能大大降低能源消耗,有利于减少污染
(4)工业上可利用粗铜(含Zn、Ag、Au等)经电解制得纯铜(电解铜).电解过程中,粗铜接电源
(5)某工厂按上述(4)原理,平均每秒生产b mol纯铜,(设阿伏加德罗常数为N,每个电子带电量为e C)求电解槽中平均电流强度为
您最近一年使用:0次
2010·湖南·一模
9 . (1)配平氧化还原反应方程式:___ C2O42-+____ MnO4-+___ H+=______ CO2+____ Mn2++___ H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___________ mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由________ 变为_______ 。该溶液中还原剂的物质的量为_________ mol。
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由
您最近一年使用:0次
10 . 磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g) ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
a、写出由磷酸钙矿制取白磷总的反应方程式_____________________________ 。
b、上述反应中SiO2起何作用?______________________________________ 。
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体________ (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在__________________ 之间 (已知磷酸的各级电离常数为:K1 = 7.1×10−3 K2 = 6.3×10−8 K3 =4.2×10−13 lg7.1≈0.9 lg6.3≈0.8 lg≈0.6) 。Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是__________________________________________ (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是___________ 。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g) ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
a、写出由磷酸钙矿制取白磷总的反应方程式
b、上述反应中SiO2起何作用?
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是
您最近一年使用:0次
2016-12-08更新
|
680次组卷
|
2卷引用:2015届湖南省长望浏宁四县高三一模考试化学试卷



