2024·江西赣州·二模
名校
解题方法
1 . 二氧化氯(ClO2)是一种高效、安全的杀菌消毒剂。一种综合法制备ClO2的工艺流程及ClO2分子的结构(O-Cl-O的键角为117.6°)如图所示。
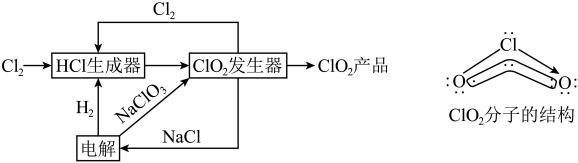
| A.Cl2与ClO2分子中所含化学键类型完全相同 |
B. ClO2分子中含有大π键(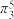 ),Cl原子杂化方式为sp2杂化 ),Cl原子杂化方式为sp2杂化 |
| C.“ClO2发生器”中,NaClO3的还原产物为Cl2 |
| D.“电解”时,阳极与阴极产物的物质的量之比为3:1 |
您最近一年使用:0次
2 . 铊(Tl)本身是一种剧毒物质,为毒性最大的金属元素之一,但是铊在工业中的用途非常广泛,主要存在于一些矿物和工业废水中,也可以从含铊的合金中提取.从某铅锌厂的富铊灰(主要成分为 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示:
①在氯化物-硫酸水溶液中,铊元素以 形式存在;
形式存在;
(2)萃取过程的反应原理为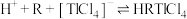 .
.
请回答下列问题:
(1)基态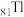 原子核外电子的运动状态有
原子核外电子的运动状态有________ 种.
(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有________________ (写出两条).
(3)写出“浸取I”中 发生反应的化学方程式:
发生反应的化学方程式:________________ ,“滤渣”的主要成分是________ (填化学式).
(4)请从化学平衡的角度解释“反萃取”过程中加入 溶液的原因:
溶液的原因:________________ .
(5)写出“还原氯化沉淀”中反应的离子方程式:________________ .
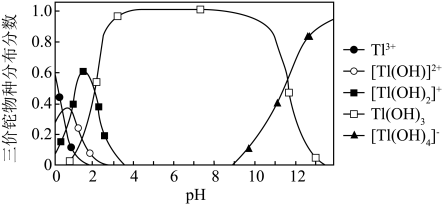
(6)通过沉淀法也可以去除工业废水中的 和
和 .
.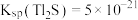 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中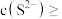
________  (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).
②向含铊废水中加入溴水,使 充分氧化成
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是________________ .
 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示: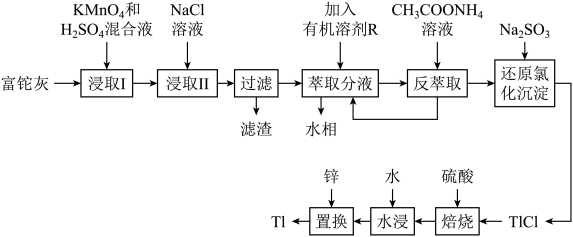
①在氯化物-硫酸水溶液中,铊元素以
 形式存在;
形式存在;(2)萃取过程的反应原理为
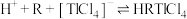 .
.请回答下列问题:
(1)基态
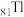 原子核外电子的运动状态有
原子核外电子的运动状态有(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有
(3)写出“浸取I”中
 发生反应的化学方程式:
发生反应的化学方程式:(4)请从化学平衡的角度解释“反萃取”过程中加入
 溶液的原因:
溶液的原因:(5)写出“还原氯化沉淀”中反应的离子方程式:
(6)通过沉淀法也可以去除工业废水中的
 和
和 .
.
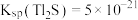 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中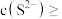
 (假设污水中铊全部以
(假设污水中铊全部以 形式存在).
形式存在).②向含铊废水中加入溴水,使
 充分氧化成
充分氧化成 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
您最近一年使用:0次
3 . 硫脲 在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备 ,然后
,然后 再与
再与 合成
合成 ,实验装置(夹持及加热装置略)如图所示。回答下列问题:
,实验装置(夹持及加热装置略)如图所示。回答下列问题: 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成 。
。
实验(一):制备硫脲。
(1)装置B中饱和NaHS溶液的作用是_______ 。
(2)检查装置气密性后加入药品,打开 ,通入一段时间
,通入一段时间 ,再打开
,再打开 ,当观察到
,当观察到_______ 时,再打开 。
。
(3)完成(2)中操作后,水浴加热装置D,在80℃条件下合成硫脲,控制温度在880℃的原因是_______ ;装置D中除生成硫脲外,还生成一种碱,写出该过程D中发生反应的化学方程式:_______ 。
实验(二):探究硫脲的性质。
(4)①取少量 溶于水,加热至150℃,一段时间后再冷却至室温,滴加
溶于水,加热至150℃,一段时间后再冷却至室温,滴加_______ ,可检验是否有 生成。
生成。
②取少量 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤,洗涤,得到黑色固体,由此推知,
溶液,过滤,洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成_______ (填离子符号)。
③取少量 溶液通过如图实验验证
溶液通过如图实验验证 被酸性
被酸性 溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性
溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性 溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有
溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有 生成,则石墨电极上的反应式为
生成,则石墨电极上的反应式为_______ 。
(5)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用cmol/L酸性 标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为_______ (用含m、c、V的代数式表示)。
 在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备 ,然后
,然后 再与
再与 合成
合成 ,实验装置(夹持及加热装置略)如图所示。回答下列问题:
,实验装置(夹持及加热装置略)如图所示。回答下列问题: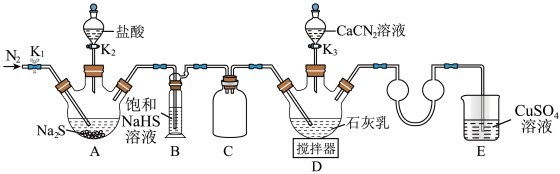
 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成 。
。实验(一):制备硫脲。
(1)装置B中饱和NaHS溶液的作用是
(2)检查装置气密性后加入药品,打开
 ,通入一段时间
,通入一段时间 ,再打开
,再打开 ,当观察到
,当观察到 。
。(3)完成(2)中操作后,水浴加热装置D,在80℃条件下合成硫脲,控制温度在880℃的原因是
实验(二):探究硫脲的性质。
(4)①取少量
 溶于水,加热至150℃,一段时间后再冷却至室温,滴加
溶于水,加热至150℃,一段时间后再冷却至室温,滴加 生成。
生成。②取少量
 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤,洗涤,得到黑色固体,由此推知,
溶液,过滤,洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成③取少量
 溶液通过如图实验验证
溶液通过如图实验验证 被酸性
被酸性 溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性
溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性 溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有
溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有 生成,则石墨电极上的反应式为
生成,则石墨电极上的反应式为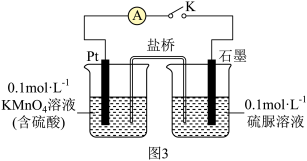
(5)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用cmol/L酸性
 标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
您最近一年使用:0次
4 . 部分含硫物质的“价-类”关系如图所示。下列叙述错误的是
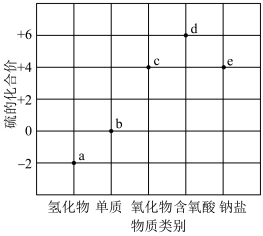
| A.一定条件下,能实现a→b→c→d的转化 |
| B.a和c反应中,氧化产物、还原产物的质量之比为2:1 |
| C.具有漂白性的c能使品红、石蕊溶液褪色 |
| D.利用b和e可以制备大苏打(Na2S2O3) |
您最近一年使用:0次
名校
5 . 铬的化合物应用广泛,工业上以铬铁矿(含Al、Si氧化物等杂质)为主要原料制备红矾钠( )的工艺流程如下图。已知:①
)的工艺流程如下图。已知:① 中Cr的化合价为+3;②焙烧的目的是将
中Cr的化合价为+3;②焙烧的目的是将 转化为
转化为 ,并将Al、Si氧化物转化为可溶性钠盐。
,并将Al、Si氧化物转化为可溶性钠盐。
(1)与基态铬原子的最外层电子数相同且同周期的元素有_________ 种。
(2)为了提高“焙烧”效果,可采取的一种措施是____________ 。
(3)“浸取”所得的滤渣为 由此推断
由此推断 “焙烧”时发生主要反应的化学方程式为
“焙烧”时发生主要反应的化学方程式为________ 。
(4)常温下,矿物中相关元素可溶性组分物质的量浓度的对数[ ]与pH的关系如图所示。当溶液中可溶性组分浓度
]与pH的关系如图所示。当溶液中可溶性组分浓度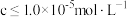 时,可认为已除尽。则“中和”时pH的理论范围为
时,可认为已除尽。则“中和”时pH的理论范围为________ ;“酸化”过程中的离子方程式为____________ 。 的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生
的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生 和
和 沉淀。
沉淀。
①若电解后溶液中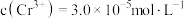 ,则
,则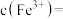
__________  {已知
{已知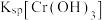
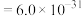 ,
,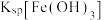 可从第(4)小题图中计算得出}。
可从第(4)小题图中计算得出}。
②电解法处理含 的酸性废水,下列有关原理的说法正确的是
的酸性废水,下列有关原理的说法正确的是_________ (填标号)。
A.阳极反应为
B.电解过程中溶液pH不会变化
C.如果石墨作阳极,电解过程不变
D.电路中每转移12mol电子,阳极有1mol 被还原
被还原
 )的工艺流程如下图。已知:①
)的工艺流程如下图。已知:① 中Cr的化合价为+3;②焙烧的目的是将
中Cr的化合价为+3;②焙烧的目的是将 转化为
转化为 ,并将Al、Si氧化物转化为可溶性钠盐。
,并将Al、Si氧化物转化为可溶性钠盐。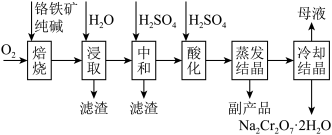
(1)与基态铬原子的最外层电子数相同且同周期的元素有
(2)为了提高“焙烧”效果,可采取的一种措施是
(3)“浸取”所得的滤渣为
 由此推断
由此推断 “焙烧”时发生主要反应的化学方程式为
“焙烧”时发生主要反应的化学方程式为(4)常温下,矿物中相关元素可溶性组分物质的量浓度的对数[
 ]与pH的关系如图所示。当溶液中可溶性组分浓度
]与pH的关系如图所示。当溶液中可溶性组分浓度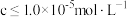 时,可认为已除尽。则“中和”时pH的理论范围为
时,可认为已除尽。则“中和”时pH的理论范围为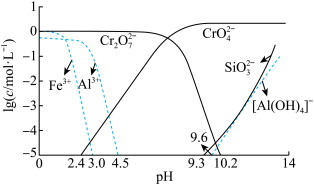
 的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生
的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生 和
和 沉淀。
沉淀。①若电解后溶液中
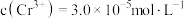 ,则
,则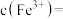
 {已知
{已知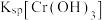
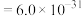 ,
,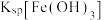 可从第(4)小题图中计算得出}。
可从第(4)小题图中计算得出}。②电解法处理含
 的酸性废水,下列有关原理的说法正确的是
的酸性废水,下列有关原理的说法正确的是A.阳极反应为

B.电解过程中溶液pH不会变化
C.如果石墨作阳极,电解过程不变
D.电路中每转移12mol电子,阳极有1mol
 被还原
被还原
您最近一年使用:0次
6 . [Cu(NH3)4]SO4•H2O是铜的重要配合物,其制备原料之一CuSO4可用废铜屑制备,其实验方案如下:
方案1:先灼烧废铜屑,再溶于稀硫酸,经系列操作得到CuSO4•5H2O;
方案2:加热废铜屑和98.3%硫酸的混合物;
方案3:在废铜屑和稀硫酸的混合液中滴加双氧水;
方案4:在废铜屑和稀硫酸的混合液中通入热空气。
下列叙述错误的是
方案1:先灼烧废铜屑,再溶于稀硫酸,经系列操作得到CuSO4•5H2O;
方案2:加热废铜屑和98.3%硫酸的混合物;
方案3:在废铜屑和稀硫酸的混合液中滴加双氧水;
方案4:在废铜屑和稀硫酸的混合液中通入热空气。
下列叙述错误的是
| A.方案1使用的玻璃仪器有烧杯、分液漏斗、玻璃棒和酒精灯 |
| B.方案2中参与反应的硫酸利用率为50%,且产生大气污染物 |
| C.方案3的离子方程式为Cu+H2O2+2H+=Cu2++2H2O |
D.方案4的化学方程式为2Cu+H2SO4+O2 2CuSO4+2H2O 2CuSO4+2H2O |
您最近一年使用:0次
7 . (NH4)2Fe(SO4)2(摩尔盐)是一种重要试剂。下列有关离子方程式错误的是
| A.在(NH4)2Fe(SO4)2溶液中滴加足量澄清石灰水:Fe2++2OH-=Fe(OH)2↓ |
| B.在(NH4)2Fe(SO4)2溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
C.在(NH4)2Fe(SO4)2溶液中滴加酸性KMnO4溶液:5Fe2++8H++MnO =Mn2++5Fe3++4H2O =Mn2++5Fe3++4H2O |
D.在(NH4)2Fe(SO4)2溶液中加入过量NaHCO3生成FeCO3:Fe2++2HCO =FeCO3↓+CO2↑+H2O =FeCO3↓+CO2↑+H2O |
您最近一年使用:0次
名校
解题方法
8 . 亚硝酸钙 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。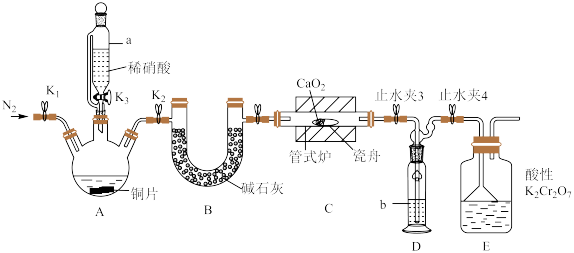
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: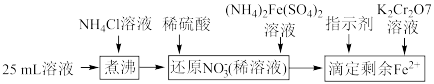
 ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
2024-05-23更新
|
221次组卷
|
5卷引用: 湖南省北师联盟2024届高三下学期模拟考试三模化学试题
名校
9 . 红树林沉积物中微生物驱动的硫循环过程原理如图所示,在有氧层中有机物通过微生物有氧呼吸来分解,在无氧层中有机物通过微生物驱动硫酸盐还原来分解,下列说法错误的是
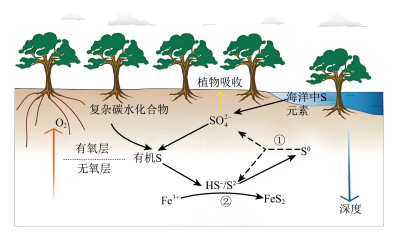
A.随着沉积物深度的增加, 主要做氧化剂将有机物氧化分解 主要做氧化剂将有机物氧化分解 |
B.反应①中氧化剂与还原剂的物质的量之比为 |
C.反应②中 与 与 的反应为 的反应为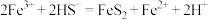 |
D.红树林沉积物中 元素主要以 元素主要以 形式存在 形式存在 |
您最近一年使用:0次
名校
10 .  可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以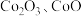 的形式存在,还含有
的形式存在,还含有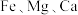 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: 常用作食品抗氧化剂。
常用作食品抗氧化剂。
②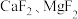 难溶于水。
难溶于水。
③部分金属阳离子形成氢氧化物沉淀的 如表所示:
如表所示:
回答下列问题:
(1)“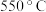 焙烧”的目的是
焙烧”的目的是__________________ 。
(2)“浸取”的过程中, 的主要作用是
的主要作用是__________________ (用离子方程式表示)。若用盐酸代替 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因__________________ 。
(3)“滤液1”中加入 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为_________ 。
(4)“滤渣2”的主要成分为_________ (填化学式)。
(5)已知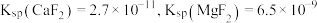 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中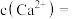
_________ (保留3位有效数字)。
(6)钴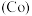 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的_________ 极(填“a”或“b”)。
②电解过程中Ⅱ室溶液 变小,则离子交换膜2为
变小,则离子交换膜2为_________ (填“阴”或“阳”)离子交换膜。
 可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以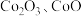 的形式存在,还含有
的形式存在,还含有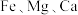 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: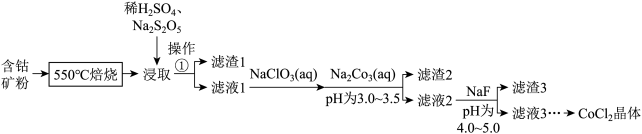
 常用作食品抗氧化剂。
常用作食品抗氧化剂。②
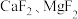 难溶于水。
难溶于水。③部分金属阳离子形成氢氧化物沉淀的
 如表所示:
如表所示:
|
|
|
|
| |
开始沉淀 | 0.3 | 2.7 | 7.2 | 7.6 | 9.6 |
完全沉淀 | 1.1 | 3.2 | 9.2 | 9.6 | 11.1 |
(1)“
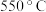 焙烧”的目的是
焙烧”的目的是(2)“浸取”的过程中,
 的主要作用是
的主要作用是 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因(3)“滤液1”中加入
 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为(4)“滤渣2”的主要成分为
(5)已知
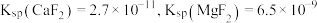 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中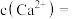
(6)钴
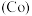 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。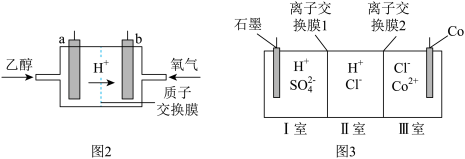
 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的②电解过程中Ⅱ室溶液
 变小,则离子交换膜2为
变小,则离子交换膜2为
您最近一年使用:0次




