1 . 部分含硫物质的“价-类”关系如图所示。下列叙述错误的是
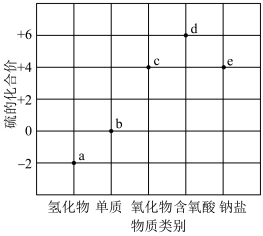
| A.一定条件下,能实现a→b→c→d的转化 |
| B.a和c反应中,氧化产物、还原产物的质量之比为2:1 |
| C.具有漂白性的c能使品红、石蕊溶液褪色 |
| D.利用b和e可以制备大苏打(Na2S2O3) |
您最近一年使用:0次
2 . [Cu(NH3)4]SO4•H2O是铜的重要配合物,其制备原料之一CuSO4可用废铜屑制备,其实验方案如下:
方案1:先灼烧废铜屑,再溶于稀硫酸,经系列操作得到CuSO4•5H2O;
方案2:加热废铜屑和98.3%硫酸的混合物;
方案3:在废铜屑和稀硫酸的混合液中滴加双氧水;
方案4:在废铜屑和稀硫酸的混合液中通入热空气。
下列叙述错误的是
方案1:先灼烧废铜屑,再溶于稀硫酸,经系列操作得到CuSO4•5H2O;
方案2:加热废铜屑和98.3%硫酸的混合物;
方案3:在废铜屑和稀硫酸的混合液中滴加双氧水;
方案4:在废铜屑和稀硫酸的混合液中通入热空气。
下列叙述错误的是
| A.方案1使用的玻璃仪器有烧杯、分液漏斗、玻璃棒和酒精灯 |
| B.方案2中参与反应的硫酸利用率为50%,且产生大气污染物 |
| C.方案3的离子方程式为Cu+H2O2+2H+=Cu2++2H2O |
D.方案4的化学方程式为2Cu+H2SO4+O2 2CuSO4+2H2O 2CuSO4+2H2O |
您最近一年使用:0次
3 . (NH4)2Fe(SO4)2(摩尔盐)是一种重要试剂。下列有关离子方程式错误的是
| A.在(NH4)2Fe(SO4)2溶液中滴加足量澄清石灰水:Fe2++2OH-=Fe(OH)2↓ |
| B.在(NH4)2Fe(SO4)2溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
C.在(NH4)2Fe(SO4)2溶液中滴加酸性KMnO4溶液:5Fe2++8H++MnO =Mn2++5Fe3++4H2O =Mn2++5Fe3++4H2O |
D.在(NH4)2Fe(SO4)2溶液中加入过量NaHCO3生成FeCO3:Fe2++2HCO =FeCO3↓+CO2↑+H2O =FeCO3↓+CO2↑+H2O |
您最近一年使用:0次
名校
4 . 红树林沉积物中微生物驱动的硫循环过程原理如图所示,在有氧层中有机物通过微生物有氧呼吸来分解,在无氧层中有机物通过微生物驱动硫酸盐还原来分解,下列说法错误的是
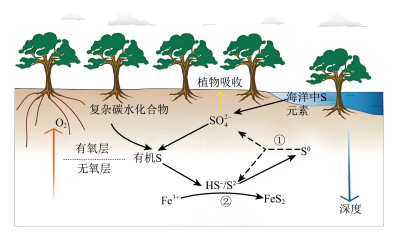
A.随着沉积物深度的增加, 主要做氧化剂将有机物氧化分解 主要做氧化剂将有机物氧化分解 |
B.反应①中氧化剂与还原剂的物质的量之比为 |
C.反应②中 与 与 的反应为 的反应为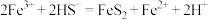 |
D.红树林沉积物中 元素主要以 元素主要以 形式存在 形式存在 |
您最近一年使用:0次
名校
5 .  可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以 的形式存在,还含有
的形式存在,还含有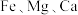 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: 常用作食品抗氧化剂。
常用作食品抗氧化剂。
②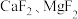 难溶于水。
难溶于水。
③部分金属阳离子形成氢氧化物沉淀的 如表所示:
如表所示:
回答下列问题:
(1)“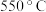 焙烧”的目的是
焙烧”的目的是__________________ 。
(2)“浸取”的过程中, 的主要作用是
的主要作用是__________________ (用离子方程式表示)。若用盐酸代替 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因__________________ 。
(3)“滤液1”中加入 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为_________ 。
(4)“滤渣2”的主要成分为_________ (填化学式)。
(5)已知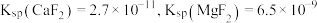 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中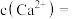
_________ (保留3位有效数字)。
(6)钴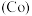 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的_________ 极(填“a”或“b”)。
②电解过程中Ⅱ室溶液 变小,则离子交换膜2为
变小,则离子交换膜2为_________ (填“阴”或“阳”)离子交换膜。
 可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以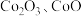 的形式存在,还含有
的形式存在,还含有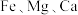 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: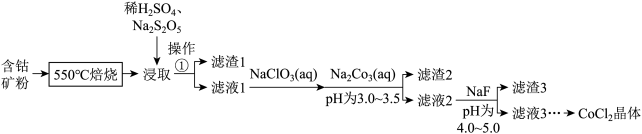
 常用作食品抗氧化剂。
常用作食品抗氧化剂。②
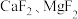 难溶于水。
难溶于水。③部分金属阳离子形成氢氧化物沉淀的
 如表所示:
如表所示:
|
|
|
|
| |
开始沉淀 | 0.3 | 2.7 | 7.2 | 7.6 | 9.6 |
完全沉淀 | 1.1 | 3.2 | 9.2 | 9.6 | 11.1 |
(1)“
 焙烧”的目的是
焙烧”的目的是(2)“浸取”的过程中,
 的主要作用是
的主要作用是 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因(3)“滤液1”中加入
 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为(4)“滤渣2”的主要成分为
(5)已知
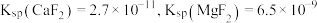 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中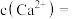
(6)钴
 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。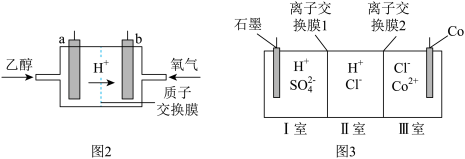
 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的②电解过程中Ⅱ室溶液
 变小,则离子交换膜2为
变小,则离子交换膜2为
您最近一年使用:0次
名校
6 . 利用高分子吸附树脂吸附 来提取卤水中的碘(以
来提取卤水中的碘(以 形式存在)的工艺流程如下:
形式存在)的工艺流程如下:
 来提取卤水中的碘(以
来提取卤水中的碘(以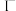 形式存在)的工艺流程如下:
形式存在)的工艺流程如下: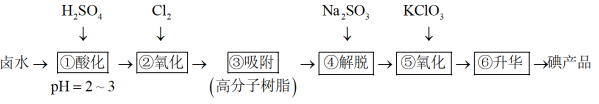
A.流程中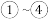 的目的是富集碘 的目的是富集碘 |
B.步骤②中 不宜过量太多,以防止 不宜过量太多,以防止 进一步氧化 进一步氧化 |
| C.步骤④的作用是将吸附的碘还原而脱离高分子树脂 |
D.步骤⑤的离子方程式为: |
您最近一年使用:0次
7 . 正高碘酸(H5IO6)是白色结晶性粉末,可溶于水,主要用作氧化剂和分析试剂。由NaI制取H5IO6的实验流程如图所示:
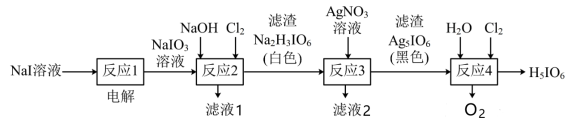
A.“反应1”中: |
B.“反应2”中: |
C.“反应3”中: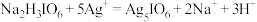 |
D.“反应4”中: |
您最近一年使用:0次
8 . 氧钒(Ⅳ)碱式碳酸铵晶体{化学式为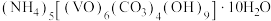 ,
,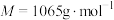 }是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
}是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:

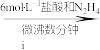
 溶液
溶液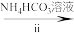 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体
已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)N2H4为二元弱碱,其在水中的电离过程与NH3类似,其第一步电离方程式为_____ ,第二步电离方程式为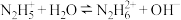 ;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:
;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:_____ 。
(2)步骤ii可通过如图装置完成。 的优点为
的优点为_____ ,检查其气密性的操作为_____ 。
②实验开始时,先打开_____ (填“K1”或“K2”)。
③盛装NH4HCO3溶液的仪器名称为_____ 。
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度。
实验步骤:粗产品wg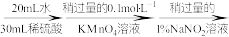
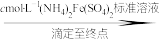 再重复实验两次。
再重复实验两次。
已知: 。
。
①滴入NaNO2溶液的目的是除去KMnO4,写出其反应的离子方程式:_____ 。
②若平均消耗cmol/L(NH4)2Fe(SO4)2标准溶液的体积为amL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为_____  。
。
③若其他操作均正确,但NaNO2的加入量不足,会引起测定结果_____ (填“偏大”“偏小”或“无影响”)。
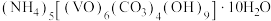 ,
,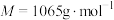 }是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
}是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
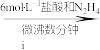
 溶液
溶液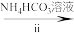 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)N2H4为二元弱碱,其在水中的电离过程与NH3类似,其第一步电离方程式为
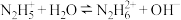 ;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:
;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:(2)步骤ii可通过如图装置完成。
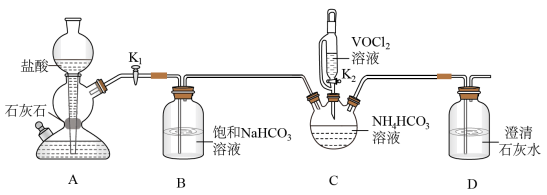
 的优点为
的优点为②实验开始时,先打开
③盛装NH4HCO3溶液的仪器名称为
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度。
实验步骤:粗产品wg
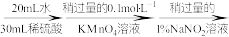
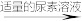
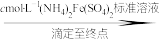 再重复实验两次。
再重复实验两次。已知:
 。
。①滴入NaNO2溶液的目的是除去KMnO4,写出其反应的离子方程式:
②若平均消耗cmol/L(NH4)2Fe(SO4)2标准溶液的体积为amL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为
 。
。③若其他操作均正确,但NaNO2的加入量不足,会引起测定结果
您最近一年使用:0次
2024-05-08更新
|
218次组卷
|
2卷引用:湖南省衡阳市祁东县2024届高三第三次联考(三模)化学试题
名校
9 . 锌是一种重要的金属,锌及其化合物被广泛应用于汽车、建筑、船舶、电池等行业。现某科研小组以固体废锌催化剂(主要成分是 ,含少量
,含少量 、
、 、
、 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示: 和
和 转化为
转化为 、
、 进入溶液。
进入溶液。
②25℃时,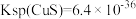 ,
,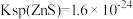
③深度除杂标准:溶液中 ≤2.0×10-6
≤2.0×10-6
(1)“浸取”温度为30℃,锌的浸出率可达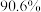 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为___________ 。
(2)“滤渣1”的主要成分为 、
、___________ 。
(3)“深度除锰”是将残留的 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式___________ 。
(4)“深度除铜”时,锌的最终回收率,除铜效果(用反应后溶液中的铜锌比 表示)与
表示)与 加入量的关系曲线如图所示。
加入量的关系曲线如图所示。 加入量最优选择
加入量最优选择___________ (填标号)
A.100% B.110% C.120% D.130%
②由图可知,当 达到一定量的时候,锌的最终回收率下降的原因是
达到一定量的时候,锌的最终回收率下降的原因是___________ (用离子方程式解释)。
(5) 原子能形成多种配位化合物,一种锌的配合物结构如图:
原子能形成多种配位化合物,一种锌的配合物结构如图:___________ 。
②键角③___________ 120°(填“<”或“=”)。
 ,含少量
,含少量 、
、 、
、 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示: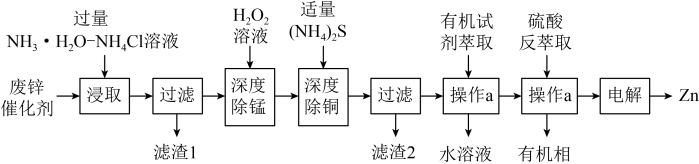
 和
和 转化为
转化为 、
、 进入溶液。
进入溶液。②25℃时,
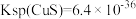 ,
,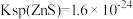
③深度除杂标准:溶液中
 ≤2.0×10-6
≤2.0×10-6(1)“浸取”温度为30℃,锌的浸出率可达
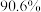 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为(2)“滤渣1”的主要成分为
 、
、(3)“深度除锰”是将残留的
 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式(4)“深度除铜”时,锌的最终回收率,除铜效果(用反应后溶液中的铜锌比
 表示)与
表示)与 加入量的关系曲线如图所示。
加入量的关系曲线如图所示。
 加入量最优选择
加入量最优选择A.100% B.110% C.120% D.130%
②由图可知,当
 达到一定量的时候,锌的最终回收率下降的原因是
达到一定量的时候,锌的最终回收率下降的原因是(5)
 原子能形成多种配位化合物,一种锌的配合物结构如图:
原子能形成多种配位化合物,一种锌的配合物结构如图: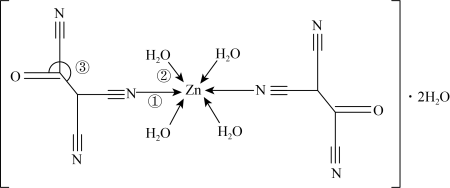
②键角③
您最近一年使用:0次
解题方法
10 . 中国科学院武汉物理与数学研究所在甲烷和一氧化碳催化转化制备有机物X的反应机理(如图)研究方面取得重要进展。下列说法错误的是
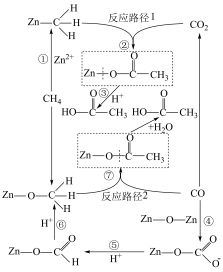

| A.有机物X可用作厨房中的调味剂 |
B.中间体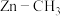 和 和 中C的化合价不同 中C的化合价不同 |
| C.反应②过程中存在键的断裂 |
D.过程⑤的反应为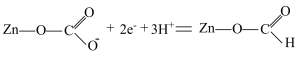 |
您最近一年使用:0次





