名校
1 . 宏观辨识与微观探析是化学学科核心素养之一,下列反应方程式书写正确的是
A.用饱和 溶液吸收少量氯气: 溶液吸收少量氯气: |
B.向 溶液中通入少量氯气: 溶液中通入少量氯气: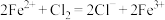 |
C.制备 时白色沉淀会快速变为灰绿色最后变为红褐色的原因: 时白色沉淀会快速变为灰绿色最后变为红褐色的原因: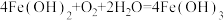 |
D.用丙烯腈电合成己二腈,在阳极发生的电极反应: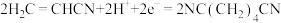 |
您最近一年使用:0次
昨日更新
|
50次组卷
|
2卷引用:黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试题(五)
名校
解题方法
2 . 铟(In)是制造半导体、电光源等的重要原料。从铜冶炼过程中产生的铟砷烟灰(主要含有 、
、 )中提取铟的工艺方法如下:
)中提取铟的工艺方法如下: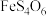 为强电解质;
为强电解质;
② 为磷酸二异辛酯,密度为
为磷酸二异辛酯,密度为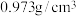 ,其在酸性溶液中可萃取三价金属离子;
,其在酸性溶液中可萃取三价金属离子;
③ 。
。
回答下列问题:
(1)滤渣的主要成分除 外还有
外还有___________ 、___________ (填化学式);“氧化酸浸”过程中, 中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:
中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:___________ 。
(2)“还原铁”时反应的离子方程式为___________ 。
(3)“萃取除铁”时,用 的
的 作萃取剂时,发现当溶液
作萃取剂时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是___________ (用平衡移动原理解释);反萃取时萃余液应从分液漏斗的___________ (填“下口放出”或“上口倒出”)。
(4)“萃取”过程中也可用酸(用 表示)作萃取剂,使
表示)作萃取剂,使 进入有机相,发生反应:
进入有机相,发生反应: ,平衡常数为
,平衡常数为 。已知
。已知 与萃取率
与萃取率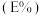 的关系符合公式:
的关系符合公式: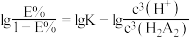 。当
。当 时,萃取率为
时,萃取率为 ,若将萃取率提升到
,若将萃取率提升到 ,应调节溶液的
,应调节溶液的
___________ (已知 ,忽略萃取剂浓度的变化,结果保留三位有效数字)。
,忽略萃取剂浓度的变化,结果保留三位有效数字)。
(5)整个工艺流程中,可循环利用的物质是___________ 。
(6)2023年诺贝尔化学奖授予对量子点的发现有突出贡献的科研工作者。铜铟硫 量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系
量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系 的晶胞结构如图所示,晶胞中In和
的晶胞结构如图所示,晶胞中In和 未标明,用
未标明,用 或者
或者 代替。
代替。 位于由
位于由 构成的
构成的___________ (填“四面体空隙”、“六面体空隙”或“八面体空隙”)中。
 、
、 )中提取铟的工艺方法如下:
)中提取铟的工艺方法如下: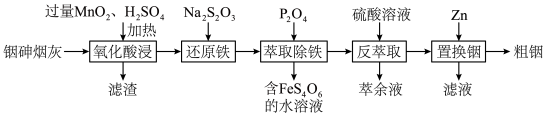
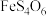 为强电解质;
为强电解质;②
 为磷酸二异辛酯,密度为
为磷酸二异辛酯,密度为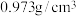 ,其在酸性溶液中可萃取三价金属离子;
,其在酸性溶液中可萃取三价金属离子;③
 。
。回答下列问题:
(1)滤渣的主要成分除
 外还有
外还有 中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:
中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:(2)“还原铁”时反应的离子方程式为
(3)“萃取除铁”时,用
 的
的 作萃取剂时,发现当溶液
作萃取剂时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是(4)“萃取”过程中也可用酸(用
 表示)作萃取剂,使
表示)作萃取剂,使 进入有机相,发生反应:
进入有机相,发生反应: ,平衡常数为
,平衡常数为 。已知
。已知 与萃取率
与萃取率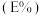 的关系符合公式:
的关系符合公式: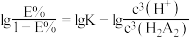 。当
。当 时,萃取率为
时,萃取率为 ,若将萃取率提升到
,若将萃取率提升到 ,应调节溶液的
,应调节溶液的
 ,忽略萃取剂浓度的变化,结果保留三位有效数字)。
,忽略萃取剂浓度的变化,结果保留三位有效数字)。(5)整个工艺流程中,可循环利用的物质是
(6)2023年诺贝尔化学奖授予对量子点的发现有突出贡献的科研工作者。铜铟硫
 量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系
量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系 的晶胞结构如图所示,晶胞中In和
的晶胞结构如图所示,晶胞中In和 未标明,用
未标明,用 或者
或者 代替。
代替。 位于由
位于由 构成的
构成的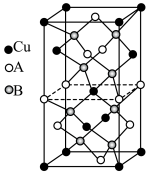
您最近一年使用:0次
名校
3 . 羟基氧化铁 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
 .产品制备及产率计算
.产品制备及产率计算
①制备晶种:称取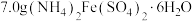 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至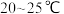 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加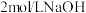 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
②氧化过程:称取足量 ,加入上述溶液,于
,加入上述溶液,于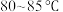 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。
③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用 试纸检验溶液
试纸检验溶液 的操作为
的操作为___________ 。
(2)①中观察到沉淀的颜色变为___________ 色时,证明已经成功制备晶种。
(3)②氧化过程中,发生反应的离子方程式为___________ 。
(4)抽滤装置如图,仪器c的作用为___________ ,和普通过滤相比,抽滤的优点有过滤速度更快和___________ 。 .产品纯度测定
.产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。 ,
,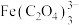 不与稀
不与稀 溶液反应。
溶液反应。
(5)铁黄溶于 标准液的离子方程式为
标准液的离子方程式为___________ 。
(6) 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为___________ (列出计算式,不需化简)。
(7)若 溶液过量,会使测定结果
溶液过量,会使测定结果___________ (填“偏大”、“偏小”或“无影响”)。(已知草酸的电离平衡常数: )
)
 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下: .产品制备及产率计算
.产品制备及产率计算①制备晶种:称取
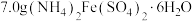 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至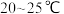 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加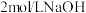 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。②氧化过程:称取足量
 ,加入上述溶液,于
,加入上述溶液,于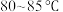 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用
 试纸检验溶液
试纸检验溶液 的操作为
的操作为(2)①中观察到沉淀的颜色变为
(3)②氧化过程中,发生反应的离子方程式为
(4)抽滤装置如图,仪器c的作用为
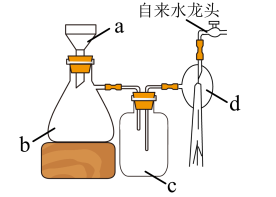
 .产品纯度测定
.产品纯度测定铁黄纯度可以通过产品的耗酸量确定。

 ,
,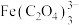 不与稀
不与稀 溶液反应。
溶液反应。(5)铁黄溶于
 标准液的离子方程式为
标准液的离子方程式为(6)
 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为(7)若
 溶液过量,会使测定结果
溶液过量,会使测定结果 )
)
您最近一年使用:0次
2024-05-17更新
|
329次组卷
|
3卷引用:2024届黑龙江省哈尔滨师范大学附属中学高三下学期三模化学试题
解题方法
4 . 红矾钠(重铬酸钠: )是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿(
)是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿( ,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题:
,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题: 转化为
转化为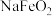 和
和 。
。
②“浸取”时铁元素以 形式存在。
形式存在。
(1)写出“焙烧”时 被氧化的化学方程式:
被氧化的化学方程式:_______ 。
(2)为了加快浸取速率可采取的措施有_______ (请写出两种方法)。
(3)矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如图所示。当溶液中可溶性组分的浓度 时认为已除尽。
时认为已除尽。_______ ,滤渣的主要成分有_______ 。
(4)“酸化”时,不可以将硫酸改为盐酸(HCl),原因是(用离子方程式表示)_______ 。
(5)“冷却结晶”所得母液中,除 外,可在上述流程中循环利用的物质还有
外,可在上述流程中循环利用的物质还有_______ (用化学式表示)。
(6) 的三种结构:①
的三种结构:①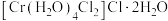 、②
、②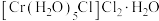 、③
、③ ,下列说法错误的是_______。
,下列说法错误的是_______。
 )是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿(
)是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿( ,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题:
,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题: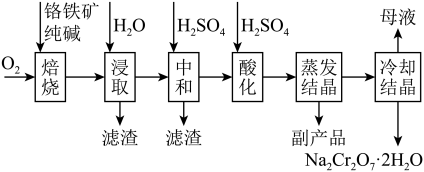
 转化为
转化为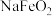 和
和 。
。②“浸取”时铁元素以
 形式存在。
形式存在。(1)写出“焙烧”时
 被氧化的化学方程式:
被氧化的化学方程式:(2)为了加快浸取速率可采取的措施有
(3)矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如图所示。当溶液中可溶性组分的浓度
 时认为已除尽。
时认为已除尽。
(4)“酸化”时,不可以将硫酸改为盐酸(HCl),原因是(用离子方程式表示)
(5)“冷却结晶”所得母液中,除
 外,可在上述流程中循环利用的物质还有
外,可在上述流程中循环利用的物质还有(6)
 的三种结构:①
的三种结构:①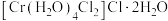 、②
、②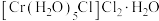 、③
、③ ,下列说法错误的是_______。
,下列说法错误的是_______。A.①中配合离子空间结构为 或 或 (已略去位于正八面体中心的 (已略去位于正八面体中心的 ) ) |
B.②③中 的配位数都是6 的配位数都是6 |
| C.②中存在的作用力有离子键、共价键、配位键和氢键等 |
D.等物质的量浓度、等体积的①②③溶液中, 的物质的量相等 的物质的量相等 |
您最近一年使用:0次
解题方法
5 . 工业上常用的一种海水中提溴技术叫做“吹出法”,其过程主要包括氧化、吹出、吸收和蒸馏等环节(如下图),下列有关说法错误的是
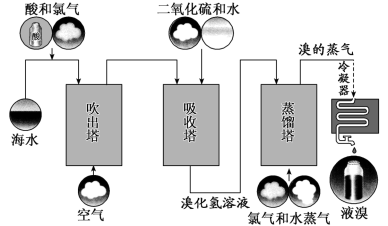
A.过程中酸化海水的目的是抑制 的溶解 的溶解 |
B.吸收塔中发生的主要反应的化学方程式为 |
| C.实验室模拟蒸馏过程,用到的主要仪器包括:蒸馏烧瓶、球形冷凝管、温度计等 |
D.保存液溴的过程中,水封的主要目的是防止或减弱 的挥发 的挥发 |
您最近一年使用:0次
名校
解题方法
6 . 红磷可用于制备半导体化合物,还可以用于制造火柴、烟火,以及三氯化磷等。
Ⅰ.研究小组以无水甲苯为溶剂, (易水解)和
(易水解)和 (叠氮化钠)为反应物制备红磷。
(叠氮化钠)为反应物制备红磷。
实验步骤如下:
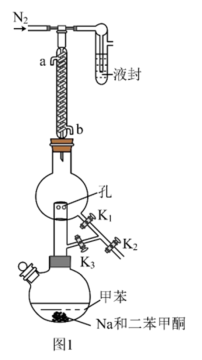
①甲苯的干燥和收集:装置如图1所示(夹持及加热装置略)
已知:二苯甲酮为指示剂,无水时体系呈蓝色,甲苯的沸点为110.6℃。 的作用是
的作用是___________ 。
(2)先小火加热控温100℃一段时间,打开活塞___________ ,达到除水的目的。再升温至120℃左右,打开活塞___________ ,达到分离收集甲苯的目的。
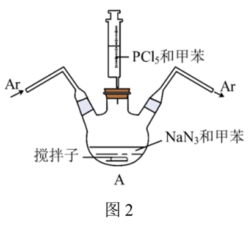
②红磷的制备:装置如图2所示(夹持、搅拌、加热装置已略)。___________ 。用氩气赶走空气的目的是___________ 。
(4)离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是___________ 。
Ⅱ.该实验所需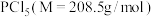 的纯度要求极高,对于的纯度测定如下:
的纯度要求极高,对于的纯度测定如下:
步骤Ⅰ:取 上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成
上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成 溶液;
溶液;
步骤Ⅱ:取 上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入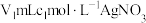 溶液(过量),使
溶液(过量),使 完全转化为
完全转化为 沉淀(
沉淀( 可溶于稀硝酸);
可溶于稀硝酸);
步骤Ⅲ:加入少量硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用 溶液滴定过量的
溶液滴定过量的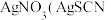 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去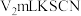 溶液。
溶液。
(5)产品中 的质量分数为
的质量分数为___________  ,若测定过程中没有加入硝基苯,则所测
,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会___________ (填“偏大”“偏小”或“不变”)。
Ⅰ.研究小组以无水甲苯为溶剂,
 (易水解)和
(易水解)和 (叠氮化钠)为反应物制备红磷。
(叠氮化钠)为反应物制备红磷。实验步骤如下:
①甲苯的干燥和收集:装置如图1所示(夹持及加热装置略)
已知:二苯甲酮为指示剂,无水时体系呈蓝色,甲苯的沸点为110.6℃。
 的作用是
的作用是(2)先小火加热控温100℃一段时间,打开活塞
②红磷的制备:装置如图2所示(夹持、搅拌、加热装置已略)。
(4)离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是
Ⅱ.该实验所需
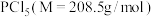 的纯度要求极高,对于的纯度测定如下:
的纯度要求极高,对于的纯度测定如下:步骤Ⅰ:取
 上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成
上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成 溶液;
溶液;步骤Ⅱ:取
 上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入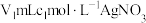 溶液(过量),使
溶液(过量),使 完全转化为
完全转化为 沉淀(
沉淀( 可溶于稀硝酸);
可溶于稀硝酸);步骤Ⅲ:加入少量硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用
 溶液滴定过量的
溶液滴定过量的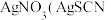 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去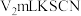 溶液。
溶液。(5)产品中
 的质量分数为
的质量分数为 ,若测定过程中没有加入硝基苯,则所测
,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会
您最近一年使用:0次
解题方法
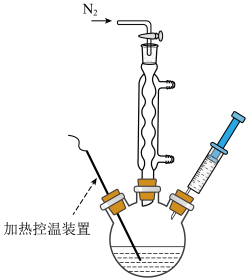
7 . 2023 年诺贝尔化学奖授予发现量子点的三位科学家,量子点的尺寸一般在1 nm~10 nm之间,是一种纳米级别的半导体。量子点的尺寸不同,则发光颜色不同,吸收光谱波长不同。实验室一种制备CdSe量子点的方法如下:
一、CdSe量子点前驱体的制备
Ⅰ.N2气氛中,取1 mmol Se粉于三颈烧瓶中,加入15 mL的十八烯溶剂,加热到280℃,Se粉完全溶解形成橙色透明溶液;
Ⅱ.N2气氛中,将1 mmol CdCl2溶于4 mL油酸,加热至120℃,使CdCl2完全溶于油酸,形成油酸镉澄清液体。
二、CdSe量子点的生长与制备
Ⅲ.将步骤Ⅱ中制备好的油酸镉溶液注射至步骤Ⅰ中含有Se粉的三颈烧瓶中,如下图所示,保持反应温度为260℃,反应45min。
Ⅳ.待反应液冷却后,加入20 mL乙醇溶液,CdSe析出,离心分离,加入正己烷分散后,再次加入乙醇,离心分离,重复2~3次后,用乙醇和丙酮洗涤 CdSe,即可得到干净的CdSe量子点。
回答下列问题:
(1)Cd为第五周期ⅡB族,则Cd的价层电子排布式为___________ 。
(2)步骤Ⅱ中N2的作用为___________ ,油酸与镉配位的原子为___________ 。
(3)Se的一种制备方法如下:向Na2SeO3水溶液中加入 进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为___________ ;此方法获得Se单质过程中无需使用的仪器是___________ (填名称)。___________ 现象时,证明CdSe量子点生长基本停止,制备完成。除此方法外,还可利用___________ 物理现象初步鉴定CdSe量子点制备成功。
(5)步骤Ⅳ中加入20 mL乙醇的作用是___________ 。
(6)CdSe洗涤干净的标志是___________ 。
一、CdSe量子点前驱体的制备
Ⅰ.N2气氛中,取1 mmol Se粉于三颈烧瓶中,加入15 mL的十八烯溶剂,加热到280℃,Se粉完全溶解形成橙色透明溶液;
Ⅱ.N2气氛中,将1 mmol CdCl2溶于4 mL油酸,加热至120℃,使CdCl2完全溶于油酸,形成油酸镉澄清液体。
二、CdSe量子点的生长与制备
Ⅲ.将步骤Ⅱ中制备好的油酸镉溶液注射至步骤Ⅰ中含有Se粉的三颈烧瓶中,如下图所示,保持反应温度为260℃,反应45min。
Ⅳ.待反应液冷却后,加入20 mL乙醇溶液,CdSe析出,离心分离,加入正己烷分散后,再次加入乙醇,离心分离,重复2~3次后,用乙醇和丙酮洗涤 CdSe,即可得到干净的CdSe量子点。
回答下列问题:
(1)Cd为第五周期ⅡB族,则Cd的价层电子排布式为
(2)步骤Ⅱ中N2的作用为
(3)Se的一种制备方法如下:向Na2SeO3水溶液中加入
 进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
(5)步骤Ⅳ中加入20 mL乙醇的作用是
(6)CdSe洗涤干净的标志是
您最近一年使用:0次
2024-05-13更新
|
112次组卷
|
2卷引用:东北三省四市教研联合体2024届高三下学期高考模拟(二)化学试题
名校
8 . 磷酸亚铁锂(LiFePO4)电池工作电压适中、放电功率高、在高温和高热环境下的稳定性高,是新能源汽车的动力电池之一、一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图:
已知:FePO4可溶于pH小于2的酸性溶液。
回答下列问题:
(1)铁在元素周期中的位置是___________ ,FePO4·2H2O中Fe元素的化合价是___________ 。
(2)操作2的名称是___________ 。
(3)TiO2是一种白色颜料,用TiCl4制备TiO2·xH2O的化学方程式是___________ 。
(4)滤液2与磷酸、双氧水生成FePO4·2H2O的离子方程式为___________ ,向滤液2中加入NaOH溶液调节溶液的pH,将溶液的pH控制在2.0的原因是___________ 。
(5)聚丙烯的作用是___________ 。
(6)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体,电池充电时,LiFePO4作极___________ (“阴”或“阳”),脱出部分Li+,进而转化为Li1-xFePO4,Li1-xFePO4结构示意图如(b)所示,则其中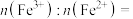
___________ 。

| 物质 | FeS | Mns | CuS | PbS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 1.6×10-24 |
回答下列问题:
(1)铁在元素周期中的位置是
(2)操作2的名称是
(3)TiO2是一种白色颜料,用TiCl4制备TiO2·xH2O的化学方程式是
(4)滤液2与磷酸、双氧水生成FePO4·2H2O的离子方程式为
(5)聚丙烯的作用是
(6)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体,电池充电时,LiFePO4作极
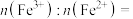

您最近一年使用:0次
名校
解题方法
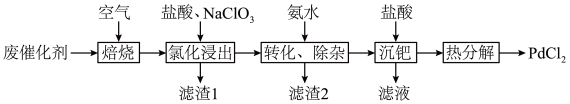
9 . 以Al2O3为载体的钯催化剂常用于石化行业加氢催化裂化过程中,工业上以失活后的废Pd-Al2O3催化剂(主要含有Pd、Al2O3,还有少量PdO、SiO2、C)为原料制备氯化钯的流程如下:
(1)“焙烧”能有效清除废催化剂表面的积碳,打开Al2O3载体对钯的包裹,提高“氯化浸出”率。依据下图可判断“焙烧”的温度和时间应控制在___________ ,若焙烧时间过长,导致“氯化浸出”率下降可能的原因是___________ 。___________ ,通过该工序可将Pd转化为 ,
, 呈平面四边形,则
呈平面四边形,则 的杂化轨道类型为
的杂化轨道类型为___________ (填字母)。
A.sp2杂化 B.sp3杂化 C.dsp2杂化 D.dsp3杂化
(3)滤渣1为___________ ,滤渣2为___________ 。
(4)就“沉钯”中获得的 进行“热分解”,生成的气体可返回
进行“热分解”,生成的气体可返回___________ 工序继续使用。
(5)工业上也可用 还原
还原 制取海绵Pd,且对环境友好,该反应的化学方程式为
制取海绵Pd,且对环境友好,该反应的化学方程式为___________ 。
(1)“焙烧”能有效清除废催化剂表面的积碳,打开Al2O3载体对钯的包裹,提高“氯化浸出”率。依据下图可判断“焙烧”的温度和时间应控制在

 ,
, 呈平面四边形,则
呈平面四边形,则 的杂化轨道类型为
的杂化轨道类型为A.sp2杂化 B.sp3杂化 C.dsp2杂化 D.dsp3杂化
(3)滤渣1为
(4)就“沉钯”中获得的
 进行“热分解”,生成的气体可返回
进行“热分解”,生成的气体可返回(5)工业上也可用
 还原
还原 制取海绵Pd,且对环境友好,该反应的化学方程式为
制取海绵Pd,且对环境友好,该反应的化学方程式为
您最近一年使用:0次
2024-04-02更新
|
506次组卷
|
4卷引用:东北三省2024届高三下学期三校二模联考化学试题
名校
解题方法
10 . KMnO4是重要氧化剂,广泛用于化工、防腐以及制药等领域。以软锰矿(主要成分为MnO2)为原料,经中间产物K2MnO4制备KMnO4的流程如图。下列说法错误的是
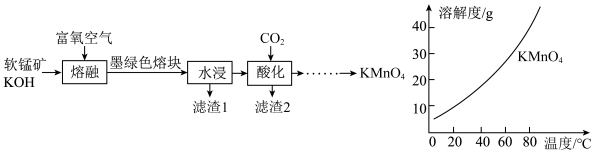
A.“熔融”过程中,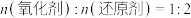 |
| B.滤渣2经处理后可循环回“熔融”过程以提高锰元素的利用率 |
| C.用盐酸替代CO2能加快“酸化”时的速率 |
| D.得到KMnO4晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥 |
您最近一年使用:0次
2024-04-02更新
|
744次组卷
|
6卷引用:东北三省2024届高三下学期三校二模联考化学试题
东北三省2024届高三下学期三校二模联考化学试题黑龙江省哈尔滨市三校联考2024届高三二模化学试题(已下线)化学(新七省高考“15+4”)-2024年高考押题预测卷东北三省2024届高三下学期三校二模联考化学试题湖南省衡阳县第四中学2023-2024学年高三下学期4月月考化学试题(已下线)压轴题02 氧化还原反应的概念及规律(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)



