磷酸亚铁锂(LiFePO4)电池工作电压适中、放电功率高、在高温和高热环境下的稳定性高,是新能源汽车的动力电池之一、一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图:
已知:FePO4可溶于pH小于2的酸性溶液。
回答下列问题:
(1)铁在元素周期中的位置是___________ ,FePO4·2H2O中Fe元素的化合价是___________ 。
(2)操作2的名称是___________ 。
(3)TiO2是一种白色颜料,用TiCl4制备TiO2·xH2O的化学方程式是___________ 。
(4)滤液2与磷酸、双氧水生成FePO4·2H2O的离子方程式为___________ ,向滤液2中加入NaOH溶液调节溶液的pH,将溶液的pH控制在2.0的原因是___________ 。
(5)聚丙烯的作用是___________ 。
(6)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体,电池充电时,LiFePO4作极___________ (“阴”或“阳”),脱出部分Li+,进而转化为Li1-xFePO4,Li1-xFePO4结构示意图如(b)所示,则其中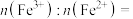
___________ 。

| 物质 | FeS | Mns | CuS | PbS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 1.6×10-24 |
回答下列问题:
(1)铁在元素周期中的位置是
(2)操作2的名称是
(3)TiO2是一种白色颜料,用TiCl4制备TiO2·xH2O的化学方程式是
(4)滤液2与磷酸、双氧水生成FePO4·2H2O的离子方程式为
(5)聚丙烯的作用是
(6)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体,电池充电时,LiFePO4作极

更新时间:2024-05-10 09:37:54
|
相似题推荐
【推荐1】碲被誉为现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁。工业上从某电镀污泥(含有 、
、 以及少量的Au)中提取粗碲,同时获得副产品重铬酸钾、金属铜和金的工艺流程如图所示。
以及少量的Au)中提取粗碲,同时获得副产品重铬酸钾、金属铜和金的工艺流程如图所示。

已知:①沉淀时 与pH的关系
与pH的关系
②溶解度
回答下列问题:
(1)“煅烧”时气体与固体原料逆流而行,目的是_______ ;“煅烧”时 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(2)金在_______ (填操作单元名称)过程中回收。已知浸出液中含有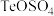 ,每得到128g碲,理论上消耗
,每得到128g碲,理论上消耗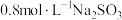 溶液的体积为
溶液的体积为_______ L。
(3)根据相关物质溶解度特点分析“操作a”的步骤:向 溶液中加入KCl固体,
溶液中加入KCl固体,_______ (填操作名称,下同),使NaCl结晶析出后_______ ,再_______ 得到 晶体。
晶体。
(4)铬(VI)毒性很高,工业上常用铁和石墨作电极,处理含 的酸性废水。通电后
的酸性废水。通电后 先转变为
先转变为 ,一段时间后变成
,一段时间后变成 沉淀而被除去。其中铁电极的作用是电子导体和
沉淀而被除去。其中铁电极的作用是电子导体和_______ ,当电解后溶液中 浓度为
浓度为 时,其开始沉降时废水的pH为
时,其开始沉降时废水的pH为_______ 。
 、
、 以及少量的Au)中提取粗碲,同时获得副产品重铬酸钾、金属铜和金的工艺流程如图所示。
以及少量的Au)中提取粗碲,同时获得副产品重铬酸钾、金属铜和金的工艺流程如图所示。
已知:①沉淀时
 与pH的关系
与pH的关系 | pH | |
| 开始沉淀 | 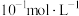 | 3.68 |
| 沉淀完全 |  | 5 |
| 溶解度 |  | NaCl |
| 100℃ | 95.1g | 39.8g |
| 25℃ | 4.6g | 36g |
(1)“煅烧”时气体与固体原料逆流而行,目的是
 发生反应的化学方程式为
发生反应的化学方程式为(2)金在
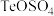 ,每得到128g碲,理论上消耗
,每得到128g碲,理论上消耗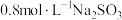 溶液的体积为
溶液的体积为(3)根据相关物质溶解度特点分析“操作a”的步骤:向
 溶液中加入KCl固体,
溶液中加入KCl固体, 晶体。
晶体。(4)铬(VI)毒性很高,工业上常用铁和石墨作电极,处理含
 的酸性废水。通电后
的酸性废水。通电后 先转变为
先转变为 ,一段时间后变成
,一段时间后变成 沉淀而被除去。其中铁电极的作用是电子导体和
沉淀而被除去。其中铁电极的作用是电子导体和 浓度为
浓度为 时,其开始沉降时废水的pH为
时,其开始沉降时废水的pH为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】许多物质中同一元素可以存在多种化合价, 或是可以看成存在多种化合价,这样有助于把握某些反应的本质。元素R是最高化合价为+6的短周期元素,Na2R2O8是一种极强的氧化剂,该物质的某种元素可以看成存在多种化合价。注:回答下列问题时,必须用R元素的真实元素符号作答。
(1)R元素的基态原子中,具有_______ 种不同空间运动状态的电子,具有_______ 种不同运动状态的电子。
(2)已知氧化性: >
> >I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到
>I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到_______ 的现象。该过程中被还原的元素是_______ 。
(3)加热Na2R2O8溶液,可以放出一种无色无味气体,结合上述信息,写出该反应的化学方程式_______ 。
(1)R元素的基态原子中,具有
(2)已知氧化性:
 >
> >I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到
>I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到(3)加热Na2R2O8溶液,可以放出一种无色无味气体,结合上述信息,写出该反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】(11分)近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。
已知:P204[二(2−乙基己基)磷酸酯]常用于萃取锰,P507(2−乙基己基膦酸−2−乙基己酯)和Cyanex272[二(2,4,4)−三甲基戊基次磷酸]常用于萃取钴、镍。
回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式__________________________________ 。
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:
加入NaOH溶液调pH=5可除去图中的________ (填金属离子符号)杂质;写出除去金属离子的离子方程式________________________ (一种即可)。
(3)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq) MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq) MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为
MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________ 。
(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。
由图可知,钴、镍的萃取率随萃取剂浓度增大而_________ (填“增大”或“减小”);两种萃取剂中___________ (填“P507”或“Cyanex272”)的分离效果比较好,若选P507为萃取剂,则最适宜的萃取剂浓度大约为__________ mol·L−1;若选Cyanex272萃取剂,则最适宜的萃取剂浓度大约为___________ mol·L−1。
(5)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×10−16,则沉镍母液中Ni2+的浓度为2.1×10−11 mol·L−1时,pH=______ (lg5=0.7)。

已知:P204[二(2−乙基己基)磷酸酯]常用于萃取锰,P507(2−乙基己基膦酸−2−乙基己酯)和Cyanex272[二(2,4,4)−三甲基戊基次磷酸]常用于萃取钴、镍。
回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:

加入NaOH溶液调pH=5可除去图中的
(3)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)
 MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq) MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为
MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。

■—Co(Cyanex272);●—Ni(Cyanex272);▲—Co(P507);▼—Ni(P507)
由图可知,钴、镍的萃取率随萃取剂浓度增大而
(5)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×10−16,则沉镍母液中Ni2+的浓度为2.1×10−11 mol·L−1时,pH=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】减少CO2的排放,合理利用CO2使其资源化具有重要意义。
(1)CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25℃,101KPa下:
H2(g)+ O2(g)=H2O(g) ΔH1=−242kJ/mol
O2(g)=H2O(g) ΔH1=−242kJ/mol
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) ΔH2=−676kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH2=−676kJ/mol
①写出CO2和H2生成气态甲醇等产物的热化学方程式_____ 。
②下面表示合成甲醇反应的能量变化示意图,正确的是_____ (填字母)。
a. b.
b.  c.
c.  d.
d.
③工业上用合成得到的甲醇制成微生物燃料电池,结构示意图如图1:

该电池外电路电子的流动方向为_____ (填写“从A到B”或“从B到A”)。A电极附近甲醇发生的电极反应式为_____ 。
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图2:

①写出X的化学式_____ 。
②在阳极区发生的反应为:_____ 和H++HCO =H2O+CO2↑。
=H2O+CO2↑。
③简述K2CO3在阴极区再生的原理_____ 。
(1)CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25℃,101KPa下:
H2(g)+
 O2(g)=H2O(g) ΔH1=−242kJ/mol
O2(g)=H2O(g) ΔH1=−242kJ/molCH3OH(g)+
 O2(g)=CO2(g)+2H2O(g) ΔH2=−676kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH2=−676kJ/mol①写出CO2和H2生成气态甲醇等产物的热化学方程式
②下面表示合成甲醇反应的能量变化示意图,正确的是
a.
 b.
b.  c.
c.  d.
d.
③工业上用合成得到的甲醇制成微生物燃料电池,结构示意图如图1:

该电池外电路电子的流动方向为
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图2:

①写出X的化学式
②在阳极区发生的反应为:
 =H2O+CO2↑。
=H2O+CO2↑。③简述K2CO3在阴极区再生的原理
您最近一年使用:0次
【推荐2】随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
Ⅰ.以 和
和 为原料合成尿素
为原料合成尿素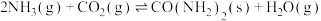
 。
。
(1)有利于提高 平衡转化率的措施是_______(填序号)。
平衡转化率的措施是_______(填序号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图所示:
第一步:

第二步: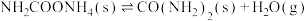


①图中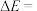
_______ 。
②反应速率较快的是_______ 反应(填“第一步”或“第二步”),理由是_______ 。
Ⅱ.以和催化重整制备合成气: 。
。
(3)在密闭容器中通入物质的量均为0.2mol的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应
 ,
, 的平衡转化率随温度、压强的变化关系如图所示:
的平衡转化率随温度、压强的变化关系如图所示:

①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是_______ (填序号)。
A.容器中混合气体的密度保持不变 B.容器内混合气体的压强保持不变
C.反应速率: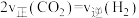 D.同时断裂2mol C―H键和1mol H―H键
D.同时断裂2mol C―H键和1mol H―H键
②由图可知,压强
_______  (填“>”“<”或“=”,下同);Y点速率
(填“>”“<”或“=”,下同);Y点速率
_______  。
。
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则X点对应温度下的
,则X点对应温度下的
_______ (用含 的代数式表示)。
的代数式表示)。
Ⅲ. 微溶于水,在酸性或中性溶液中快速分解产生
微溶于水,在酸性或中性溶液中快速分解产生 ,在碱性溶液中较稳定。一种制备
,在碱性溶液中较稳定。一种制备 的方法如下:
的方法如下:
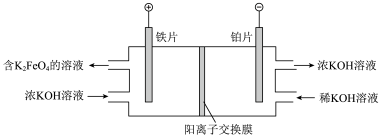
(4)若以铅蓄电池为电源,则铂片应与_______ 极相连(填Pb或 )。
)。
(5)生成 的电极反应式:
的电极反应式:_______ 。
(6)阴极室KOH的浓度提高,结合电极反应式解释原因:_______ 。
Ⅰ.以
 和
和 为原料合成尿素
为原料合成尿素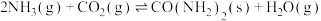
 。
。(1)有利于提高
 平衡转化率的措施是_______(填序号)。
平衡转化率的措施是_______(填序号)。| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图所示:
第一步:


第二步:
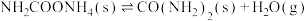


①图中
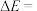
②反应速率较快的是
Ⅱ.以和催化重整制备合成气:
 。
。(3)在密闭容器中通入物质的量均为0.2mol的
 和
和 ,在一定条件下发生反应
,在一定条件下发生反应
 ,
, 的平衡转化率随温度、压强的变化关系如图所示:
的平衡转化率随温度、压强的变化关系如图所示:
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
A.容器中混合气体的密度保持不变 B.容器内混合气体的压强保持不变
C.反应速率:
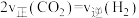 D.同时断裂2mol C―H键和1mol H―H键
D.同时断裂2mol C―H键和1mol H―H键②由图可知,压强

 (填“>”“<”或“=”,下同);Y点速率
(填“>”“<”或“=”,下同);Y点速率
 。
。③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 ,则X点对应温度下的
,则X点对应温度下的
 的代数式表示)。
的代数式表示)。Ⅲ.
 微溶于水,在酸性或中性溶液中快速分解产生
微溶于水,在酸性或中性溶液中快速分解产生 ,在碱性溶液中较稳定。一种制备
,在碱性溶液中较稳定。一种制备 的方法如下:
的方法如下:
(4)若以铅蓄电池为电源,则铂片应与
 )。
)。(5)生成
 的电极反应式:
的电极反应式:(6)阴极室KOH的浓度提高,结合电极反应式解释原因:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】金属铅在工业生产、国防建设和医学诊疗等方面都有着重要的应用,废旧铅蓄电池随意丢弃会造成环境污染,可以按照如图工艺制备高纯 、芒硝
、芒硝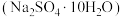 等。
等。
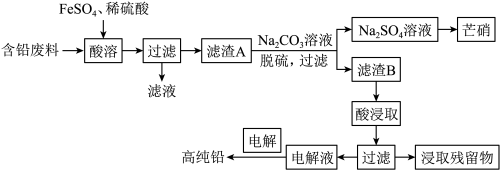
已知:①铅蓄电池的含铅废料主要成分为 、
、 、
、 、
、 。
。
② 是一种无机强酸。
是一种无机强酸。
回答下列问题:
(1)为了加快酸溶的速率,可采取的方法有___________ (写一种即可),酸溶过程中 被
被 还原时发生反应的离子方程式为
还原时发生反应的离子方程式为___________ ,检验酸溶后过滤的滤液中是否有 ,可以选择的试剂为
,可以选择的试剂为___________ (填标号)。
A.酸性高锰酸钾溶液 B.稀硝酸
C. 溶液 D.
溶液 D.
(2)向滤渣 中加入
中加入 溶液实现脱硫,滤渣
溶液实现脱硫,滤渣 为
为___________ (填化学式);滤渣B需要洗涤干净,检验滤渣B洗涤干净的一种方法是取最后一次洗涤液,滴加___________ (填标号),通过现象进行判断。
a.稀盐酸 b.稀硫酸
c.氯化钡溶液 d.氢氧化钠溶液
(3)一般采用 溶液与滤渣
溶液与滤渣 反应,生成
反应,生成 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;以石墨为阳极、高纯铅为阴极,电解 溶液(溶液呈弱酸性,整个过程中
溶液(溶液呈弱酸性,整个过程中 不参与反应)制备铅,阳极的电极反应式为
不参与反应)制备铅,阳极的电极反应式为___________ ,当电路中转移 电子时,阴极理论上增重
电子时,阴极理论上增重___________ g。
 、芒硝
、芒硝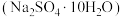 等。
等。
已知:①铅蓄电池的含铅废料主要成分为
 、
、 、
、 、
、 。
。②
 是一种无机强酸。
是一种无机强酸。回答下列问题:
(1)为了加快酸溶的速率,可采取的方法有
 被
被 还原时发生反应的离子方程式为
还原时发生反应的离子方程式为 ,可以选择的试剂为
,可以选择的试剂为A.酸性高锰酸钾溶液 B.稀硝酸
C.
 溶液 D.
溶液 D.
(2)向滤渣
 中加入
中加入 溶液实现脱硫,滤渣
溶液实现脱硫,滤渣 为
为a.稀盐酸 b.稀硫酸
c.氯化钡溶液 d.氢氧化钠溶液
(3)一般采用
 溶液与滤渣
溶液与滤渣 反应,生成
反应,生成 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为 溶液(溶液呈弱酸性,整个过程中
溶液(溶液呈弱酸性,整个过程中 不参与反应)制备铅,阳极的电极反应式为
不参与反应)制备铅,阳极的电极反应式为 电子时,阴极理论上增重
电子时,阴极理论上增重
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】铁、铜等金属及其化合物在生产、生活中用途非常广泛。回答下列问题:
(1) 可用作抗震剂,通过下列反应获得:
可用作抗震剂,通过下列反应获得: 。
。
①基态 原子核外电子排布式为
原子核外电子排布式为________ ,其原子核外未成对电子数为________ 。
②与CO具有相同空间构型和键合形式的阴离子是________ (填化学式),CO分子中σ键与π键数目之比为________ ,C、N、O三种元素第一电离能由小到大的顺序为________ 。
(2)向含 的溶液中滴加少量的
的溶液中滴加少量的 溶液,溶液中生成红色的
溶液,溶液中生成红色的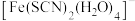 ,中心离子
,中心离子 的配位数为
的配位数为________ ,配体是________ , 分子中O原子的杂化方式为
分子中O原子的杂化方式为________ 。
(3)一种含有Fe、Cu、S三种元素的化合物的晶胞如图所示(晶胞底面为正方形),该化合物的化学式为________ ,若晶胞的底面边长为 ,晶体的密度为
,晶体的密度为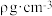 ,阿伏加 德罗常数为
,阿伏加 德罗常数为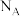 ,该晶胞的高为
,该晶胞的高为________  。
。

(1)
 可用作抗震剂,通过下列反应获得:
可用作抗震剂,通过下列反应获得: 。
。①基态
 原子核外电子排布式为
原子核外电子排布式为②与CO具有相同空间构型和键合形式的阴离子是
(2)向含
 的溶液中滴加少量的
的溶液中滴加少量的 溶液,溶液中生成红色的
溶液,溶液中生成红色的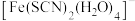 ,中心离子
,中心离子 的配位数为
的配位数为 分子中O原子的杂化方式为
分子中O原子的杂化方式为(3)一种含有Fe、Cu、S三种元素的化合物的晶胞如图所示(晶胞底面为正方形),该化合物的化学式为
 ,晶体的密度为
,晶体的密度为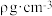 ,阿伏加 德罗常数为
,阿伏加 德罗常数为 ,该晶胞的高为
,该晶胞的高为 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】锌、氮元素形成的化合物在各领域有着重要的作用。
(1)基态Zn2+的价电子排布式为_______________ ;
(2)独立的NH3分子中,H-N-H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H-N-H键键角。
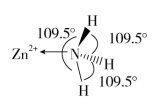
请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是_____________ 。
(3)离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,其结构如图所示:
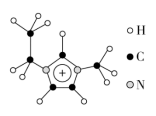
大π键可用符号Π 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________ 。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________ 。
(4)过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律,已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:____________________ 。
(5)Zn与S形成某种化合物的晶胞如图所示。
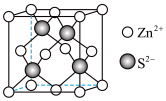
①Zn2+填入S2-组成的________________ 空隙中;
②由①能否判断出S2-、Zn2+相切?_________ (填“能”或“否”);已知晶体密度为dg/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________ pm(写计算表达式)。
(1)基态Zn2+的价电子排布式为
(2)独立的NH3分子中,H-N-H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H-N-H键键角。

请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是
(3)离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,其结构如图所示:

大π键可用符号Π
 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为(4)过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律,已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:
(5)Zn与S形成某种化合物的晶胞如图所示。

①Zn2+填入S2-组成的
②由①能否判断出S2-、Zn2+相切?
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
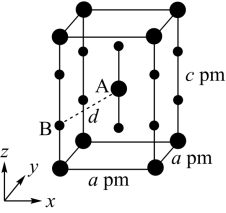
【推荐3】主族元素N、F、Si、As、Se、Cl等的某些化合物对工农业生产意义重大,回答下列问题:
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于_______ 晶体;SiCl4中Si采取的杂化类型为_______ 。
(2)O、F、Cl电负性由大到小的顺序为_______ ;OF2分子的空间构型为_______ ;OF2的熔、沸点低于Cl2O,原因是_______ 。
(3)Se元素基态原子的原子核外电子排布式为_______ ;As的第一电离能比Se的第一电离能大的原因为_______ 。
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_______ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为_______ ;晶胞中A、B间距离d=_______ pm。
(1)Si3N4陶瓷是世界上最坚硬的物质之一,具有高强度、低密度、耐高温等性质,其属于
(2)O、F、Cl电负性由大到小的顺序为
(3)Se元素基态原子的原子核外电子排布式为
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe-F键长为rpm,则B点原子的分数坐标为
)。已知Xe-F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
真题
解题方法
【推荐1】白合金是铜钴矿冶炼过程的中间产物,一种从白合金(主要含 及少量
及少量 )中分离回收金属的流程如下:
)中分离回收金属的流程如下:_________ (任写其中一种),CoO 发生反应的离子方程式_________ 。
(2)“焙烧1”中,晶体[ 和
和 ]总质量随温度升高的变化情况如下:
]总质量随温度升高的变化情况如下:
①升温至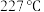 过程中,晶体总质量变小的原因是
过程中,晶体总质量变小的原因是_______ ;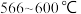 发生分解的物质是
发生分解的物质是_______ (填化学式)。
②为有效分离铁、钴元素,“焙烧1”的温度应控制为_______ ℃。
(3) 时,
时,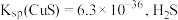 的
的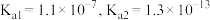 。反应
。反应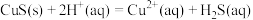 的平衡常数
的平衡常数
_______ (列出计算式即可)。经计算可判断 难溶于稀硫酸。
难溶于稀硫酸。
II.铜的硫化物结构多样。天然硫化铜俗称铜蓝,其晶胞结构如图。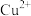 的价电子排布式为
的价电子排布式为_______ 。
(5)晶胞中含有_______ 个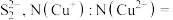
_______ 。晶体中微粒间作用力有_______ (填标号)。
a.氢键 b.离子键 c.共价键 d.金属键
(6)“焙烧2”中 发生反应的化学方程式为
发生反应的化学方程式为_______ ;“滤渣2”是_______ (填化学式)。
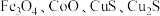 及少量
及少量 )中分离回收金属的流程如下:
)中分离回收金属的流程如下:
(2)“焙烧1”中,晶体[
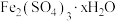 和
和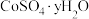 ]总质量随温度升高的变化情况如下:
]总质量随温度升高的变化情况如下:| 温度区间/℃ | 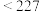 | 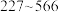 |  |  |
| 晶体总质量 | 变小 | 不变 | 变小 | 不变 |
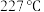 过程中,晶体总质量变小的原因是
过程中,晶体总质量变小的原因是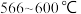 发生分解的物质是
发生分解的物质是②为有效分离铁、钴元素,“焙烧1”的温度应控制为
(3)
 时,
时,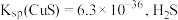 的
的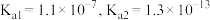 。反应
。反应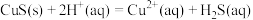 的平衡常数
的平衡常数
 难溶于稀硫酸。
难溶于稀硫酸。II.铜的硫化物结构多样。天然硫化铜俗称铜蓝,其晶胞结构如图。

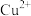 的价电子排布式为
的价电子排布式为(5)晶胞中含有
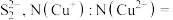
a.氢键 b.离子键 c.共价键 d.金属键
(6)“焙烧2”中
 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】锇酸钾晶体(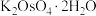 )主要应用于催化烯烃不对称双羟化反应、氨羟化反应等。由锇酸钠废液(主要成分为
)主要应用于催化烯烃不对称双羟化反应、氨羟化反应等。由锇酸钠废液(主要成分为 ,还含少量
,还含少量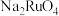 及
及 、
、 杂质)回收锇并制备锇酸钾晶体的工艺流程如下:
杂质)回收锇并制备锇酸钾晶体的工艺流程如下:

已知: 的熔点为40.6℃,沸点为130℃,微溶于水,可溶于四氯化碳等有机溶剂。
的熔点为40.6℃,沸点为130℃,微溶于水,可溶于四氯化碳等有机溶剂。
回答下列问题:
(1)“沉锇”过程得到难溶物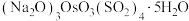 ,该化合物中锇元素的化合价为
,该化合物中锇元素的化合价为_______ 。
(2)检验滤液2中金属阳离子的实验方法是_______ 。
(3)“溶解、蒸馏”步骤中,先加入50%硫酸得到 溶液,再加入
溶液,再加入 溶液,反应后蒸馏出
溶液,反应后蒸馏出 ,生成
,生成 的离子方程式为
的离子方程式为_______ 。
(4) 用NaOH溶液吸收后又得到
用NaOH溶液吸收后又得到 溶液,且吸收液中仍然存在少量
溶液,且吸收液中仍然存在少量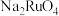 杂质,操作加入甲醇的目的是
杂质,操作加入甲醇的目的是_______ 。
(5)“转化”时须加入过量KOH溶液,试从平衡移动角度分析其原因:_______ 。
(6)25℃时, ,
,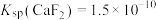 。若
。若 废液中浓度分别
废液中浓度分别 、
、 浓度分别为0.02 mol⋅L
浓度分别为0.02 mol⋅L 和0.01 mol⋅L
和0.01 mol⋅L ,则1.0 L该废液至少需加入
,则1.0 L该废液至少需加入_______ g NaF才能使废液中 、
、 沉淀完全(当离子浓度不大于
沉淀完全(当离子浓度不大于 mol⋅L
mol⋅L 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
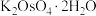 )主要应用于催化烯烃不对称双羟化反应、氨羟化反应等。由锇酸钠废液(主要成分为
)主要应用于催化烯烃不对称双羟化反应、氨羟化反应等。由锇酸钠废液(主要成分为 ,还含少量
,还含少量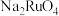 及
及 、
、 杂质)回收锇并制备锇酸钾晶体的工艺流程如下:
杂质)回收锇并制备锇酸钾晶体的工艺流程如下:
已知:
 的熔点为40.6℃,沸点为130℃,微溶于水,可溶于四氯化碳等有机溶剂。
的熔点为40.6℃,沸点为130℃,微溶于水,可溶于四氯化碳等有机溶剂。回答下列问题:
(1)“沉锇”过程得到难溶物
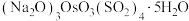 ,该化合物中锇元素的化合价为
,该化合物中锇元素的化合价为(2)检验滤液2中金属阳离子的实验方法是
(3)“溶解、蒸馏”步骤中,先加入50%硫酸得到
 溶液,再加入
溶液,再加入 溶液,反应后蒸馏出
溶液,反应后蒸馏出 ,生成
,生成 的离子方程式为
的离子方程式为(4)
 用NaOH溶液吸收后又得到
用NaOH溶液吸收后又得到 溶液,且吸收液中仍然存在少量
溶液,且吸收液中仍然存在少量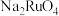 杂质,操作加入甲醇的目的是
杂质,操作加入甲醇的目的是(5)“转化”时须加入过量KOH溶液,试从平衡移动角度分析其原因:
(6)25℃时,
 ,
,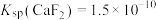 。若
。若 废液中浓度分别
废液中浓度分别 、
、 浓度分别为0.02 mol⋅L
浓度分别为0.02 mol⋅L 和0.01 mol⋅L
和0.01 mol⋅L ,则1.0 L该废液至少需加入
,则1.0 L该废液至少需加入 、
、 沉淀完全(当离子浓度不大于
沉淀完全(当离子浓度不大于 mol⋅L
mol⋅L 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】废旧钴金属片中的钴有+2价和+3价,还含有锰、铁、钙、镁、铝等金属元素及碳粉等,回收钴的工艺流程如下:
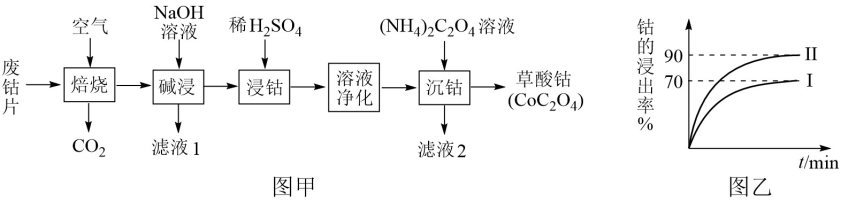
(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是____________________ (任写一条)。
(2)该流程中浸钴时,钴的浸出率最高只能达到70%,后来改进方法,加入使用硫酸进行第一次浸取后,再加入Na2SO3溶液进行第二次浸取,从而使钴的浸出率达90%以上,写出第二次浸出钴时溶液中发生反应的离子方程式:____________________ 。
(3)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液pH为1.5~2.0后,加H2O2,反应一段时间,加8%Na2CO3溶液,将溶液的pH调至4.0~5.0。已知Fe(OH)3的溶度积常数为4×10-38,则当溶液的pH调至4.0时,溶液中的c(Fe3+)=__________ mol·L-1。
②除锰:加入NaClO溶液。写出该离子方程式:____________________ 。
③减钙镁:加入NH4F溶液,沉淀大部分的钙、镁的离子。
试解释为何草酸铵溶液沉钴前要减钙镁:______________________________ 。
(4)滤液2的主要成分为____________________ (以化学式表示)。
(5)得到的草酸钴沉淀须洗涤干燥。写出检验沉淀已被洗净的操作与现象__________ 。

(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是
(2)该流程中浸钴时,钴的浸出率最高只能达到70%,后来改进方法,加入使用硫酸进行第一次浸取后,再加入Na2SO3溶液进行第二次浸取,从而使钴的浸出率达90%以上,写出第二次浸出钴时溶液中发生反应的离子方程式:
(3)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液pH为1.5~2.0后,加H2O2,反应一段时间,加8%Na2CO3溶液,将溶液的pH调至4.0~5.0。已知Fe(OH)3的溶度积常数为4×10-38,则当溶液的pH调至4.0时,溶液中的c(Fe3+)=
②除锰:加入NaClO溶液。写出该离子方程式:
③减钙镁:加入NH4F溶液,沉淀大部分的钙、镁的离子。
| 物质 | MgF2 | CaF2 | CoF2 | MgC2O4 | CaC2O4 | CoC2O4 |
| 溶度积 | 4×10-9 | 5.3×10-9 | 4×10-3 | 5×10-6 | 6.4×10-9 | 1.7×10-7 |
试解释为何草酸铵溶液沉钴前要减钙镁:
(4)滤液2的主要成分为
(5)得到的草酸钴沉淀须洗涤干燥。写出检验沉淀已被洗净的操作与现象
您最近一年使用:0次



