名校
1 . 氮是自然界重要元素之一,氮及其化合物的性质以及氮的循环利用对解决环境和能源问题都具有重要意义。
已知:1 mol物质中的化学键断裂时所需能量如下表。
(1)恒温下,将1 mol空气 和
和 的体积分数分别为0.78和0.21,其余为惰性组分)置于容积为V L的恒容密闭容器中,假设体系中只存在如下两个反应:
的体积分数分别为0.78和0.21,其余为惰性组分)置于容积为V L的恒容密闭容器中,假设体系中只存在如下两个反应:
ⅰ.


ⅱ.

 kJ⋅mol
kJ⋅mol
①
___________ kJ⋅mol 。
。
②以下操作可以降低上述平衡体系中NO浓度的有___________ (填标号)。
A.升高温度 B.移除 C.降低
C.降低 浓度
浓度
③若上述平衡体系中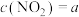 mol⋅L
mol⋅L :
: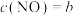 mol⋅L
mol⋅L ,则
,则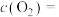
___________ mol⋅L 用含a、b、V的计算式表示)。
用含a、b、V的计算式表示)。
(2) 也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨气。其反应机理如图1(其中
也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨气。其反应机理如图1(其中 和NaCl略去)。NaClO氧化
和NaCl略去)。NaClO氧化 的化学反应程式为
的化学反应程式为___________ 。 对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图2所示,则除氨气过程中最佳的
对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图2所示,则除氨气过程中最佳的 值约为
值约为___________ 。
(4)室温下,用水稀释0.1 mol⋅L 氨水,溶液中随着水量的增加而减小的是___________。
氨水,溶液中随着水量的增加而减小的是___________。
(5)工业上以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:
为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ. 和
和 生成
生成 ;ⅱ.
;ⅱ. 分解生成尿素。
分解生成尿素。
结合反应过程中能量变化图3,下列说法正确的是___________ 。
b.ⅰ为放热反应,ⅱ为吸热反应
c.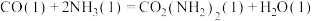

已知:1 mol物质中的化学键断裂时所需能量如下表。
| 物质 |  |  |  |
能量/kJ·mol | 945 | 498 | 631 |
(1)恒温下,将1 mol空气
 和
和 的体积分数分别为0.78和0.21,其余为惰性组分)置于容积为V L的恒容密闭容器中,假设体系中只存在如下两个反应:
的体积分数分别为0.78和0.21,其余为惰性组分)置于容积为V L的恒容密闭容器中,假设体系中只存在如下两个反应:ⅰ.



ⅱ.


 kJ⋅mol
kJ⋅mol
①

 。
。②以下操作可以降低上述平衡体系中NO浓度的有
A.升高温度 B.移除
 C.降低
C.降低 浓度
浓度③若上述平衡体系中
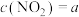 mol⋅L
mol⋅L :
: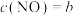 mol⋅L
mol⋅L ,则
,则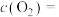
 用含a、b、V的计算式表示)。
用含a、b、V的计算式表示)。(2)
 也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨气。其反应机理如图1(其中
也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨气。其反应机理如图1(其中 和NaCl略去)。NaClO氧化
和NaCl略去)。NaClO氧化 的化学反应程式为
的化学反应程式为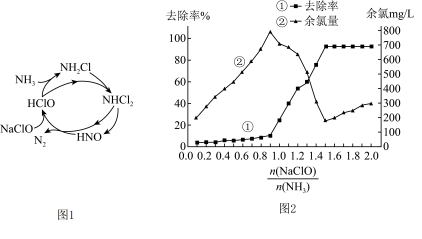
 对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图2所示,则除氨气过程中最佳的
对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图2所示,则除氨气过程中最佳的 值约为
值约为(4)室温下,用水稀释0.1 mol⋅L
 氨水,溶液中随着水量的增加而减小的是___________。
氨水,溶液中随着水量的增加而减小的是___________。A.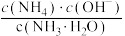 | B. |
C. | D. |
(5)工业上以
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:
为原料在一定温度和压强下合成尿素。反应分两步:ⅰ.
 和
和 生成
生成 ;ⅱ.
;ⅱ. 分解生成尿素。
分解生成尿素。结合反应过程中能量变化图3,下列说法正确的是
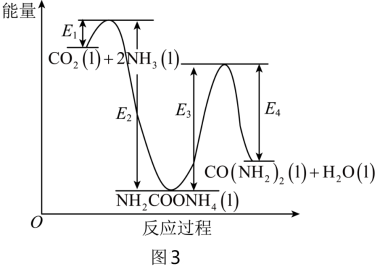
b.ⅰ为放热反应,ⅱ为吸热反应
c.
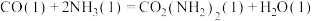

您最近一年使用:0次
解题方法
2 . 某小组以粗铍(含少量的 、
、 、
、 、
、 、
、 等)为原料制备、提纯
等)为原料制备、提纯  ,并测定产品中
,并测定产品中 的含量。
的含量。
Ⅰ.按如图所示装置(夹持装置略)制
已知:①乙醚沸点为34.5℃;溶于乙醚,不溶于苯,易发生水解; 溶于乙醚和苯;
溶于乙醚和苯; 、
、 不溶于乙醚和苯。
不溶于乙醚和苯。
②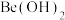 与
与  的化学性质相似。
的化学性质相似。 ,仪器
,仪器 的名称为
的名称为___________ ;装置D的作用是___________ 。
(2)C中发生的主要反应的化学方程式为___________ 。
(3)因反应放热使乙醚挥发,需控制冷凝回流速度1~2滴/秒。若发现回流速度过快,需进行的操作是___________ 。
(4)上述实验装置的缺点是___________ 。
Ⅱ. 提纯
反应后,装置 中
中 的乙醚溶液经过滤、蒸馏出乙醚得固体,用苯溶解固体,充分搅拌后过滤、洗涤、干燥得
的乙醚溶液经过滤、蒸馏出乙醚得固体,用苯溶解固体,充分搅拌后过滤、洗涤、干燥得 产品。
产品。
(5)用苯溶解固体,充分搅拌后过滤,目的是___________ 。
Ⅲ.测定产品中 的含量
的含量
取 产品溶于盐酸配成
产品溶于盐酸配成 溶液;取
溶液;取 溶液,加入
溶液,加入 掩蔽杂质离子,调节,过滤、洗涤,得
掩蔽杂质离子,调节,过滤、洗涤,得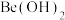 固体,加入
固体,加入 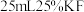 溶液溶解固体,滴加酚酞作指示剂,用
溶液溶解固体,滴加酚酞作指示剂,用 盐酸溶液滴定其中的
盐酸溶液滴定其中的 ,消耗盐酸
,消耗盐酸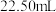 。(已知:
。(已知: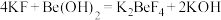 ;滴定过程中
;滴定过程中 、
、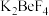 不与盐酸反应)
不与盐酸反应)
(6)调节溶液 时要控制
时要控制 不能过大,其原因为
不能过大,其原因为___________ 。
(7) 的纯度为
的纯度为___________ 。
(8)某同学认为该计算结果不可靠,理由是___________ 。
 、
、 、
、 、
、 、
、 等)为原料制备、提纯
等)为原料制备、提纯  ,并测定产品中
,并测定产品中 的含量。
的含量。Ⅰ.按如图所示装置(夹持装置略)制

已知:①乙醚沸点为34.5℃;溶于乙醚,不溶于苯,易发生水解;
 溶于乙醚和苯;
溶于乙醚和苯; 、
、 不溶于乙醚和苯。
不溶于乙醚和苯。②
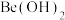 与
与  的化学性质相似。
的化学性质相似。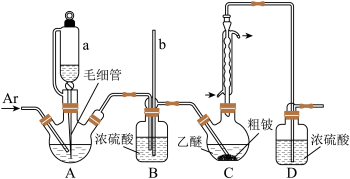
 ,仪器
,仪器 的名称为
的名称为(2)C中发生的主要反应的化学方程式为
(3)因反应放热使乙醚挥发,需控制冷凝回流速度1~2滴/秒。若发现回流速度过快,需进行的操作是
(4)上述实验装置的缺点是
Ⅱ. 提纯

反应后,装置
 中
中 的乙醚溶液经过滤、蒸馏出乙醚得固体,用苯溶解固体,充分搅拌后过滤、洗涤、干燥得
的乙醚溶液经过滤、蒸馏出乙醚得固体,用苯溶解固体,充分搅拌后过滤、洗涤、干燥得 产品。
产品。(5)用苯溶解固体,充分搅拌后过滤,目的是
Ⅲ.测定产品中
 的含量
的含量取
 产品溶于盐酸配成
产品溶于盐酸配成 溶液;取
溶液;取 溶液,加入
溶液,加入 掩蔽杂质离子,调节,过滤、洗涤,得
掩蔽杂质离子,调节,过滤、洗涤,得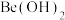 固体,加入
固体,加入 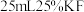 溶液溶解固体,滴加酚酞作指示剂,用
溶液溶解固体,滴加酚酞作指示剂,用 盐酸溶液滴定其中的
盐酸溶液滴定其中的 ,消耗盐酸
,消耗盐酸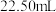 。(已知:
。(已知: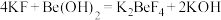 ;滴定过程中
;滴定过程中 、
、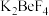 不与盐酸反应)
不与盐酸反应)(6)调节溶液
 时要控制
时要控制 不能过大,其原因为
不能过大,其原因为(7)
 的纯度为
的纯度为(8)某同学认为该计算结果不可靠,理由是
您最近一年使用:0次
解题方法
3 . 以硫铁矿(主要成分为 )为原料制备氯化铁晶体(
)为原料制备氯化铁晶体( )的工艺流程如下图所示。
)的工艺流程如下图所示。
(1)需将硫铁矿粉碎再“焙烧”的目的是_______ 。
(2)硫铁矿“焙烧”后的烧渣中含有 、
、 等,“酸溶”时不能用硫酸代替盐酸的原因是
等,“酸溶”时不能用硫酸代替盐酸的原因是_______ 。
(3)“操作I”的名称为_______ 。
(4)“氧化”过程中主要发生反应的离子方程式为_______ , 的电子式为
的电子式为_______ 。
(5)实验室常用 配制
配制 溶液,写出正确的配制方法:
溶液,写出正确的配制方法:_______ 。
(6)尾气主要含 、
、 、
、 和少量的
和少量的 、
、 ,为测定其中
,为测定其中 的含量,某同学将VL尾气缓慢通入装置A中。
的含量,某同学将VL尾气缓慢通入装置A中。_______ ,该装置的作用是_______ 。
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量 的含量,写出该方案合理与否的理由:
的含量,写出该方案合理与否的理由:_______ 。
 )为原料制备氯化铁晶体(
)为原料制备氯化铁晶体( )的工艺流程如下图所示。
)的工艺流程如下图所示。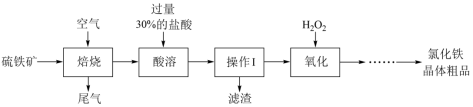
(1)需将硫铁矿粉碎再“焙烧”的目的是
(2)硫铁矿“焙烧”后的烧渣中含有
 、
、 等,“酸溶”时不能用硫酸代替盐酸的原因是
等,“酸溶”时不能用硫酸代替盐酸的原因是(3)“操作I”的名称为
(4)“氧化”过程中主要发生反应的离子方程式为
 的电子式为
的电子式为(5)实验室常用
 配制
配制 溶液,写出正确的配制方法:
溶液,写出正确的配制方法:(6)尾气主要含
 、
、 、
、 和少量的
和少量的 、
、 ,为测定其中
,为测定其中 的含量,某同学将VL尾气缓慢通入装置A中。
的含量,某同学将VL尾气缓慢通入装置A中。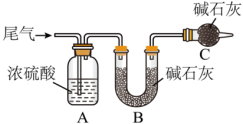
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量
 的含量,写出该方案合理与否的理由:
的含量,写出该方案合理与否的理由:
您最近一年使用:0次
2024·贵州贵阳·一模
名校
4 . 下列离子方程式书写正确的是
A.用高锰酸钾溶液滴定草酸: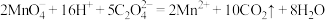 |
B.电解饱和食盐水: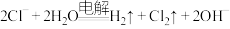 |
C.向 溶液中加入足量稀硝酸: 溶液中加入足量稀硝酸: |
D.将足量 通入 通入 溶液中: 溶液中: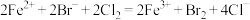 |
您最近一年使用:0次
名校
5 . 对于下列实验,能正确描述其反应的离子方程式是
A.用 溶液吸收少量Cl2: 溶液吸收少量Cl2: |
B.向 溶液中滴入酸化的 溶液中滴入酸化的 溶液产生白色沉淀: 溶液产生白色沉淀: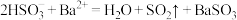 |
C.向 溶液中滴加少量 溶液中滴加少量 : :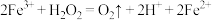 |
D. 检测酒驾的反应原理: 检测酒驾的反应原理: |
您最近一年使用:0次
6 . 钪( )是一种功能强大的稀土金属,广泛用于航天、激光、导弹等尖端科学领域。钛铁矿主要成分为钛酸亚铁
)是一种功能强大的稀土金属,广泛用于航天、激光、导弹等尖端科学领域。钛铁矿主要成分为钛酸亚铁 ,还含有少量
,还含有少量 、
、 、
、 等杂质,从钛铁矿中提取
等杂质,从钛铁矿中提取 的流程如下图:
的流程如下图:
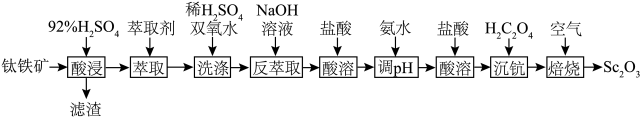
回答下列问题:
(1)“滤渣”的主要成分是
(2)“酸浸”后,钛主要以
 的形式存在于溶液中,
的形式存在于溶液中, 在一定条件下可完全水解生成
在一定条件下可完全水解生成 ,写出
,写出 水解的离子方程式:
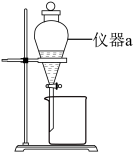
水解的离子方程式:(3)实验室萃取装置如下图所示,仪器a的名称为
(4)25℃时“调
 ”先加氨水调节
”先加氨水调节 ,过滤除去
,过滤除去 。再向滤液中加入氨水调节
。再向滤液中加入氨水调节 ,已知
,已知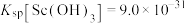 ,此时滤液中
,此时滤液中 的浓度为
的浓度为 。写出检验含
。写出检验含 滤液中是否含
滤液中是否含 的方法:
的方法:(5)“沉钪”时用到草酸,已知草酸的
 ;
;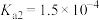 ,则在25℃时,
,则在25℃时, 的草酸溶液中
的草酸溶液中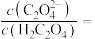
(6)
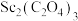 在空气中“焙烧”时生成
在空气中“焙烧”时生成 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
解题方法
7 . 下列指定反应的离子方程式书写正确的是
A.将 溶液滴入 溶液滴入 溶液中: 溶液中: |
B. 溶液中通入过量的 溶液中通入过量的 : :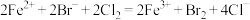 |
C.用铜作电极电解饱和食盐水: |
D.碳酸氢铵溶液中加入足量石灰水: |
您最近一年使用:0次
名校
解题方法
8 . 烟气中常含有大量SO2和H2S等大气污染物,需经过净化处理后才能排放。
(1)除去燃煤产生的废气中的SO2的过程如图所示。

①过程I是 发生催化氧化反应,若参加反应
发生催化氧化反应,若参加反应 和
和 的体积比为4:3,则反应的化学方程式为
的体积比为4:3,则反应的化学方程式为_________ 。
②过程Ⅱ利用电化学装置吸收另一部分 ,使得Cu再生,该过程中阳极的电极反应式为
,使得Cu再生,该过程中阳极的电极反应式为____________ 。若此过程中除去 体积分数为0.5%的废气2240L(标准状况),可使
体积分数为0.5%的废气2240L(标准状况),可使________ g Cu再生。
(2)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺为:

① 时,I中为
时,I中为_________ 溶液(写化学式)。
②工艺中加入 固体,并再次充入
固体,并再次充入 的目的是
的目的是______________ 。
(3)较普遍采用H2S处理方法为克劳斯工艺,反应原理可表示为: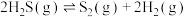 。在1470K、100kPa反应条件下,将
。在1470K、100kPa反应条件下,将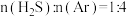 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为___________ ,平衡常数
___________ kPa。
(1)除去燃煤产生的废气中的SO2的过程如图所示。

①过程I是
 发生催化氧化反应,若参加反应
发生催化氧化反应,若参加反应 和
和 的体积比为4:3,则反应的化学方程式为
的体积比为4:3,则反应的化学方程式为②过程Ⅱ利用电化学装置吸收另一部分
 ,使得Cu再生,该过程中阳极的电极反应式为
,使得Cu再生,该过程中阳极的电极反应式为 体积分数为0.5%的废气2240L(标准状况),可使
体积分数为0.5%的废气2240L(标准状况),可使(2)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺为:

①
 时,I中为
时,I中为②工艺中加入
 固体,并再次充入
固体,并再次充入 的目的是
的目的是(3)较普遍采用H2S处理方法为克劳斯工艺,反应原理可表示为:
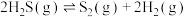 。在1470K、100kPa反应条件下,将
。在1470K、100kPa反应条件下,将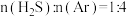 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为
您最近一年使用:0次
解题方法
9 . Cr、Fe、Co、Ni、Zn等金属元素的合金及其相关化合物用途非常广泛。
(1)Cr元素在周期表中的位置______ ;其原子核外未成对电子数为______ 。
(2)FeSO4可用作污水处理的混凝剂,硫元素的原子核外有______ 种不同能量的电子, 的空间构型为
的空间构型为______ 。
(3)Co、Ni两种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为______ 。(用化学式表示)
(4) 是铬(Ⅲ)的一种配合物,1mol
是铬(Ⅲ)的一种配合物,1mol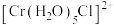 中含有
中含有 键的数目为
键的数目为______ 。
(5)+6价铬的化合物毒性较大,常用 将酸性废液中的
将酸性废液中的 还原成
还原成 ,该反应的离子方程式为
,该反应的离子方程式为______ 。
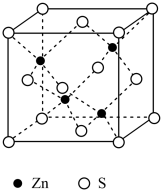
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有______ 个。晶胞棱长为a pm,密度为______  (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)Cr元素在周期表中的位置
(2)FeSO4可用作污水处理的混凝剂,硫元素的原子核外有
 的空间构型为
的空间构型为(3)Co、Ni两种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为
(4)
 是铬(Ⅲ)的一种配合物,1mol
是铬(Ⅲ)的一种配合物,1mol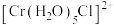 中含有
中含有 键的数目为
键的数目为(5)+6价铬的化合物毒性较大,常用
 将酸性废液中的
将酸性废液中的 还原成
还原成 ,该反应的离子方程式为
,该反应的离子方程式为(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有
 (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
名校
10 . I.已知氯化钠的晶胞如图所示。

(1)下列关于氯化钠的说法正确的是_____ 。
(2)已知NaCl的密度为ρg•cm-3,NaCl的摩尔质量为Mg/mol,阿佛加德罗常数的值为NA,则在NaCl晶体里Na+和Cl-的最短距离为_____ pm。
Ⅱ.过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。
已知:H2O2(l) H+(aq)+
H+(aq)+ (aq) K=2.24×10-12(25℃)
(aq) K=2.24×10-12(25℃)
完成下列填空:
(3)氧原子核外电子能级数为_____ ,H2O2的电子式_____ 。
对H2O2分子结构,有以下两种推测:
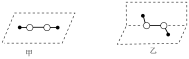
要确定H2O2分子结构,需要测定H2O2分子中的_____ 。(选填序号)
a.H-O键长 b.O-O键长 c.H-O-O键角 d.H-O、O-O键能
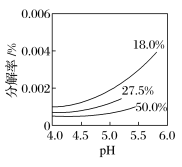
(4)25℃,pH(H2O2)_____ pH(H2O)(选填“>”、“<”或“=”)。研究表明,H2O2溶液中HO 浓度越大,H2O2的分解速率越快。某温度下,经过相同时间,不同浓度H2O2分解率与pH的关系如图所示。一定浓度的H2O2,pH增大H2O2分解率增大的原因是
浓度越大,H2O2的分解速率越快。某温度下,经过相同时间,不同浓度H2O2分解率与pH的关系如图所示。一定浓度的H2O2,pH增大H2O2分解率增大的原因是_____ 。相同pH下,H2O2浓度越大H2O2分解率越低的原因是_____ 。
(5)蓝色的CrO5遇H2O2会褪色,此反应可用于检验H2O2,配平下列方程式:_____ 。
_____CrO5+_____H2O2+_____H+=_____Cr3++_____O2↑+_____H2O。

(1)下列关于氯化钠的说法正确的是
| A.基态Na+的电子有5种空间运动状态 |
| B.钠是第一电离能最大的碱金属元素 |
| C.氯原子的价电子排布式可写成[Ne]3s23p5 |
| D.每个氯离子周围与它最近且等距的氯离子有12个 |
Ⅱ.过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。
已知:H2O2(l)
 H+(aq)+
H+(aq)+ (aq) K=2.24×10-12(25℃)
(aq) K=2.24×10-12(25℃)完成下列填空:
(3)氧原子核外电子能级数为
对H2O2分子结构,有以下两种推测:
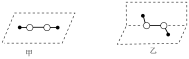
要确定H2O2分子结构,需要测定H2O2分子中的
a.H-O键长 b.O-O键长 c.H-O-O键角 d.H-O、O-O键能
(4)25℃,pH(H2O2)
 浓度越大,H2O2的分解速率越快。某温度下,经过相同时间,不同浓度H2O2分解率与pH的关系如图所示。一定浓度的H2O2,pH增大H2O2分解率增大的原因是
浓度越大,H2O2的分解速率越快。某温度下,经过相同时间,不同浓度H2O2分解率与pH的关系如图所示。一定浓度的H2O2,pH增大H2O2分解率增大的原因是
(5)蓝色的CrO5遇H2O2会褪色,此反应可用于检验H2O2,配平下列方程式:
_____CrO5+_____H2O2+_____H+=_____Cr3++_____O2↑+_____H2O。
您最近一年使用:0次



