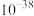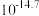名校
解题方法
1 . 宏观辨识与微观探析是化学学科核心素养之一、下列反应方程式书写正确的是
A.将少量 通入 通入 溶液中: 溶液中: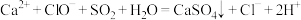 |
B.向甲醛溶液中加入足量的银氨溶液并加热: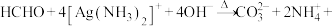  |
C.向摩尔盐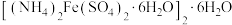 溶液中加入NaOH溶液至 溶液中加入NaOH溶液至 刚好反应完全: 刚好反应完全: |
D.往酸性 溶液中加入难溶于水的 溶液中加入难溶于水的 固体,溶液出现紫红色: 固体,溶液出现紫红色: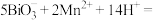 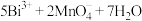 |
您最近一年使用:0次
昨日更新
|
171次组卷
|
3卷引用:辽宁省凌源市2024届高三下学期第三次模拟考试化学试卷
解题方法
2 . 金属钼在工业和国防建设中有重要的作用,其化合物钼酸钠晶体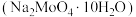 可制造金属缓释剂。由钼精矿(主要成分为
可制造金属缓释剂。由钼精矿(主要成分为 ,含有少量不反应的杂质)制备钼及钼酸钠晶体的工艺流程如图所示,回答下列问题:
,含有少量不反应的杂质)制备钼及钼酸钠晶体的工艺流程如图所示,回答下列问题:____________ 。
(2)焙烧过程中采用“多层逆流(空气从炉底进入,钼精矿经粉碎后从炉顶进入)焙烧”,下图为焙烧时各炉层固体物料的物质的量百分数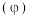 。
。____________ ;“多层逆流焙烧”的优点是_______________ ;
②某些生产工艺在焙烧时加入碳酸钙会更环保,其原因是________ (用化学方程式表示);
(3)碱浸时发生反应的离子方程式为_____________________ ;
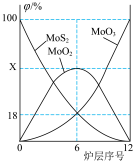
(4)已知钼酸钠的溶解度曲线如图所示,要获得钼酸钠晶体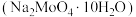 的操作2为
的操作2为________ 、_________ 、过滤、洗涤、干燥; 生成,用固体
生成,用固体 除去.在除
除去.在除 前测定碱浸液中
前测定碱浸液中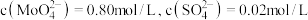 ,当
,当 开始沉淀时,
开始沉淀时, 的去除率为
的去除率为_____ %(保留整数)[已知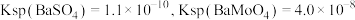 ,溶液体积变化忽略不计]。
,溶液体积变化忽略不计]。
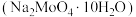 可制造金属缓释剂。由钼精矿(主要成分为
可制造金属缓释剂。由钼精矿(主要成分为 ,含有少量不反应的杂质)制备钼及钼酸钠晶体的工艺流程如图所示,回答下列问题:
,含有少量不反应的杂质)制备钼及钼酸钠晶体的工艺流程如图所示,回答下列问题: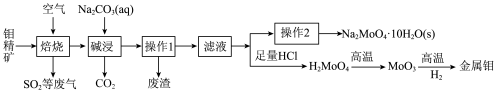
(2)焙烧过程中采用“多层逆流(空气从炉底进入,钼精矿经粉碎后从炉顶进入)焙烧”,下图为焙烧时各炉层固体物料的物质的量百分数
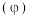 。
。
②某些生产工艺在焙烧时加入碳酸钙会更环保,其原因是
(3)碱浸时发生反应的离子方程式为
(4)已知钼酸钠的溶解度曲线如图所示,要获得钼酸钠晶体
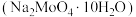 的操作2为
的操作2为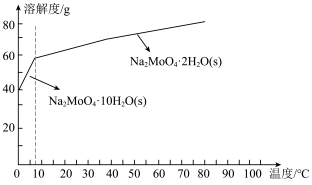
 生成,用固体
生成,用固体 除去.在除
除去.在除 前测定碱浸液中
前测定碱浸液中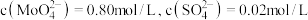 ,当
,当 开始沉淀时,
开始沉淀时, 的去除率为
的去除率为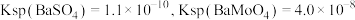 ,溶液体积变化忽略不计]。
,溶液体积变化忽略不计]。
您最近一年使用:0次
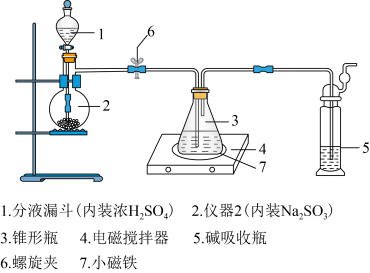
3 . 硫代硫酸钠被广泛用于纺织、造纸、化学合成等工业领域。制备硫代硫酸钠的装置如下图所示。
1.将浓硫酸缓缓注入仪器2中,适当调节螺旋夹6,使反应产生的气体均匀地进入锥形瓶中(硫化钠—碳酸钠溶液),并采用电磁搅拌器进行搅拌和加热。
2.持续通入气体,直至溶液的pH=7(注意不要小于7),停止通入气体。
3.将锥形瓶中的液体转移至烧杯中,________,过滤,得到 晶体样品。
晶体样品。
4.精确称取0.5000g步骤3的样品,用少量水溶解,再注入10mL醋酸-醋酸钠的缓冲溶液。以淀粉为指示剂,用0.1000mol/L的碘标准溶液滴定至终点,消耗标准溶液的体积为VmL。
已知:
请回答下列问题:
(1)仪器2的名称是________ 。
(2)写出生成硫代硫酸钠总反应的化学方程式________ 。
(3)补齐步骤3的实验操作________ 。
(4)用必要的文字说明为什么溶液的pH不能小于7________ 。
(5)①滴定时,应使用________ (填“酸式”或“碱式”)滴定管。
②滴定达到终点的标志是________ 。
③ 晶体的质量分数为
晶体的质量分数为________ (用含有V的代数式表示)。
④下列说法错误的是________ 。
a.滴定读数时,应单手持滴定管上端并保持其自然垂直
b.滴定实验中用到的玻璃仪器是烧杯、锥形瓶、滴定管
c.滴定前滴定管尖嘴处有气泡,导致实验结果偏低
d.用标准液润洗滴定管后,应将润洗液从滴定管上口倒出
1.将浓硫酸缓缓注入仪器2中,适当调节螺旋夹6,使反应产生的气体均匀地进入锥形瓶中(硫化钠—碳酸钠溶液),并采用电磁搅拌器进行搅拌和加热。
2.持续通入气体,直至溶液的pH=7(注意不要小于7),停止通入气体。
3.将锥形瓶中的液体转移至烧杯中,________,过滤,得到
 晶体样品。
晶体样品。4.精确称取0.5000g步骤3的样品,用少量水溶解,再注入10mL醋酸-醋酸钠的缓冲溶液。以淀粉为指示剂,用0.1000mol/L的碘标准溶液滴定至终点,消耗标准溶液的体积为VmL。
已知:

请回答下列问题:
(1)仪器2的名称是
(2)写出生成硫代硫酸钠总反应的化学方程式
(3)补齐步骤3的实验操作
(4)用必要的文字说明为什么溶液的pH不能小于7
(5)①滴定时,应使用
②滴定达到终点的标志是
③
 晶体的质量分数为
晶体的质量分数为④下列说法错误的是
a.滴定读数时,应单手持滴定管上端并保持其自然垂直
b.滴定实验中用到的玻璃仪器是烧杯、锥形瓶、滴定管
c.滴定前滴定管尖嘴处有气泡,导致实验结果偏低
d.用标准液润洗滴定管后,应将润洗液从滴定管上口倒出
您最近一年使用:0次
解题方法
4 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 、
、 )实现镍、钴、镁元素的回收。
)实现镍、钴、镁元素的回收。 )的电离第一步完全,第二步微弱。
)的电离第一步完全,第二步微弱。
2.25℃时,相关物质的 如下:
如下:
回答下列问题:
(1)Ni属于元素周期表的________ 区。
(2)混合气在“氧化”中,产生 ,其中S的化合价为
,其中S的化合价为________ 。
(3)“滤渣”的成分之一是软锰矿的主要成分,由 氧化产生,该反应的离子方程式为
氧化产生,该反应的离子方程式为________ ;其可用于实验室制取氯气,该反应的离子方程式为________ 。
(4)若使 沉淀完全(浓度
沉淀完全(浓度 ),需调节pH不低于
),需调节pH不低于________ 。
(5)上述表格中a________ b(填“大于”、“小于”或“无法确定”)。
(6)“沉钴镍”后需将钴镍渣洗涤干净,实验室检验其是否洗净的方法是________ 。
(7)滤液2中含有的金属阳离子是________ 。
 、
、 、
、 、
、 、
、 、
、 )实现镍、钴、镁元素的回收。
)实现镍、钴、镁元素的回收。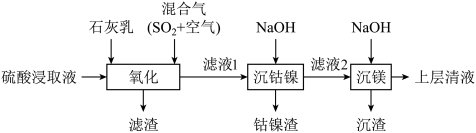
 )的电离第一步完全,第二步微弱。
)的电离第一步完全,第二步微弱。2.25℃时,相关物质的
 如下:
如下:物质 |
|
|
|
|
|
|
| a | b |
(1)Ni属于元素周期表的
(2)混合气在“氧化”中,产生
 ,其中S的化合价为
,其中S的化合价为(3)“滤渣”的成分之一是软锰矿的主要成分,由
 氧化产生,该反应的离子方程式为
氧化产生,该反应的离子方程式为(4)若使
 沉淀完全(浓度
沉淀完全(浓度 ),需调节pH不低于
),需调节pH不低于(5)上述表格中a
(6)“沉钴镍”后需将钴镍渣洗涤干净,实验室检验其是否洗净的方法是
(7)滤液2中含有的金属阳离子是
您最近一年使用:0次
名校
解题方法
5 . 铱(77Ir)和锇(76Os)属于铂族金属,与金、银合称贵重金属,可以用于电气、精密仪表、催化剂等领域。铱锇矿的主要成分有Ir、Os、Ir2O3、OsO2,还含有CuO和SiO2等杂质,从铱锇矿中提取铱和锇的流程如下:
回答下列问题:
(1)“酸溶I”的目的是___________ ;酸溶I后溶渣的主要成分除Ir、Os外,还有___________ (填化学式)。
(2)“氧化挥发”是将溶渣置于300~800℃的管式炉内,通入空气氧化。再用NaOH溶液吸收OsO4生成Na2OsO4,该反应的离子方程式为___________ 。
(3)“沉锇”时,NH4Cl与Na2OsO4发生反应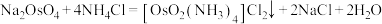 ,生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的优点是
,生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的优点是___________ 。
(4)“碱熔”时,“残渣I”中的Ir与Na2O2反应生成IrO2·nNa2O和O2,该反应的化学方程式为___________ 。
(5)“沉铜”过程中,当通入H2S达到饱和时测得溶液的pH=1,此时溶液中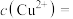
___________ mol/L。[已知:25℃,H2S溶于水形成饱和溶液时, ;H2S的电离常数
;H2S的电离常数 ,
,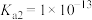 ;
;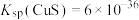 ]
]
(6)化合物 IrO2的四方晶格结构如图所示,其棱边夹角均为90°。已知IrO2晶体密度为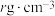 ,设NA为阿伏加德罗常数的值,则IrO2的摩尔质量为
,设NA为阿伏加德罗常数的值,则IrO2的摩尔质量为___________ (用代数式表示)g/mol。
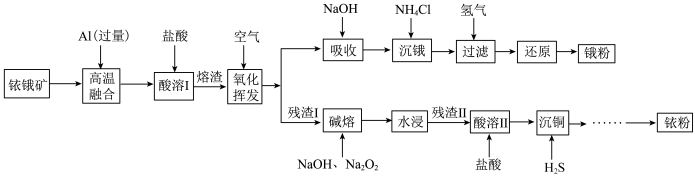
回答下列问题:
(1)“酸溶I”的目的是
(2)“氧化挥发”是将溶渣置于300~800℃的管式炉内,通入空气氧化。再用NaOH溶液吸收OsO4生成Na2OsO4,该反应的离子方程式为
(3)“沉锇”时,NH4Cl与Na2OsO4发生反应
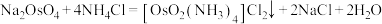 ,生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的优点是
,生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的优点是(4)“碱熔”时,“残渣I”中的Ir与Na2O2反应生成IrO2·nNa2O和O2,该反应的化学方程式为
(5)“沉铜”过程中,当通入H2S达到饱和时测得溶液的pH=1,此时溶液中
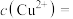
 ;H2S的电离常数
;H2S的电离常数 ,
,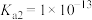 ;
;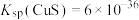 ]
](6)化合物 IrO2的四方晶格结构如图所示,其棱边夹角均为90°。已知IrO2晶体密度为
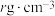 ,设NA为阿伏加德罗常数的值,则IrO2的摩尔质量为
,设NA为阿伏加德罗常数的值,则IrO2的摩尔质量为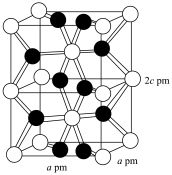
您最近一年使用:0次
7日内更新
|
178次组卷
|
3卷引用:辽宁省协作校2023-2024学年高三下学期三模化学试题
解题方法
6 . 下列有关生产、生活应用中,所对应的离子方程式书写正确的是
A.用硝酸银与氨水制备银氨溶液: |
B.用 除去废水中的 除去废水中的 |
C.用酸性 溶液验证 溶液验证 的还原性: 的还原性: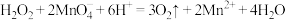 |
D.用 检验久置 检验久置 溶液中的 溶液中的 : :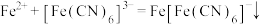 |
您最近一年使用:0次
解题方法
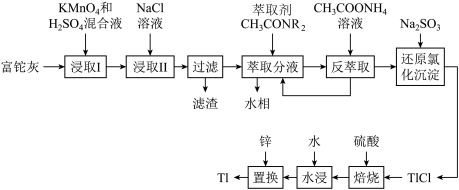
7 . 铊(Tl)广泛应用于电子、军工、航天等领域。一种从铅精矿焙烧产生的富铊灰(主要成分为PbO、ZnO、FeO、Fe2O3、Tl2O)中回收铊的工艺流程如图所示:
①Tl+易被氧化为Tl3+
②在氯化物-硫酸水溶液中,Tl元素以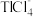 形式存在
形式存在
③萃取过程的反应原理为:H++CH3CONR2+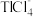
 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4
④常温下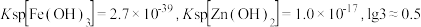
请回答下列问题:
(1)铊(81Tl)与铝同主族,基态 原子的价电子轨道表示式为
原子的价电子轨道表示式为________ 。
(2)“浸取Ⅰ”中Tl2O发生反应的化学方程式为________ 。
(3)滤渣的主要成分为________ 。
(4)常温下,向“萃取分液”后的水相中加入NaOH溶液,调pH回收铁。已知水相中c(Zn2+)=0.1mol/L,控制pH范围为_______ (已知当溶液中离子浓度小于10-5mol/L时,通常认为该离子沉淀完全,结果保留一位小数)。
(5)请从化学平衡的角度解释“反萃取”过程中加入CH3COONH4溶液的原因________ 。
(6)“还原氯化沉淀”中反应的离子方程式为_______ 。
(7)铊镉合金是原子能工业重要材料,其一种立方晶胞结构如图所示,已知该铊镉合金密度为 ,设
,设 为阿伏加德罗常数的值,则铊原子和镉原子之间的最短距离d=
为阿伏加德罗常数的值,则铊原子和镉原子之间的最短距离d=_____ nm(用含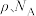 的代数式表示)。
的代数式表示)。
①Tl+易被氧化为Tl3+
②在氯化物-硫酸水溶液中,Tl元素以
 形式存在
形式存在③萃取过程的反应原理为:H++CH3CONR2+
 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4 ④常温下
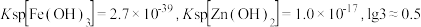
请回答下列问题:
(1)铊(81Tl)与铝同主族,基态
 原子的价电子轨道表示式为
原子的价电子轨道表示式为(2)“浸取Ⅰ”中Tl2O发生反应的化学方程式为
(3)滤渣的主要成分为
(4)常温下,向“萃取分液”后的水相中加入NaOH溶液,调pH回收铁。已知水相中c(Zn2+)=0.1mol/L,控制pH范围为
(5)请从化学平衡的角度解释“反萃取”过程中加入CH3COONH4溶液的原因
(6)“还原氯化沉淀”中反应的离子方程式为
(7)铊镉合金是原子能工业重要材料,其一种立方晶胞结构如图所示,已知该铊镉合金密度为
 ,设
,设 为阿伏加德罗常数的值,则铊原子和镉原子之间的最短距离d=
为阿伏加德罗常数的值,则铊原子和镉原子之间的最短距离d=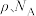 的代数式表示)。
的代数式表示)。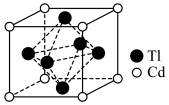
您最近一年使用:0次
8 . 公元前200年左右中国就开始使用镍。镍主要用于合金及用作催化剂,也可用来制造货币。以镍废渣(主要成分为Ni,还含有 、NiO、FeO、CaO和
、NiO、FeO、CaO和 )为原料制备纯镍的流程如图,回答下列问题:
)为原料制备纯镍的流程如图,回答下列问题:______ (填化学式)。常温下,“酸浸”中硫酸浓度与镍浸出率的关系如图所示。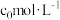 后,镍浸出率降低的可能原因是
后,镍浸出率降低的可能原因是____________ 。
(2)“氧化”时双氧水的作用是____________ (用离子方程式表示)。
(3)“沉铝”时NiO的作用是_______ ,“操作X”包括蒸发浓缩、______ 、过滤、洗涤。
(4) 在隔绝空气条件下的热失重曲线如下图2所示。a→b过程中失去的物质是
在隔绝空气条件下的热失重曲线如下图2所示。a→b过程中失去的物质是______ (填化学式,下同),c点对应的氧化物为______ 。 代表阿伏加德罗常数的值。该晶胞中Ni、Nb个数之比为
代表阿伏加德罗常数的值。该晶胞中Ni、Nb个数之比为____ ,该晶体的密度为___ (填表达式)g·cm 。
。
 、NiO、FeO、CaO和
、NiO、FeO、CaO和 )为原料制备纯镍的流程如图,回答下列问题:
)为原料制备纯镍的流程如图,回答下列问题: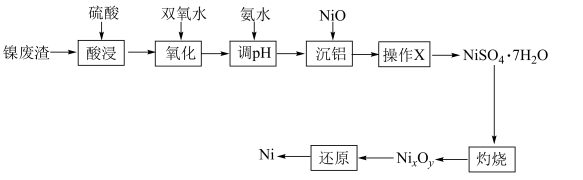
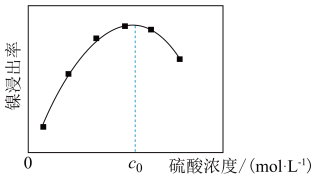
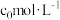 后,镍浸出率降低的可能原因是
后,镍浸出率降低的可能原因是(2)“氧化”时双氧水的作用是
(3)“沉铝”时NiO的作用是
(4)
 在隔绝空气条件下的热失重曲线如下图2所示。a→b过程中失去的物质是
在隔绝空气条件下的热失重曲线如下图2所示。a→b过程中失去的物质是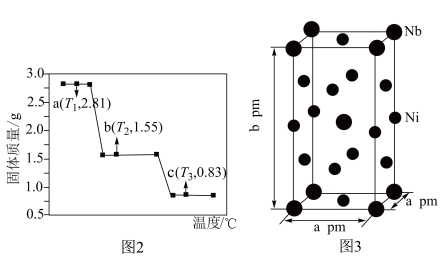
 代表阿伏加德罗常数的值。该晶胞中Ni、Nb个数之比为
代表阿伏加德罗常数的值。该晶胞中Ni、Nb个数之比为 。
。
您最近一年使用:0次
2024-05-06更新
|
657次组卷
|
3卷引用:2024届辽宁省抚顺市六校协作体高三下学期第三次模拟化学试卷
9 . 碲被誉为金属性最强的非金属,某科研小组从碲渣(主要含有Cu2Te )中提取粗碲的工艺流程如图所示。下列有关说法错误的是
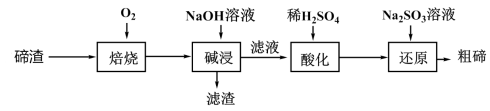
| A.“焙烧”后铜以Cu2O形式存在 |
| B.“碱浸”后过滤用到的主要仪器有:烧杯、漏斗、玻璃棒 |
| C.“酸化”后生成Te(SO4)2 |
| D.“还原”后,溶液的酸性减弱 |
您最近一年使用:0次
名校
解题方法
10 . 工业上一种利用废旧三元锂离子电池正极材料(主要成分为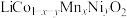 ,还含有铝箔、炭黑、有机粘合剂等)综合回收钴、锰、镍、锂的工艺流程如下图所示:
,还含有铝箔、炭黑、有机粘合剂等)综合回收钴、锰、镍、锂的工艺流程如下图所示: 的基本结构单元如图所示,则据此计算
的基本结构单元如图所示,则据此计算
___________ ,
___________ 。___________ 。
(3)“碱浸”后滤液中大量存在的阴离子为___________ 和___________ 。
(4)已知: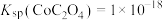 ,
,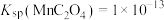 ,
,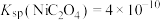 。若“酸浸”后溶液中
。若“酸浸”后溶液中 、
、 、
、 浓度均为0.1mol/L,理论计算欲使
浓度均为0.1mol/L,理论计算欲使 完全沉淀(离子浓度小于
完全沉淀(离子浓度小于 )而不沉淀
)而不沉淀 、
、 ,需调节
,需调节___________ mol/L<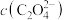 <
<___________ mol/L;实际“沉钴”时,在加入 之后
之后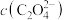 往往超出上述范围,因而须先加入一定量氨水,推测所加氨水的作用为
往往超出上述范围,因而须先加入一定量氨水,推测所加氨水的作用为___________ 。
(5)“沉锰”过程中加入 溶液后,溶液先变为紫红色,一段时间后紫红色又褪去,则溶液变为紫红色的原因为
溶液后,溶液先变为紫红色,一段时间后紫红色又褪去,则溶液变为紫红色的原因为___________ 。[用离子方程式表示,Mn(Ⅱ)写作 即可]。
即可]。
(6)“沉镍”过程中加入 溶液不能过量,原因为
溶液不能过量,原因为___________ 。
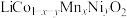 ,还含有铝箔、炭黑、有机粘合剂等)综合回收钴、锰、镍、锂的工艺流程如下图所示:
,还含有铝箔、炭黑、有机粘合剂等)综合回收钴、锰、镍、锂的工艺流程如下图所示: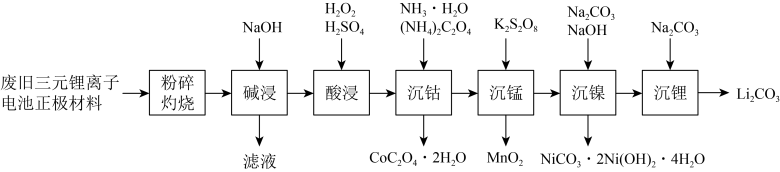
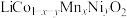 的基本结构单元如图所示,则据此计算
的基本结构单元如图所示,则据此计算

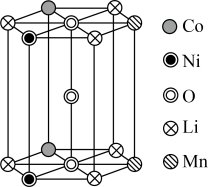
(3)“碱浸”后滤液中大量存在的阴离子为
(4)已知:
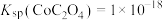 ,
,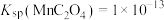 ,
,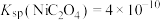 。若“酸浸”后溶液中
。若“酸浸”后溶液中 、
、 、
、 浓度均为0.1mol/L,理论计算欲使
浓度均为0.1mol/L,理论计算欲使 完全沉淀(离子浓度小于
完全沉淀(离子浓度小于 )而不沉淀
)而不沉淀 、
、 ,需调节
,需调节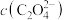 <
< 之后
之后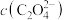 往往超出上述范围,因而须先加入一定量氨水,推测所加氨水的作用为
往往超出上述范围,因而须先加入一定量氨水,推测所加氨水的作用为(5)“沉锰”过程中加入
 溶液后,溶液先变为紫红色,一段时间后紫红色又褪去,则溶液变为紫红色的原因为
溶液后,溶液先变为紫红色,一段时间后紫红色又褪去,则溶液变为紫红色的原因为 即可]。
即可]。(6)“沉镍”过程中加入
 溶液不能过量,原因为
溶液不能过量,原因为
您最近一年使用:0次