1 . 水热法制备 纳米颗粒的反应如下(反应条件忽略):
纳米颗粒的反应如下(反应条件忽略):
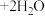 。下列说法错误的是
。下列说法错误的是
 纳米颗粒的反应如下(反应条件忽略):
纳米颗粒的反应如下(反应条件忽略):
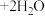 。下列说法错误的是
。下列说法错误的是A.该反应中 作氧化剂 作氧化剂 | B.该反应中 和 和 都是还原剂 都是还原剂 |
C.3个 参加反应时有1个 参加反应时有1个 被氧化 被氧化 | D.离子方程式中 |
您最近半年使用:0次
2 . 请按照要求填写:
(1)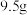 某二价金属氯化物
某二价金属氯化物 中含有
中含有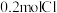 ,则
,则 的摩尔质量是
的摩尔质量是___________ 。
(2)除去镁粉中的铝粉,所选试剂为___________ ,相关的离子反应方程式为___________ 。
(3)配平离子方程式:___________ 。
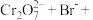 ___________=___________
___________=___________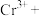 ___________
___________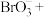 ___________
___________
(4)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂 的一种制备方法如下。
的一种制备方法如下。___________ ;
② 的结构式是
的结构式是___________ ;
③反应Ⅰ的离子方程式是___________ 。
(1)
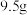 某二价金属氯化物
某二价金属氯化物 中含有
中含有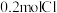 ,则
,则 的摩尔质量是
的摩尔质量是(2)除去镁粉中的铝粉,所选试剂为
(3)配平离子方程式:
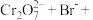 ___________=___________
___________=___________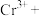 ___________
___________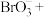 ___________
___________
(4)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂
 的一种制备方法如下。
的一种制备方法如下。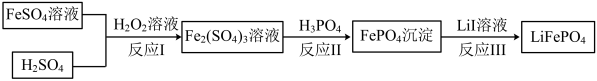
②
 的结构式是
的结构式是③反应Ⅰ的离子方程式是
您最近半年使用:0次
名校
3 . 高铁酸钾 是一种高效多功能的新型非氯绿色消毒剂。已知
是一种高效多功能的新型非氯绿色消毒剂。已知 可溶于水、微溶于浓
可溶于水、微溶于浓 溶液,在
溶液,在 、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:

回答下列问题:
(1)配制 溶液。
溶液。
①配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒和_______ ,需要用托盘天平称量 固体
固体_______ g。
②下列操作可能导致上述 溶液浓度偏大的是
溶液浓度偏大的是_______ (填字母)。
A.摇匀后发现液面低于刻度线,再加水至刻度线
B. 在烧杯中溶解后,烧杯未洗涤
在烧杯中溶解后,烧杯未洗涤
C.使用前,容量瓶中有少量蒸馏水
D.定容时俯视刻度线
③上述配制的 溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为
溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为_______ (从物质性质角度)。
(2)“氧化”过程中溶液保持强碱性,写出 溶液氧化
溶液氧化 生成
生成 的离子方程式:
的离子方程式:_______ 。
(3)“除杂”后滤液的主要成分为 和
和 ,“转化”反应能发生的原因是
,“转化”反应能发生的原因是_______ 。
(4) 在净水过程中会产生
在净水过程中会产生 胶体,检验该过程中产生胶体的方法是
胶体,检验该过程中产生胶体的方法是_______ 。
 是一种高效多功能的新型非氯绿色消毒剂。已知
是一种高效多功能的新型非氯绿色消毒剂。已知 可溶于水、微溶于浓
可溶于水、微溶于浓 溶液,在
溶液,在 、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
回答下列问题:
(1)配制
 溶液。
溶液。①配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒和
 固体
固体②下列操作可能导致上述
 溶液浓度偏大的是
溶液浓度偏大的是A.摇匀后发现液面低于刻度线,再加水至刻度线
B.
 在烧杯中溶解后,烧杯未洗涤
在烧杯中溶解后,烧杯未洗涤C.使用前,容量瓶中有少量蒸馏水
D.定容时俯视刻度线
③上述配制的
 溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为
溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为(2)“氧化”过程中溶液保持强碱性,写出
 溶液氧化
溶液氧化 生成
生成 的离子方程式:
的离子方程式:(3)“除杂”后滤液的主要成分为
 和
和 ,“转化”反应能发生的原因是
,“转化”反应能发生的原因是(4)
 在净水过程中会产生
在净水过程中会产生 胶体,检验该过程中产生胶体的方法是
胶体,检验该过程中产生胶体的方法是
您最近半年使用:0次
2024-03-02更新
|
62次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高一上学期2月期末化学试题
名校
解题方法
4 . 如图为制取无水氯化铁粉末的装置,已知氯化铁粉末很容易吸水生成含结晶水的化合物。
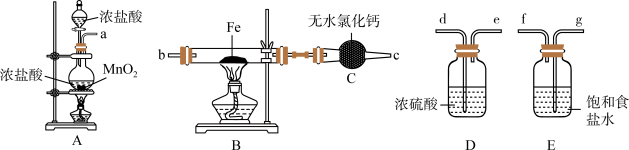
回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置E的作用是___________ 。
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为___________ 。
(5)利用制取的无水氯化铁固体配制少量 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。
①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为___________ ;溶解所得溶液中含有 的原因可能是
的原因可能是___________ 。
②向沸水中滴加少量 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至___________ (填实验现象)时停止,得到 胶体。
胶体。

回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
(2)装置A中发生反应的离子方程式为
(3)装置E的作用是
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有
 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为(5)利用制取的无水氯化铁固体配制少量
 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为
 的原因可能是
的原因可能是②向沸水中滴加少量
 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至 胶体。
胶体。
您最近半年使用:0次
2024-03-02更新
|
75次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高一上学期2月期末化学试题
解题方法
5 . 钛白粉学名二氧化钛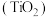 是性能最佳、应用最广、用量最大的白色颜料。钛铁矿
是性能最佳、应用最广、用量最大的白色颜料。钛铁矿 中往往含有
中往往含有 等杂质。一种硫酸法钛白粉生产工艺如图:
等杂质。一种硫酸法钛白粉生产工艺如图:
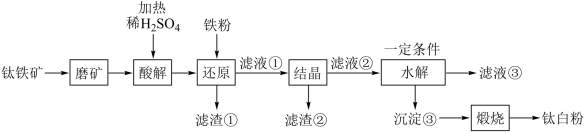
已知:①酸解后,钛主要以 形式存在,强电解质
形式存在,强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。
② 不溶于水和稀酸。
不溶于水和稀酸。
(1)写出基态 原子的价层电子排布式
原子的价层电子排布式___________ 。
(2)磨矿的目的是___________ 。
(3)滤渣①的主要成分是___________ 。
(4)酸解过程中,写出 发生反应的化学方程式
发生反应的化学方程式___________ 。
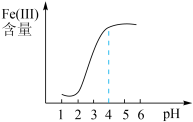
(5)还原过程中,加入铁粉的目的是还原体系中的 。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中
。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中 (Ⅲ)含量随
(Ⅲ)含量随 变化如图,试分析在
变化如图,试分析在 介于4~6之间时,
介于4~6之间时, (Ⅲ)含量基本保持不变的原因:
(Ⅲ)含量基本保持不变的原因:___________ 。
(6)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的离子方程式为___________ 。
②一定量 的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中
的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中 的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理___________ 。
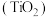 是性能最佳、应用最广、用量最大的白色颜料。钛铁矿
是性能最佳、应用最广、用量最大的白色颜料。钛铁矿 中往往含有
中往往含有 等杂质。一种硫酸法钛白粉生产工艺如图:
等杂质。一种硫酸法钛白粉生产工艺如图:
已知:①酸解后,钛主要以
 形式存在,强电解质
形式存在,强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。②
 不溶于水和稀酸。
不溶于水和稀酸。(1)写出基态
 原子的价层电子排布式
原子的价层电子排布式(2)磨矿的目的是
(3)滤渣①的主要成分是
(4)酸解过程中,写出
 发生反应的化学方程式
发生反应的化学方程式(5)还原过程中,加入铁粉的目的是还原体系中的
 。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中
。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中 (Ⅲ)含量随
(Ⅲ)含量随 变化如图,试分析在
变化如图,试分析在 介于4~6之间时,
介于4~6之间时, (Ⅲ)含量基本保持不变的原因:
(Ⅲ)含量基本保持不变的原因:
(6)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的离子方程式为
②一定量
 的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中
的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中 的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
您最近半年使用:0次
解题方法
6 . 氯化碘(ICl)是红棕色液体,易挥发,熔点为 ,沸点为
,沸点为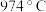 ,易与水反应,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组同学拟用下列仪器制备氯化碘。
,易与水反应,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组同学拟用下列仪器制备氯化碘。
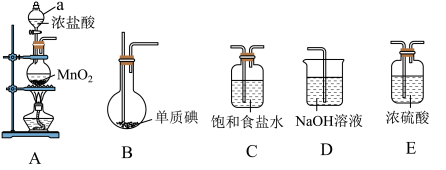
(1)a仪器名称___________ 。
(2)上述装置,按气流方向连接的顺序为___________ (装置可重复使用)。
(3)A装置中发生反应的化学方程式为___________ 。
(4)氟化氯与氯化碘都是卤素互化物,它可用于制备硝酸氯,原理为: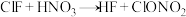 ,下列判断中正确的是___________。
,下列判断中正确的是___________。
(5)高铁酸钾 与
与 都是高效消毒剂,实验室可将氯气通入过量
都是高效消毒剂,实验室可将氯气通入过量 与
与 的混合溶液来制备
的混合溶液来制备 。向
。向 滴加盐酸可以生成氯气,说明氧化性:
滴加盐酸可以生成氯气,说明氧化性:
___________  (填“>”或“<”),而
(填“>”或“<”),而 的制备实验表明
的制备实验表明 和
和 的氧化性强弱关系相反,其原因是
的氧化性强弱关系相反,其原因是___________ 。
 ,沸点为
,沸点为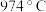 ,易与水反应,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组同学拟用下列仪器制备氯化碘。
,易与水反应,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组同学拟用下列仪器制备氯化碘。
(1)a仪器名称
(2)上述装置,按气流方向连接的顺序为
(3)A装置中发生反应的化学方程式为
(4)氟化氯与氯化碘都是卤素互化物,它可用于制备硝酸氯,原理为:
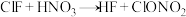 ,下列判断中正确的是___________。
,下列判断中正确的是___________。A. 和 和 熔融状态均能导电 熔融状态均能导电 |
B. 与 与 反应时,氯元素被还原 反应时,氯元素被还原 |
C.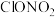 与水反应生成盐酸和硝酸 与水反应生成盐酸和硝酸 |
D. 化学性质与卤素单质相似,可以与锌反应 化学性质与卤素单质相似,可以与锌反应 |
(5)高铁酸钾
 与
与 都是高效消毒剂,实验室可将氯气通入过量
都是高效消毒剂,实验室可将氯气通入过量 与
与 的混合溶液来制备
的混合溶液来制备 。向
。向 滴加盐酸可以生成氯气,说明氧化性:
滴加盐酸可以生成氯气,说明氧化性:
 (填“>”或“<”),而
(填“>”或“<”),而 的制备实验表明
的制备实验表明 和
和 的氧化性强弱关系相反,其原因是
的氧化性强弱关系相反,其原因是
您最近半年使用:0次
解题方法
7 . 某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。已知:铜与稀硝酸反应,金和稀硝酸不反应。回答下列问题:
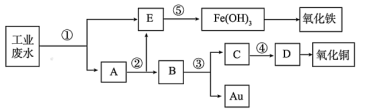
(1)图中标号处需加入的相应物质分别是①___________ 、②___________ (均写物质名称)。
(2)③处加入的物质为稀硝酸,化学反应为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,请用单线桥标明电子转移方向及数目___________ 。
(3)在浓度相等的条件下,Fe3+、Cu2+、Au3+氧化性由强到弱的顺序为___________ 。
(4)⑤处的总离子方程式为: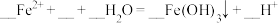 ,请补全缺项并配平
,请补全缺项并配平___________ ;该反应的现象为___________ 。

(1)图中标号处需加入的相应物质分别是①
(2)③处加入的物质为稀硝酸,化学反应为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,请用单线桥标明电子转移方向及数目
(3)在浓度相等的条件下,Fe3+、Cu2+、Au3+氧化性由强到弱的顺序为
(4)⑤处的总离子方程式为:
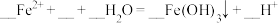 ,请补全缺项并配平
,请补全缺项并配平
您最近半年使用:0次
名校
解题方法
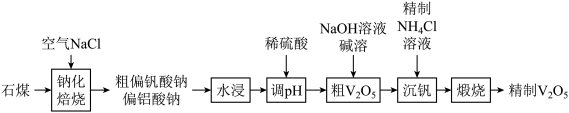
8 .  (五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有
(五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有 等)来制备
等)来制备 的一种工艺流程如下:
的一种工艺流程如下:
已知:① (偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。
(偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。
②
 沉淀生成和溶解的
沉淀生成和溶解的 如表所示:
如表所示:
回答下列问题:
(1)V在元素周期表中的位置:___________ 。
(2)“钠化焙烧”过程中 转化为可溶性
转化为可溶性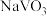 ,同时有黄绿色气体生成,其化学方程式为
,同时有黄绿色气体生成,其化学方程式为___________ 。
(3)粗 中含有
中含有 ,可通过
,可通过 溶液碱溶除去,需调节
溶液碱溶除去,需调节 的范围为
的范围为___________ 。
(4)已知:室温下,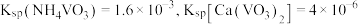 ,向偏钒酸铵的悬浊液中加入
,向偏钒酸铵的悬浊液中加入 ,当溶液中
,当溶液中 时,溶液中的
时,溶液中的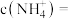
___________ 。
(5)产品纯度测定:将 产品溶于足量稀硫酸配成
产品溶于足量稀硫酸配成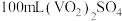 溶液。取
溶液。取 该溶液于锥形瓶中,用
该溶液于锥形瓶中,用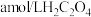 标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为
标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为 。已知:
。已知: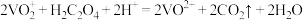 ,则该产品中
,则该产品中 的质量分数是
的质量分数是___________ %。
(6)钒的一种配合物的结构简式为 ,该配合物分子中含有的化学键类型有___________(填字母)。
,该配合物分子中含有的化学键类型有___________(填字母)。
 (五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有
(五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有 等)来制备
等)来制备 的一种工艺流程如下:
的一种工艺流程如下:
已知:①
 (偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。
(偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。②

 沉淀生成和溶解的
沉淀生成和溶解的 如表所示:
如表所示:溶液 | ||||
| 物质 | 开始沉淀 | 完全沉淀 | 沉淀开始溶解 | 沉淀完全溶解 |
 | 2.2 | 5.1 | 7.1 | 8.1 |
 | 3.3 | 4.7 | 8.7 | 12.8 |
(1)V在元素周期表中的位置:
(2)“钠化焙烧”过程中
 转化为可溶性
转化为可溶性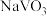 ,同时有黄绿色气体生成,其化学方程式为
,同时有黄绿色气体生成,其化学方程式为(3)粗
 中含有
中含有 ,可通过
,可通过 溶液碱溶除去,需调节
溶液碱溶除去,需调节 的范围为
的范围为(4)已知:室温下,
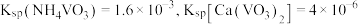 ,向偏钒酸铵的悬浊液中加入
,向偏钒酸铵的悬浊液中加入 ,当溶液中
,当溶液中 时,溶液中的
时,溶液中的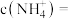
(5)产品纯度测定:将
 产品溶于足量稀硫酸配成
产品溶于足量稀硫酸配成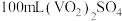 溶液。取
溶液。取 该溶液于锥形瓶中,用
该溶液于锥形瓶中,用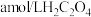 标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为
标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为 。已知:
。已知: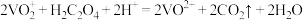 ,则该产品中
,则该产品中 的质量分数是
的质量分数是(6)钒的一种配合物的结构简式为
 ,该配合物分子中含有的化学键类型有___________(填字母)。
,该配合物分子中含有的化学键类型有___________(填字母)。| A.离子键 | B.极性键 | C.非极性键 | D.配位键 |
您最近半年使用:0次
2024-01-28更新
|
454次组卷
|
2卷引用:辽宁省五校联考2023-2024学年高三上学期期末考试化学试题
名校
解题方法
9 . 从干海带中提取碘的实验流程如下:
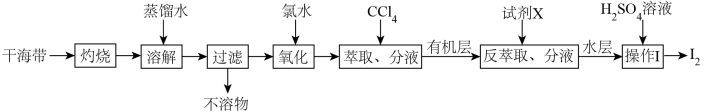
| A.氧化步骤中氯水可用过氧化氢代替 |
B.试剂X可以为 ,反萃取的离子方程式为: ,反萃取的离子方程式为: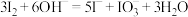 |
C. 可循环利用以有效提高干海带提碘的产率 可循环利用以有效提高干海带提碘的产率 |
| D.操作Ⅰ要用到普通漏斗、烧杯和玻璃棒 |
您最近半年使用:0次
2024-01-28更新
|
555次组卷
|
4卷引用:辽宁省五校联考2023-2024学年高三上学期期末考试化学试题
解题方法
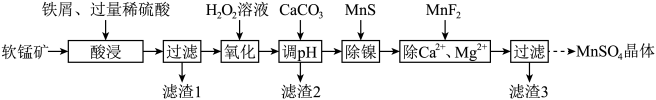
10 . 利用软锰矿(主要成分是 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
已知:常温下, ,
, ,
, ,
, 。
。
回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是_______ ;“酸浸”后溶液中检测到 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为________ ;“滤渣1”的主要成分为________ (填化学式)。
(2)“氧化”时发生反应的离子方程式为___________ ,“调pH”的目的是___________ 。
(3)“除镍”时,使用MnS作为沉淀剂的原因是___________ 。
(4)加入 使
使 、
、 的浓度均不高于
的浓度均不高于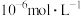 ,此时溶液中
,此时溶液中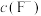 至少为
至少为_______  。
。
(5)硫酸锰的溶解度随温度变化关系如图所示,从“除 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是________ 。

 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
已知:常温下,
 ,
, ,
, ,
, 。
。回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是
 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为(2)“氧化”时发生反应的离子方程式为
(3)“除镍”时,使用MnS作为沉淀剂的原因是
(4)加入
 使
使 、
、 的浓度均不高于
的浓度均不高于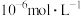 ,此时溶液中
,此时溶液中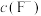 至少为
至少为 。
。(5)硫酸锰的溶解度随温度变化关系如图所示,从“除
 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是
您最近半年使用:0次



