1 . 氮氧化物(NOx)会对生态系统和人体健康造成危害。一种以沸石笼作为载体对NOₓ进行催化还原的原理如图所示。下列说法错误的是
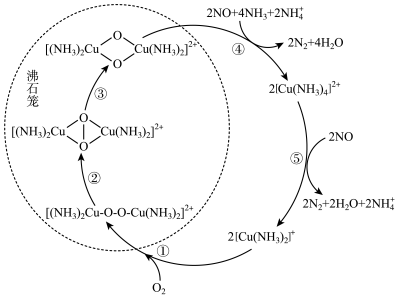
| A.反应①每消耗lmolO2, 转移 2mol电子 |
| B.反应⑤中[Cu(NH3)4]2+作还原剂 |
| C.反应④有σ键和π键的形成 |
D.脱除NO 的总反应可表示为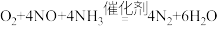 |
您最近一年使用:0次
2023-10-19更新
|
287次组卷
|
4卷引用:辽宁省沈阳市辽中区第一私立高级中学2023-2024学年高二上学期1月期末化学试题
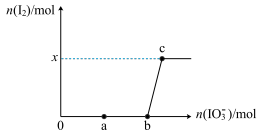
2 . 往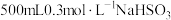 溶液中逐滴加入KIO3溶液,加入的KIO3和生成的I2的物质的量的关系曲线如图所示(不考虑物质与水发生的反应及弱电解质的电离)。
溶液中逐滴加入KIO3溶液,加入的KIO3和生成的I2的物质的量的关系曲线如图所示(不考虑物质与水发生的反应及弱电解质的电离)。
回答下列问题:
(1)NaHSO3在水中的电离方程式为___________ 。
(2)a点溶液的pH___________ (填“>”、“<”或“=”)7,判断的理由为___________ (用离子方程式表示)。
(3)b点溶液中所含的阳离子有___________ (填离子符号)。
(4)b→c的离子方程式为___________ 。
(5)往c点溶液中加入淀粉溶液,可以观察到的现象为___________ 。
(6)x=___________ 。
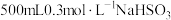 溶液中逐滴加入KIO3溶液,加入的KIO3和生成的I2的物质的量的关系曲线如图所示(不考虑物质与水发生的反应及弱电解质的电离)。
溶液中逐滴加入KIO3溶液,加入的KIO3和生成的I2的物质的量的关系曲线如图所示(不考虑物质与水发生的反应及弱电解质的电离)。
回答下列问题:
(1)NaHSO3在水中的电离方程式为
(2)a点溶液的pH
(3)b点溶液中所含的阳离子有
(4)b→c的离子方程式为
(5)往c点溶液中加入淀粉溶液,可以观察到的现象为
(6)x=
您最近一年使用:0次
3 . 某工厂制备Cr(OH)3的工艺流程如图所示:
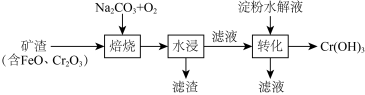
已知:焙烧后Cr元素以+6价的形式存在。
下列说法正确的是

已知:焙烧后Cr元素以+6价的形式存在。
下列说法正确的是
| A.Na2CO3俗称水玻璃 |
| B.FeO、Cr2O3、O2均不溶于稀盐酸 |
C.焙烧时发生反应的化学方程式可能为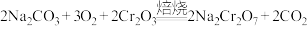 |
| D.淀粉水解液能产生丁达尔效应,且其在转化时的主要作用为作催化剂 |
您最近一年使用:0次
4 . 将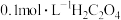 溶液逐滴滴入同浓度的酸性KMnO4溶液中(如图所示),下列说法正确的是
溶液逐滴滴入同浓度的酸性KMnO4溶液中(如图所示),下列说法正确的是
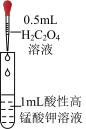
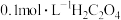 溶液逐滴滴入同浓度的酸性KMnO4溶液中(如图所示),下列说法正确的是
溶液逐滴滴入同浓度的酸性KMnO4溶液中(如图所示),下列说法正确的是
| A.H2C2O4属于二元强酸 |
| B.该反应中,每生成0.2molC=O键,转移的电子的物质的量为0.1mol |
| C.当胶头滴管中的溶液全部滴加完,一段时间后,试管中溶液的颜色由紫色变为无色 |
D.该反应的化学方程式为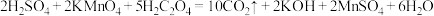 |
您最近一年使用:0次
2023-07-25更新
|
77次组卷
|
2卷引用:辽宁省部分学校2022-2023学年高二下学期期末考试化学试题
名校
解题方法
5 . 为验证SO2的性质并制备NaHSO3和Na2SO3,设计如图所示实验装置(部分夹持装置略去)。
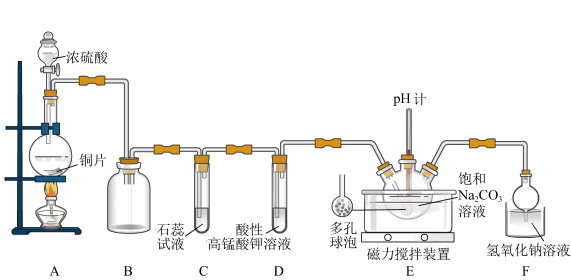
(1)装置A中反应的化学方程式是_______ 。
(2)盛放浓硫酸的仪器名称是_______ ,装置B的作用是_______ 。
(3)试管D中发生反应的离子方程式为_______ 。
(4)装置E中设计多孔球泡的目的是_______ 。
(5)已知:Na2SO3水溶液中H2SO3、 、
、 的物质的量分数随pH的分布如图1所示,Na2SO3的溶解度曲线如图2所示。
的物质的量分数随pH的分布如图1所示,Na2SO3的溶解度曲线如图2所示。
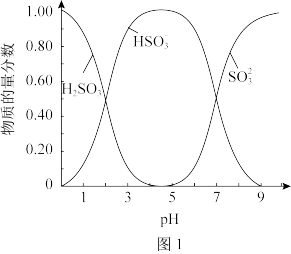
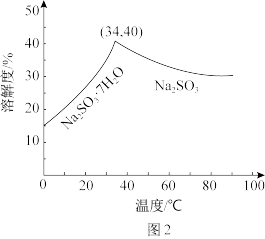
由NaHSO3溶液制备Na2SO3的实验方案为边搅拌边向NaHSO3溶液中加入NaOH溶液,测量溶液的pH,当pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于_______ ℃条件下趁热过滤。滴加NaOH溶液不能过慢的原因是_______ 。

(1)装置A中反应的化学方程式是
(2)盛放浓硫酸的仪器名称是
(3)试管D中发生反应的离子方程式为
(4)装置E中设计多孔球泡的目的是
(5)已知:Na2SO3水溶液中H2SO3、
 、
、 的物质的量分数随pH的分布如图1所示,Na2SO3的溶解度曲线如图2所示。
的物质的量分数随pH的分布如图1所示,Na2SO3的溶解度曲线如图2所示。

由NaHSO3溶液制备Na2SO3的实验方案为边搅拌边向NaHSO3溶液中加入NaOH溶液,测量溶液的pH,当pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于
您最近一年使用:0次
名校
解题方法
6 . 在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析下列一组有现象变化的化学反应。
(1)用离子方程式解释现象Ⅰ中出现胶状沉淀的原因:_______ 。
(2)Ⅲ中加碱时出现的现象是_______ 。
(3)Ⅳ中加酸时出现的现象是_______ ,用离子方程式解释产生此现象的原因:_______ 。
(4)滴加试剂顺序的变化会影响溶液中的现象和发生的反应。请继续分析以下实验。
①探究加酸时Fe(NO3)2溶液中是否发生了反应:向1.0mL0.1mol·L-1Fe(NO3)2溶液中_______ ,如果溶液变红色,说明溶液中含有Fe3+,证明加酸时溶液中发生了反应。(请将上述操作补充完整)
②推测溶液中产生Fe3+的可能原因有两种:
a._______ 。
b._______ 。
| 实验及操作 | 现象 | ||
| 装置 | 试管 | 滴管 | |
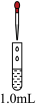 | 饱和Na2SiO3溶液(含2滴酚酞) | 先滴加1.0mL0.5mol·L-1NaOH溶液;再滴加1.5mL1.0mol·L-1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
| 0.1mol·L-1AlCl3溶液 | Ⅱ.加碱时_______;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
| 0.1mol·L-1Fe(NO3)2溶液 | Ⅲ.加碱时_______;加酸后得到棕黄色溶液 | ||
| 新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后_______ | ||
(2)Ⅲ中加碱时出现的现象是
(3)Ⅳ中加酸时出现的现象是
(4)滴加试剂顺序的变化会影响溶液中的现象和发生的反应。请继续分析以下实验。
| 实验及操作 | 现象 | ||
| 装置 | 试管 | 滴管 | |
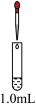 | 0.1mol·L-1Fe(NO3)2溶液 | 先滴加1.5mL1.0mol·L-1H2SO4溶液;再滴加1.0mL0.5mol·L-1NaOH溶液 | Ⅴ.加酸时溶液有明显现象;加碱后溶液依然没有明显变化 |
②推测溶液中产生Fe3+的可能原因有两种:
a.
b.
您最近一年使用:0次
7 . 近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、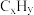 、
、 三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。

在图示的转化中,被还原的元素是___________ ,X的化学式为___________ 。
(2)SCR技术可使 与
与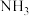 直接反应,实现无害转化。假设
直接反应,实现无害转化。假设 是NO时,发生反应的化学方程式是
是NO时,发生反应的化学方程式是_______ 。
(3)利用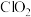 氧化氮氧化物反应过程如下:
氧化氮氧化物反应过程如下: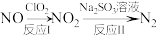 。反应I的化学方程式是
。反应I的化学方程式是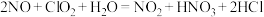 ,反应II的离子方程式是
,反应II的离子方程式是___________ 。
(4)加入过量次氯酸钠可使废水中 完全转化为
完全转化为 ,而本身被还原为NaCl。
,而本身被还原为NaCl。
①检验废水中是否存在 的方法是
的方法是___________ 。
②若处理废水产生了0.448L (标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为
(标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为___________ mL。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、
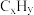 、
、 三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
在图示的转化中,被还原的元素是
(2)SCR技术可使
 与
与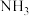 直接反应,实现无害转化。假设
直接反应,实现无害转化。假设 是NO时,发生反应的化学方程式是
是NO时,发生反应的化学方程式是(3)利用
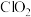 氧化氮氧化物反应过程如下:
氧化氮氧化物反应过程如下: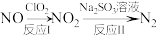 。反应I的化学方程式是
。反应I的化学方程式是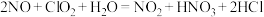 ,反应II的离子方程式是
,反应II的离子方程式是(4)加入过量次氯酸钠可使废水中
 完全转化为
完全转化为 ,而本身被还原为NaCl。
,而本身被还原为NaCl。①检验废水中是否存在
 的方法是
的方法是②若处理废水产生了0.448L
 (标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为
(标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为
您最近一年使用:0次
解题方法
8 . 某含镁废弃物中主要含有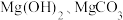 ,还含有少量的
,还含有少量的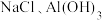 、
、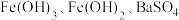 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:

已知:部分离子开始沉淀和完全沉淀的
回答下列问题:
(1)滤渣1的主要成分为_______ (填化学式),其阴离子空间构型为_______ 。
(2)“酸浸”时,发生反应的基本反应类型均为_______ ,所使用的稀盐酸的质量浓度为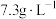 ,则其物质的量浓度为
,则其物质的量浓度为_______  。
。
(3)“氧化”时,反应的离子方程式为_______ 。
(4)“调 ”时,
”时, 的调节范围为
的调节范围为_______ (滤渣2中有两种氢氧化物)。
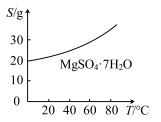
(5)已知 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括_______ 、过滤、洗涤、干燥。
(6)若测定 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
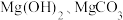 ,还含有少量的
,还含有少量的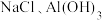 、
、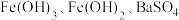 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:
已知:部分离子开始沉淀和完全沉淀的

| 氢氧化物 |  |  |  |
开始沉淀时的 | 4.0 | 8.4 | 1.9 |
完全沉淀时的 | 5.2 | 11.2 | 3.2 |
(1)滤渣1的主要成分为
(2)“酸浸”时,发生反应的基本反应类型均为
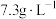 ,则其物质的量浓度为
,则其物质的量浓度为 。
。(3)“氧化”时,反应的离子方程式为
(4)“调
 ”时,
”时, 的调节范围为
的调节范围为(5)已知
 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括
(6)若测定
 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。| A | B | C | D |
 |  |  |  |
| 天平 | 坩埚 | 马弗炉(一种加热设备) | 分液漏斗 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-12更新
|
94次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题
9 . 某工厂采用联合焙烧法以辉铋矿(主要成分为 ,含有
,含有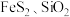 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )为原料制备
)为原料制备 和
和 ,工艺流程如下:
,工艺流程如下:
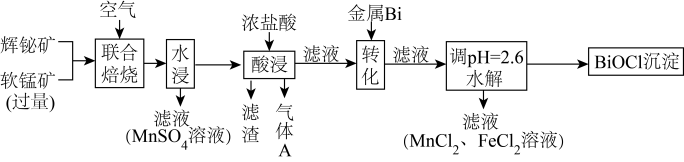
已知:①焙烧时过量的 分解为
分解为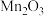 ,
,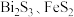 转变为
转变为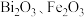 ;
;
②金属活动性: ;
;
③常温下,相关金属离子形成氢氧化物的 范围如下:
范围如下:
回答下列问题:
(1)写出“联合焙烧”时 和
和 反应生成
反应生成 的化学方程式:
的化学方程式:_______ 。
(2) 在空气中单独焙烧生成
在空气中单独焙烧生成 ,同时产生一种气体产物,若用过量的
,同时产生一种气体产物,若用过量的 溶液吸收该气体,则所得溶液的溶质为
溶液吸收该气体,则所得溶液的溶质为_______ 。
(3)“酸浸”时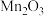 转化为
转化为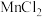 ,则生成的气体A为
,则生成的气体A为_______ (填化学式)
(4)“转化”时加入金属 的目的是
的目的是_______ (用离子方程式表示)
(5)若沉淀完全时溶液中的金属离子浓度为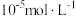 ,则由表中数据计算可得:
,则由表中数据计算可得: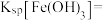
_______ 。
(6)水解生成 的离子方程式为
的离子方程式为_______ 、
(7)若取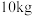 铋含量为
铋含量为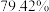 的辉铋矿,经过上述流程(铋元素在整个流程中损失率为
的辉铋矿,经过上述流程(铋元素在整个流程中损失率为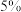 ),计算可制得
),计算可制得 固体的质量约为
固体的质量约为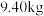 ,实测干燥的
,实测干燥的 产品产量高于计算值的原因是
产品产量高于计算值的原因是_______ 。
 ,含有
,含有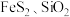 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )为原料制备
)为原料制备 和
和 ,工艺流程如下:
,工艺流程如下:
已知:①焙烧时过量的
 分解为
分解为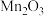 ,
,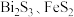 转变为
转变为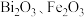 ;
;②金属活动性:
 ;
;③常温下,相关金属离子形成氢氧化物的
 范围如下:
范围如下:| 离子 | 开始沉淀 | 完全沉淀 |
 | 6.3 | 8.3 |
 | 1.6 | 3.1 |
 | 8.1 | 10.1 |
(1)写出“联合焙烧”时
 和
和 反应生成
反应生成 的化学方程式:
的化学方程式:(2)
 在空气中单独焙烧生成
在空气中单独焙烧生成 ,同时产生一种气体产物,若用过量的
,同时产生一种气体产物,若用过量的 溶液吸收该气体,则所得溶液的溶质为
溶液吸收该气体,则所得溶液的溶质为(3)“酸浸”时
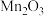 转化为
转化为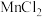 ,则生成的气体A为
,则生成的气体A为(4)“转化”时加入金属
 的目的是
的目的是(5)若沉淀完全时溶液中的金属离子浓度为
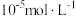 ,则由表中数据计算可得:
,则由表中数据计算可得: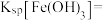
(6)水解生成
 的离子方程式为
的离子方程式为(7)若取
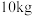 铋含量为
铋含量为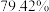 的辉铋矿,经过上述流程(铋元素在整个流程中损失率为
的辉铋矿,经过上述流程(铋元素在整个流程中损失率为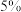 ),计算可制得
),计算可制得 固体的质量约为
固体的质量约为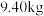 ,实测干燥的
,实测干燥的 产品产量高于计算值的原因是
产品产量高于计算值的原因是
您最近一年使用:0次
名校
解题方法
10 . 超细银粉在光学、生物医疗等领域有着广阔的应用前景。由含银废催化剂制备超细银粉的过程如下:
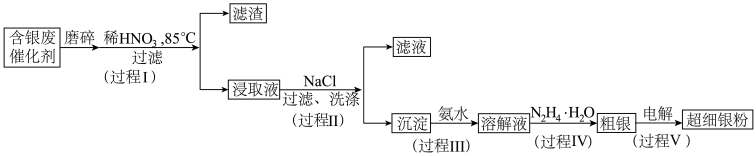
资料:
i.含银废催化剂成分:主要含Ag、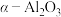 及少量MgO、
及少量MgO、 、
、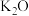 、
、 等
等
ii.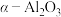 为载体,且不溶于硝酸
为载体,且不溶于硝酸
iii.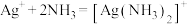
(1)预处理
过程I中,为提高银的浸取速率采取的措施有_______
(2)分离除杂
①过程Ⅱ中,检验沉淀表面的 已洗涤干净的操作是
已洗涤干净的操作是_______ 。
②过程Ⅲ中,请结合平衡移动原理解释沉淀溶解的原因_______ 。
③过程Ⅳ中, 被氧化为
被氧化为 ,同时获得粗银,该反应的离子方程式为
,同时获得粗银,该反应的离子方程式为_______ 。
(3)回收率测定
采用如下方法测定粗银中银的回收率:取m g粗银样品用硝酸溶解,以铁铵矾[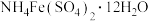 ]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。
]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。
已知:i.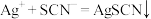 (白色)
(白色) 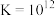
 (红色)
(红色) 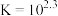
ii. 开始沉淀的pH为1.5,完全沉淀的pH为2.8
开始沉淀的pH为1.5,完全沉淀的pH为2.8
iii.AgSCN可溶于较浓硝酸判断已达滴定终点时的现象是_______ 。
(4)精炼
①精炼时粗银应连接电源_______ 极;
②电解质溶液中溶质为_______ 。

资料:
i.含银废催化剂成分:主要含Ag、
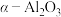 及少量MgO、
及少量MgO、 、
、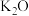 、
、 等
等ii.
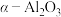 为载体,且不溶于硝酸
为载体,且不溶于硝酸iii.
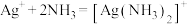
(1)预处理
过程I中,为提高银的浸取速率采取的措施有
(2)分离除杂
①过程Ⅱ中,检验沉淀表面的
 已洗涤干净的操作是
已洗涤干净的操作是②过程Ⅲ中,请结合平衡移动原理解释沉淀溶解的原因
③过程Ⅳ中,
 被氧化为
被氧化为 ,同时获得粗银,该反应的离子方程式为
,同时获得粗银,该反应的离子方程式为(3)回收率测定
采用如下方法测定粗银中银的回收率:取m g粗银样品用硝酸溶解,以铁铵矾[
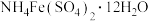 ]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。
]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。已知:i.
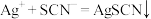 (白色)
(白色) 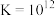
 (红色)
(红色) 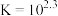
ii.
 开始沉淀的pH为1.5,完全沉淀的pH为2.8
开始沉淀的pH为1.5,完全沉淀的pH为2.8iii.AgSCN可溶于较浓硝酸判断已达滴定终点时的现象是
(4)精炼
①精炼时粗银应连接电源
②电解质溶液中溶质为
您最近一年使用:0次
2023-01-05更新
|
295次组卷
|
2卷引用:辽宁省沈阳市东北育才学校2022-2023学年高二上学期期末测试化学试题



