9-10高三·江西宜春·阶段练习
解题方法
1 . 有一未完成的离子方程式为:□□+XO3-+6H+=3X2+3H2O,据此判断,X元素的最高化合价为
| A.+7 | B.+4 | C.+5 | D.+1 |
您最近一年使用:0次
解题方法
2 . 铜的离子除了铜离子(Cu2+)外,自然界中还存在亚铜离子(Cu+)。Cu+在水溶液中没有Cu2+稳定,易在酸性条件下发生反应:2Cu+═Cu2++Cu。+1价铜的化合物通常是难溶物,如Cu2O、CuI、CuCl、Cu2S、等。
回答下列问题:
(1) 在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成难溶物的颜色为________ ;若继续加热,出现黑色物质,判断这种物质的化学式为________________ 。
(2) 在CuCl2溶液中滴加过量KI溶液,可发生如下反应:
a.2Cu2++4I-═2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-═2CuCl↓(白色)+I2
为顺利观察到CuI、CuCl白色沉淀,可以加入下列试剂中的________ 。
A.乙醇 B.苯 C.盐酸溶液 D.NaCl溶液
(3) Cu2S在稀H2SO4酸化下与氧气反应生成CuSO4,该反应的化学方程式为________________________________ ;该反应的还原剂为________________ ,当1 mol O2发生反应时,还原剂所失电子的物质的量为________ mol,其中被S元素还原的O2的物质的量为________ mol。
回答下列问题:
(1) 在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成难溶物的颜色为
(2) 在CuCl2溶液中滴加过量KI溶液,可发生如下反应:
a.2Cu2++4I-═2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-═2CuCl↓(白色)+I2
为顺利观察到CuI、CuCl白色沉淀,可以加入下列试剂中的
A.乙醇 B.苯 C.盐酸溶液 D.NaCl溶液
(3) Cu2S在稀H2SO4酸化下与氧气反应生成CuSO4,该反应的化学方程式为
您最近一年使用:0次
9-10高三·河南周口·阶段练习
名校
3 . 在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+ 2As+3SnCl62-+6M,关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3②还原性:Cl->As ③每生成7.5 g As,还原剂失去的电子为0.3 mol
④M为OH-⑤SnCl62-是氧化产物
①氧化剂是H3AsO3②还原性:Cl->As ③每生成7.5 g As,还原剂失去的电子为0.3 mol
④M为OH-⑤SnCl62-是氧化产物
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.①③ |
您最近一年使用:0次
2018-03-09更新
|
245次组卷
|
7卷引用:2011-2012学年辽宁省实验中学分校高二下学期期末考试化学试卷
(已下线)2011-2012学年辽宁省实验中学分校高二下学期期末考试化学试卷福建省厦门第一中学2016-2017学年高二下学期开学考试理综-化学试题2016-2017学年湖南省长沙市第一中学高二下学期第一次模块检测化学试卷(已下线)2010年河南省郸城县第一高级中学高三第二次月考化学试卷河南省郑州市第一中学2017-2018学年高一下学期入学考试化学试题江西省吉安市吉水中学2019届高三10月月考化学试题江西省余干县新时代学校2020-2021学年高一上学期阶段测试(二)化学试题
名校
4 . I.(1)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备ClO2,化学方程式是_____________________________________ 。
(2)科学家又研究出了一种新的制备ClO2方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,该反应的离子方程式为_____________________________________ 。
II.向50mL0.018 mol·L-1的AgNO3溶液中加入50mL0.020 mol·L-1的盐酸,生成沉淀。如果AgCl的Ksp=l.0×10-10,试求:
(1)沉淀生成后溶液中c(Ag+)为_____________________ 。
(2)沉淀生成后溶液的pH是_____________________ 。
(2)科学家又研究出了一种新的制备ClO2方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,该反应的离子方程式为
II.向50mL0.018 mol·L-1的AgNO3溶液中加入50mL0.020 mol·L-1的盐酸,生成沉淀。如果AgCl的Ksp=l.0×10-10,试求:
(1)沉淀生成后溶液中c(Ag+)为
(2)沉淀生成后溶液的pH是
您最近一年使用:0次
5 . (1)白色固体PCl5受热即挥发并发生分解:PCl5(g)  PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为
PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为________ 。
(2)下列微粒在溶液中的还原性和氧化性强弱顺序如下:还原性HSO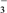 >I-,氧化性IO
>I-,氧化性IO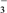 >I2>SO
>I2>SO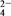 。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为
。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为________ mol。
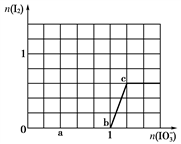
(3)甲醇对水质会造成一定的污染,可细菌的作用下,用氨(NH3)处理含甲醇(CH3OH)的工业废水,使其变成无毒的CO2和N2,从而消除对环境的污染,化学方程式为:_____________________ ,该过程中被氧化的元素是 ___________ ,当产生标准状况下2.24L 时,共转移电子
时,共转移电子_______ mol。
 PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为
PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为(2)下列微粒在溶液中的还原性和氧化性强弱顺序如下:还原性HSO
 >I-,氧化性IO
>I-,氧化性IO >I2>SO
>I2>SO 。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为
。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为
(3)甲醇对水质会造成一定的污染,可细菌的作用下,用氨(NH3)处理含甲醇(CH3OH)的工业废水,使其变成无毒的CO2和N2,从而消除对环境的污染,化学方程式为:
 时,共转移电子
时,共转移电子
您最近一年使用:0次
6 . KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
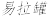
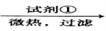

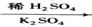
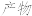
回答下列问题:
(1)为尽量少引入杂质,试剂①应选用NaOH溶液,若选用H2SO4溶液,其后果是________________________ 。
(2)易拉罐溶解过程中主要反应的化学方程式为____________________________ ;滤液A中的某种离子与NH4+、HCO3-均能反应生成沉淀B,该离子与NH4+反应的离子方程式为_____________________________________________ 。
(3)明矾与硫磺焙烧时发生反应的化学方程式为:KAl(SO4)2·12H2O+S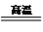 K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为
K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为___________________________ ;每生成67.2L标准状况下的SO2,转移电子的物质的量为________ ;焙烧产生的SO2经催化氧化、吸收等过程可制得硫酸,若SO2催化氧化时的转化率为96.0%,则理论上用该法生成硫酸时硫元素的总转化率为__________ 。
(4)实验室需要用1mol/L的KAl(SO4)2溶液225ml,用明矾配制用到的玻璃仪器有____________________________________ 。
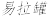
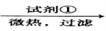

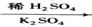
回答下列问题:
(1)为尽量少引入杂质,试剂①应选用NaOH溶液,若选用H2SO4溶液,其后果是
(2)易拉罐溶解过程中主要反应的化学方程式为
(3)明矾与硫磺焙烧时发生反应的化学方程式为:KAl(SO4)2·12H2O+S
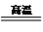 K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为
K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为(4)实验室需要用1mol/L的KAl(SO4)2溶液225ml,用明矾配制用到的玻璃仪器有
您最近一年使用:0次
单选题
|
较易(0.85)
|
名校
7 . 做实验时不小心使皮肤上粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为MnO4-+H2C2O4+H+→CO2↑+Mn2++ 。下列有关叙述正确的是
。下列有关叙述正确的是
 。下列有关叙述正确的是
。下列有关叙述正确的是| A.发生还原反应的是H2C2O4 | B.该离子方程式右侧方框内的产物是OH- |
C.1mol草酸分子中含7mol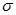 键 键 | D.10 mol二氧化碳生成时,电子转移5 mol |
您最近一年使用:0次
11-12高三·河南周口·阶段练习
名校
8 . 氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可产生它。下列有关叙述中错误的是
| A.“某物质”具有还原性 |
| B.CuH与盐酸反应,可能产生H2 |
| C.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl |
| D.CuH与足量的稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O |
您最近一年使用:0次
2017-02-17更新
|
245次组卷
|
15卷引用:2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷
2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷河南省安阳市第二中学2016-2017学年高二下学期期末考试化学试题(已下线)2013届辽宁省沈阳市第二十中学高三高考领航考试(二)化学试卷(已下线)2013-2014学年吉林省吉林一中高一上学期期末考试化学试卷(已下线)2014届上海市徐汇区高三上学期期末(一模)考试化学试卷贵州省长顺文博高级中学2020-2021学年高二上学期期中考试化学试题卷一 物质及其变化 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末复习检测卷 (已下线)2013届河南省扶沟县高级中学高三第三次考试化学试卷2016届江西师大附中,九江一中高三上期中化学试卷2016届江西省上饶市余干二中高三上学期教学质检化学试卷2017届广东省中山一中高三上学期第一次统测化学试卷2017届河北省武邑中学高三上学期第二次调研化学试卷2017届广东省深圳市三校高三上学期第一次联考化学卷(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第4讲 用途广泛的金属材料及开发利用金属矿物【押题专练】河南省周口恒大中学2023-2024学年高一下学期开学化学试题
名校
解题方法
9 . 利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO4·7H2O)的工业流程示意图如下:
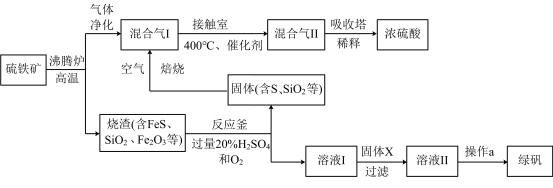
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是______________ 。
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是________________ 。
(3)反应釜中,烧渣经过反应转化为溶液I和固体。
① 烧渣中的FeS在反应中做_______________ 剂(填“氧化”或“还原”)。
② 溶液I中所含溶质的化学式是_____________ 。
(4)操作a的主要步骤是:加热浓缩、______________ 、过滤洗涤。
(5)流程中,固体X可以选择硫铁矿(FeS2)或_______________ ;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整:
FeS2+
______ +
______ === Fe2++
Fe2++ SO42-+
SO42-+
_______

(1)沸腾炉中,硫铁矿进行粉碎处理的目的是
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是
(3)反应釜中,烧渣经过反应转化为溶液I和固体。
① 烧渣中的FeS在反应中做
② 溶液I中所含溶质的化学式是
(4)操作a的主要步骤是:加热浓缩、
(5)流程中,固体X可以选择硫铁矿(FeS2)或
FeS2+


 Fe2++
Fe2++ SO42-+
SO42-+
您最近一年使用:0次
2016-12-09更新
|
922次组卷
|
7卷引用:辽宁省沈阳市2019-2020 学年高二下学期期末联考化学试题
辽宁省沈阳市2019-2020 学年高二下学期期末联考化学试题河北省承德市围场满族蒙古族自治县卉原中学2022-2023学年高一上学期期末网考化学试题2017届北京市海淀区高三上学期期中化学试卷(已下线)5.1.3 不同价态含硫物质的转化(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)北京市中央民族大学附属中学2022届高三9月月考化学试题山西省长治市第二中学校2021-2022学年高一下学期第一次月考化学试题云南省宣威市第三中学2022-2023学年高一下学期第三次月考化学试题
名校
10 . 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________________ 。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为_________ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为__________ (填化学式)。
③NaH2PO2为___________ (填“正盐”或“酸式盐”)
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:___________________________________ 。
(1)H3PO2是一元中强酸,写出其电离方程式
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为
③NaH2PO2为
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:
您最近一年使用:0次
2016-12-09更新
|
459次组卷
|
2卷引用:2015-2016学年辽宁省抚顺重点高中协作校高二下期末化学试卷



