解题方法
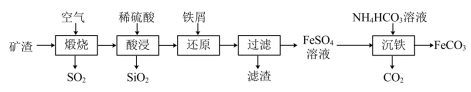
1 . 利用金属矿渣(含有FeS2、SiO2及Cu2O)制备FeCO3的实验流程如下。已知煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。 的反应外,还发生反应的
的反应外,还发生反应的离子方程式 有___________ 、___________ 。
(2)检验Fe3+是否完全被还原的实验操作是___________ 。
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度___________ 。(写出计算过程)
(4)制备 FeCO3.写出“沉铁”步骤发生反应的离子方程式 :___________ 。
 的反应外,还发生反应的
的反应外,还发生反应的(2)检验Fe3+是否完全被还原的实验操作是
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度
(4)制备 FeCO3.写出“沉铁”步骤发生反应的
您最近一年使用:0次
名校
2 . 氨气的燃烧热316.25kJ·mol-1.肼(N2H4)为无色油状液体,有类似于氨的刺鼻气味,是一种强极性化合物。下列说法正确的是
| A.氨气燃烧的热化学方程式:4NH3(g)+3O2(g)=6H2O(g)+2N2(g) ΔH=-1265kJ·mol-1 |
B.HNO2与KMnO4酸性溶液反应:5 +2 +2 +6H+=5 +6H+=5 +2Mn2++3H2O +2Mn2++3H2O |
| C.肼(N2H4)—空气碱性燃料电池的负极反应:N2H4+4e-=4H++N2↑ |
| D.氢氧化铜溶于氨水的化学方程式:Cu(OH)2+4NH3=[Cu(NH3)4](OH)2 |
您最近一年使用:0次
名校
解题方法
3 . 金矿提金采用氰化工艺,产生的含氰废水需处理后才能排放。
(1)氰化工艺中,金溶解于 溶液生成
溶液生成 。
。
①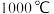 时,
时, 和
和 在催化剂作用下可转化为
在催化剂作用下可转化为 ,
, 与
与 反应可制得
反应可制得 。生成HCN的化学方程式为
。生成HCN的化学方程式为_______ 。
② 含有
含有 键的数目为
键的数目为_______ 。
(2)用 溶液处理含氰废水,使有毒的
溶液处理含氰废水,使有毒的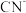 转化为
转化为 等。
等。
①该反应的离子方程式为_______ 。
② 可作为上述反应的催化剂。其他条件相同时,总氰化物(
可作为上述反应的催化剂。其他条件相同时,总氰化物( 等)去除率随溶液初始
等)去除率随溶液初始 变化如图1所示。当溶液初始
变化如图1所示。当溶液初始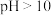 时,总氰化物去除率下降的原因可能是
时,总氰化物去除率下降的原因可能是_______ 。

(3)焦亚硫酸钠 空气法处理含氰废水部分机理如下,其中[0]代表活性氧原子
空气法处理含氰废水部分机理如下,其中[0]代表活性氧原子 。其他条件相同时,总氰化物去除率随
。其他条件相同时,总氰化物去除率随 初始浓度
初始浓度 变化如图2所示。当
变化如图2所示。当 时,总氰化物去除率下降的原因可能是
时,总氰化物去除率下降的原因可能是_______ 。

(4)循环流化床烟气脱硫灰的主要成分有 。为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如下图所示。
。为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如下图所示。

①图3中1100℃时,残留固体主要成分为_______ ;
②在600~630℃时有一个微弱的SO2峰,可能是由于脱硫灰中少量的 分解导致的,写出该分解反应的化学方程式:
分解导致的,写出该分解反应的化学方程式:_______ 。
③对比图3与图4知,图4中370~420℃曲线上升的原因为_______ 。
(1)氰化工艺中,金溶解于
 溶液生成
溶液生成 。
。①
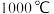 时,
时, 和
和 在催化剂作用下可转化为
在催化剂作用下可转化为 ,
, 与
与 反应可制得
反应可制得 。生成HCN的化学方程式为
。生成HCN的化学方程式为②
 含有
含有 键的数目为
键的数目为(2)用
 溶液处理含氰废水,使有毒的
溶液处理含氰废水,使有毒的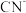 转化为
转化为 等。
等。①该反应的离子方程式为
②
 可作为上述反应的催化剂。其他条件相同时,总氰化物(
可作为上述反应的催化剂。其他条件相同时,总氰化物( 等)去除率随溶液初始
等)去除率随溶液初始 变化如图1所示。当溶液初始
变化如图1所示。当溶液初始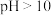 时,总氰化物去除率下降的原因可能是
时,总氰化物去除率下降的原因可能是
(3)焦亚硫酸钠
 空气法处理含氰废水部分机理如下,其中[0]代表活性氧原子
空气法处理含氰废水部分机理如下,其中[0]代表活性氧原子 。其他条件相同时,总氰化物去除率随
。其他条件相同时,总氰化物去除率随 初始浓度
初始浓度 变化如图2所示。当
变化如图2所示。当 时,总氰化物去除率下降的原因可能是
时,总氰化物去除率下降的原因可能是
(4)循环流化床烟气脱硫灰的主要成分有
 。为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如下图所示。
。为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如下图所示。
①图3中1100℃时,残留固体主要成分为
②在600~630℃时有一个微弱的SO2峰,可能是由于脱硫灰中少量的
 分解导致的,写出该分解反应的化学方程式:
分解导致的,写出该分解反应的化学方程式:③对比图3与图4知,图4中370~420℃曲线上升的原因为
您最近一年使用:0次
4 . 卤族元素的化合物在生活、医药、化工中有着重要的用途。
Ⅰ.过氧化氢氧化法制备碘酸钾(KIO3)的方法如图:
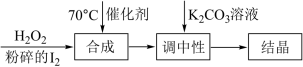
(1)合成步骤的加热方法为______ ,发生反应的化学方程式为____________________ 。
(2)当合成温度高于70℃,碘酸钾产率会降低,写出可能的两种原因:____________________ 。
Ⅱ.ClO2和Cl2都可以用于自来水消毒杀菌,可以通过下列方法制取: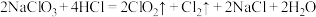
(3)该反应的氧化产物为______ ,若反应过程中有4 mol HCl参与反应,则电子转移的数目为______ 。
Ⅲ.目前从海水中提溴(Br2)大致有“浓缩”、“氧化”、“提取”等步骤。
(4)向浓缩的海水中通入Cl2,将海水中的 氧化为Br2,再用热空气将Br2从溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2,吸收反应的离子方程式为
氧化为Br2,再用热空气将Br2从溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2,吸收反应的离子方程式为____________________ 。
Ⅰ.过氧化氢氧化法制备碘酸钾(KIO3)的方法如图:

(1)合成步骤的加热方法为
(2)当合成温度高于70℃,碘酸钾产率会降低,写出可能的两种原因:
Ⅱ.ClO2和Cl2都可以用于自来水消毒杀菌,可以通过下列方法制取:
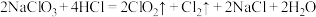
(3)该反应的氧化产物为
Ⅲ.目前从海水中提溴(Br2)大致有“浓缩”、“氧化”、“提取”等步骤。
(4)向浓缩的海水中通入Cl2,将海水中的
 氧化为Br2,再用热空气将Br2从溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2,吸收反应的离子方程式为
氧化为Br2,再用热空气将Br2从溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2,吸收反应的离子方程式为
您最近一年使用:0次
解题方法
5 . 丙烯是重要的有机化合物,具有广泛应用。
Ⅰ.工业上以苯和丙烯为原料合成聚碳酸酯的生产原理如下。
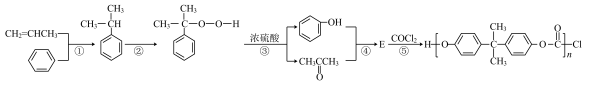
(1)丙酮与水互溶的原因是______ 。
(2)反应②的原子利用率为100%,加入的氧化剂是______ (填分子式)。
(3)蒸馏分离丙酮、苯酚前,需要除去剩余硫酸,最适宜选择______ (选填序号)。
A.NaOH B. C.
C.
(4)E的分子式为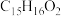 ,则其结构简式为
,则其结构简式为______ 。
Ⅱ.开发新型高效、无毒的催化剂,以丙烯为还原剂脱硝除去NO。
(5)对Mn基催化剂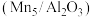 分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、
分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、 的选择性随温度变化曲线分别如图-1、图-2所示。
的选择性随温度变化曲线分别如图-1、图-2所示。
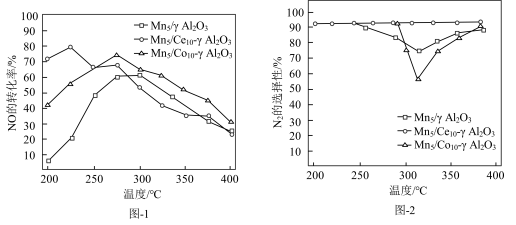
添加助剂______ (选填“Ce”、“Co”)改善催化剂的催化活性效果更加显著。
(6)研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图-3为丙烯脱硝机理。
参与反应,图-3为丙烯脱硝机理。
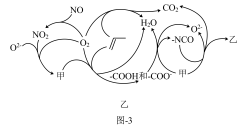
①图中,甲为______ ,乙为______ 。(用化学式表示)
②若参加反应的丙烯与NO物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为______ 。
Ⅰ.工业上以苯和丙烯为原料合成聚碳酸酯的生产原理如下。

(1)丙酮与水互溶的原因是
(2)反应②的原子利用率为100%,加入的氧化剂是
(3)蒸馏分离丙酮、苯酚前,需要除去剩余硫酸,最适宜选择
A.NaOH B.
 C.
C.
(4)E的分子式为
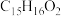 ,则其结构简式为
,则其结构简式为Ⅱ.开发新型高效、无毒的催化剂,以丙烯为还原剂脱硝除去NO。
(5)对Mn基催化剂
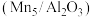 分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、
分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、 的选择性随温度变化曲线分别如图-1、图-2所示。
的选择性随温度变化曲线分别如图-1、图-2所示。
添加助剂
(6)研究表明催化剂添加助剂后催化活性提高的原因是形成活性
 参与反应,图-3为丙烯脱硝机理。
参与反应,图-3为丙烯脱硝机理。
①图中,甲为
②若参加反应的丙烯与NO物质的量之比为
 ,则反应的化学方程式为
,则反应的化学方程式为
您最近一年使用:0次
解题方法
6 . 油气开采、煤化工等行业的硫化氢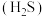 废气转化为
废气转化为 (熔点
(熔点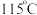 )是资源利用和环境保护的重要研究课题。
)是资源利用和环境保护的重要研究课题。

Ⅰ.高温热分解法: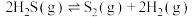
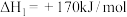
(1) 分解所得
分解所得 ,在低温高压时和氢气反应得到一种新型超导材料(晶胞如图-1所示)。该物质化学式为
,在低温高压时和氢气反应得到一种新型超导材料(晶胞如图-1所示)。该物质化学式为_______ 。
Ⅱ.克劳斯法: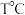 时,
时,
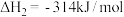
(2)其他条件不变时,相同时间内 的产率随
的产率随 值的变化如图-2所示。当
值的变化如图-2所示。当 时,
时, 产率随
产率随 值增大而减小的可能原因是
值增大而减小的可能原因是_______ 。
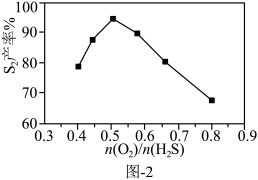
Ⅲ.用 脱除法。
脱除法。
(3)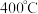 时,将
时,将 和
和 混合气体以一定流速通过装有
混合气体以一定流速通过装有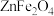 脱硫剂的反应器,得到
脱硫剂的反应器,得到 和
和 。
。
①该反应的化学方程式为_______ 。
②取反应后的固体,在 的混合气体中加热再生,
的混合气体中加热再生, 随温度变化的曲线如图-3所示。在
随温度变化的曲线如图-3所示。在 范围内,固体质量减小的主要原因:(ⅰ)
范围内,固体质量减小的主要原因:(ⅰ) 和
和 被氧化成
被氧化成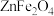 ;(ⅱ)
;(ⅱ)_______ 。

Ⅳ.电化学脱除法
(4)我国科学家设计了 协同转化装置(右侧电解质溶液中含有
协同转化装置(右侧电解质溶液中含有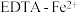 ),实现对天然气中
),实现对天然气中 和
和 的高效去除,工作原理如图-4所示。
的高效去除,工作原理如图-4所示。

①电极 上发生的电极式为
上发生的电极式为_______ 。
②在图-4中,图右侧的反应可描述为_______ 。
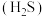 废气转化为
废气转化为 (熔点
(熔点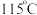 )是资源利用和环境保护的重要研究课题。
)是资源利用和环境保护的重要研究课题。
Ⅰ.高温热分解法:
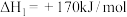
(1)
 分解所得
分解所得 ,在低温高压时和氢气反应得到一种新型超导材料(晶胞如图-1所示)。该物质化学式为
,在低温高压时和氢气反应得到一种新型超导材料(晶胞如图-1所示)。该物质化学式为Ⅱ.克劳斯法:
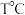 时,
时,
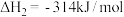
(2)其他条件不变时,相同时间内
 的产率随
的产率随 值的变化如图-2所示。当
值的变化如图-2所示。当 时,
时, 产率随
产率随 值增大而减小的可能原因是
值增大而减小的可能原因是
Ⅲ.用
 脱除法。
脱除法。(3)
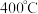 时,将
时,将 和
和 混合气体以一定流速通过装有
混合气体以一定流速通过装有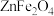 脱硫剂的反应器,得到
脱硫剂的反应器,得到 和
和 。
。①该反应的化学方程式为
②取反应后的固体,在
 的混合气体中加热再生,
的混合气体中加热再生, 随温度变化的曲线如图-3所示。在
随温度变化的曲线如图-3所示。在 范围内,固体质量减小的主要原因:(ⅰ)
范围内,固体质量减小的主要原因:(ⅰ) 和
和 被氧化成
被氧化成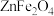 ;(ⅱ)
;(ⅱ)
Ⅳ.电化学脱除法
(4)我国科学家设计了
 协同转化装置(右侧电解质溶液中含有
协同转化装置(右侧电解质溶液中含有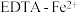 ),实现对天然气中
),实现对天然气中 和
和 的高效去除,工作原理如图-4所示。
的高效去除,工作原理如图-4所示。
①电极
 上发生的电极式为
上发生的电极式为②在图-4中,图右侧的反应可描述为
您最近一年使用:0次
7 . 碱式氯化铜[Cu2(OH)2Cl2·3H2O]为绿色或墨绿色的结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中很稳定。
Ⅰ.模拟制备碱式氯化铜。
向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分加持装置已省略)。
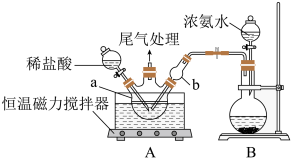
(1)碱式氯化铜中Cu(II)的核外电子排布式为___________ 。
(2)实验室利用装置B制备NH3,圆底烧瓶中盛放的固体药品可能是___________ (填名称)。
(3)反应过程中,需控制盐酸不能过量的原因是___________ 。
(4)反应结束后,将装置A中反应器内的混合物过滤,经提纯得产品无水碱式氯化铜,从滤液中还可以获得的副产品是___________ (填化学式)。
(5)碱式氯化铜[Cu2(OH)2Cl2·3H2O]也可以通过在40℃~50℃,向CuCl悬浊液中持续通空气制得,该反应的化学方程式为___________ 。
Ⅱ.采用沉淀滴定法测定碱式氯化铜中氯含量
(6)请补充完整测定氯的实验过程:取一定量碱式氯化铜固体,溶于稀硝酸,配制成一定体积待测液,准确量取25mL待测液于锥形瓶中,边振荡边向锥形瓶中滴加0.010 mol·L-1AgNO3溶液,直至静置后向上层清液中继续滴加0.010 mol·L-1AgNO3溶液无浑浊产生,记录消耗AgNO3溶液的体积V1,___________ ,重复上述实验2~3次。
已知:①Ag+ + SCN— = AgSCN↓(白色沉淀);②聚乙烯醇可以覆盖在AgCl表面,阻止AgCl转化为AgSCN。[须使用的实验试剂:0.010 mol·L-1NH4SCN标准溶液、Fe(NO3)3溶液、聚乙烯醇]
Ⅰ.模拟制备碱式氯化铜。
向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分加持装置已省略)。

(1)碱式氯化铜中Cu(II)的核外电子排布式为
(2)实验室利用装置B制备NH3,圆底烧瓶中盛放的固体药品可能是
(3)反应过程中,需控制盐酸不能过量的原因是
(4)反应结束后,将装置A中反应器内的混合物过滤,经提纯得产品无水碱式氯化铜,从滤液中还可以获得的副产品是
(5)碱式氯化铜[Cu2(OH)2Cl2·3H2O]也可以通过在40℃~50℃,向CuCl悬浊液中持续通空气制得,该反应的化学方程式为
Ⅱ.采用沉淀滴定法测定碱式氯化铜中氯含量
(6)请补充完整测定氯的实验过程:取一定量碱式氯化铜固体,溶于稀硝酸,配制成一定体积待测液,准确量取25mL待测液于锥形瓶中,边振荡边向锥形瓶中滴加0.010 mol·L-1AgNO3溶液,直至静置后向上层清液中继续滴加0.010 mol·L-1AgNO3溶液无浑浊产生,记录消耗AgNO3溶液的体积V1,
已知:①Ag+ + SCN— = AgSCN↓(白色沉淀);②聚乙烯醇可以覆盖在AgCl表面,阻止AgCl转化为AgSCN。[须使用的实验试剂:0.010 mol·L-1NH4SCN标准溶液、Fe(NO3)3溶液、聚乙烯醇]
您最近一年使用:0次
8 . V2O5-WO3/TiO2催化剂可以催化NH3脱除烟气中的NO,反应为:4NO(g) + 4NH3(g) + O2(g)=4N2(g) + 6H2O(g)  =-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
=-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
已知:NaVO3溶于水,NH4VO3难溶于水。
回答下列问题:
(1)向石煤中加纯碱,在通入空气的条件下焙烧, 转化为
转化为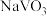 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(2)“沉钒”时加入NH4Cl析出NH4VO3,沉钒温度需控制在50℃左右,温度不能过高的原因为___________ ;在水溶液中VO 水解为H3VO4沉淀的离子方程式为
水解为H3VO4沉淀的离子方程式为___________ 。
(3)还原V2O5可制得VO2,下图为VO2的晶胞,该晶胞中钒的配位数为___________ 。

(4)催化剂的应用。将模拟烟气(含NO、NH3、N2、O2)以一定流速通过装有V2O5-WO3/TiO2催化剂的反应管,反应相同时间,测得NO的转化率随温度的变化如图所示,反应温度高于350℃,NO转化率下降的原因可能是___________ 。

(5)为测定回收所得V2O5样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL (VO2)2SO4溶液,量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000mol·L-1(NH4)2Fe(SO4)2溶液,再用0.01000mol·L-1KMnO4标准溶液滴定至终点,消耗标准溶液24.00mL,滴定过程中发生如下反应:
VO +Fe2++2H+ = VO2++Fe3++H2O;MnO
+Fe2++2H+ = VO2++Fe3++H2O;MnO +5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
+5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
则V2O5样品的纯度为___________ 。(写出计算过程)
 =-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
=-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。已知:NaVO3溶于水,NH4VO3难溶于水。
回答下列问题:
(1)向石煤中加纯碱,在通入空气的条件下焙烧,
 转化为
转化为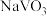 ,该反应的化学方程式为
,该反应的化学方程式为(2)“沉钒”时加入NH4Cl析出NH4VO3,沉钒温度需控制在50℃左右,温度不能过高的原因为
 水解为H3VO4沉淀的离子方程式为
水解为H3VO4沉淀的离子方程式为(3)还原V2O5可制得VO2,下图为VO2的晶胞,该晶胞中钒的配位数为

(4)催化剂的应用。将模拟烟气(含NO、NH3、N2、O2)以一定流速通过装有V2O5-WO3/TiO2催化剂的反应管,反应相同时间,测得NO的转化率随温度的变化如图所示,反应温度高于350℃,NO转化率下降的原因可能是

(5)为测定回收所得V2O5样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL (VO2)2SO4溶液,量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000mol·L-1(NH4)2Fe(SO4)2溶液,再用0.01000mol·L-1KMnO4标准溶液滴定至终点,消耗标准溶液24.00mL,滴定过程中发生如下反应:
VO
 +Fe2++2H+ = VO2++Fe3++H2O;MnO
+Fe2++2H+ = VO2++Fe3++H2O;MnO +5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
+5Fe2++ 8H+ = Mn2++5Fe3++4H2O。则V2O5样品的纯度为
您最近一年使用:0次
解题方法
9 . 碱式碳酸钴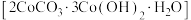 可用于制含钴催化剂。实验小组以某种钴矿(主要含
可用于制含钴催化剂。实验小组以某种钴矿(主要含 及少量
及少量 、
、 )制取碱式碳酸钴的过程如下:
)制取碱式碳酸钴的过程如下:

(1)还原时使用的装置如图所示。 溶液的作用是吸收
溶液的作用是吸收 ,装置A反应后烧瓶溶液中主要存在的阳离子是
,装置A反应后烧瓶溶液中主要存在的阳离子是 、
、 和
和 。写出装置A中
。写出装置A中 所发生反应的化学方程式:
所发生反应的化学方程式:___________ 。
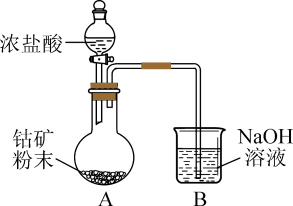
(2)为控制装置A中应加入盐酸的量,需测定钴矿中 的含量。准确称取
的含量。准确称取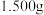 钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应(
钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应( 和
和 不与
不与 反应)。向锥形瓶中滴加2滴淀粉溶液,用
反应)。向锥形瓶中滴加2滴淀粉溶液,用 的
的 标准溶液滴定,恰好完全反应时消耗
标准溶液滴定,恰好完全反应时消耗 标准溶液
标准溶液 。滴定过程中发生的反应为
。滴定过程中发生的反应为 。
。
①滴定终点的现象是___________ ;
②计算钴矿中 的计算钴矿中
的计算钴矿中 的质量分数,并写出计算过程
的质量分数,并写出计算过程___________ 。
(3)补充完整由装置A反应后的溶液提取 的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量
的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量 固体,充分反应;
固体,充分反应;___________ ,得到 溶液。
溶液。
[已知:①在浓 溶液中会发生反应:
溶液中会发生反应: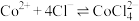 ;②
;②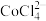 易溶解于一种有机胺溶剂(密度比水小,难溶于水),
易溶解于一种有机胺溶剂(密度比水小,难溶于水), 和
和 不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水]
不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水]
(4)沉钴步骤中的试剂是 溶液和
溶液和 溶液,合理混合得到碱式碳酸钴沉淀。
溶液,合理混合得到碱式碳酸钴沉淀。
①适宜的加料方式为___________ 。
A.将 溶液加入到
溶液加入到 溶液中
溶液中
B.将 溶液加入到
溶液加入到 溶液中
溶液中
②写出沉钴时生成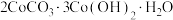 沉淀和
沉淀和 时的离子方程式:
时的离子方程式:___________ 。
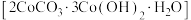 可用于制含钴催化剂。实验小组以某种钴矿(主要含
可用于制含钴催化剂。实验小组以某种钴矿(主要含 及少量
及少量 、
、 )制取碱式碳酸钴的过程如下:
)制取碱式碳酸钴的过程如下:
(1)还原时使用的装置如图所示。
 溶液的作用是吸收
溶液的作用是吸收 ,装置A反应后烧瓶溶液中主要存在的阳离子是
,装置A反应后烧瓶溶液中主要存在的阳离子是 、
、 和
和 。写出装置A中
。写出装置A中 所发生反应的化学方程式:
所发生反应的化学方程式:
(2)为控制装置A中应加入盐酸的量,需测定钴矿中
 的含量。准确称取
的含量。准确称取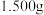 钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应(
钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应( 和
和 不与
不与 反应)。向锥形瓶中滴加2滴淀粉溶液,用
反应)。向锥形瓶中滴加2滴淀粉溶液,用 的
的 标准溶液滴定,恰好完全反应时消耗
标准溶液滴定,恰好完全反应时消耗 标准溶液
标准溶液 。滴定过程中发生的反应为
。滴定过程中发生的反应为 。
。①滴定终点的现象是
②计算钴矿中
 的计算钴矿中
的计算钴矿中 的质量分数,并写出计算过程
的质量分数,并写出计算过程(3)补充完整由装置A反应后的溶液提取
 的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量
的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量 固体,充分反应;
固体,充分反应; 溶液。
溶液。[已知:①在浓
 溶液中会发生反应:
溶液中会发生反应: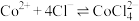 ;②
;②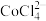 易溶解于一种有机胺溶剂(密度比水小,难溶于水),
易溶解于一种有机胺溶剂(密度比水小,难溶于水), 和
和 不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水]
不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水](4)沉钴步骤中的试剂是
 溶液和
溶液和 溶液,合理混合得到碱式碳酸钴沉淀。
溶液,合理混合得到碱式碳酸钴沉淀。①适宜的加料方式为
A.将
 溶液加入到
溶液加入到 溶液中
溶液中B.将
 溶液加入到
溶液加入到 溶液中
溶液中②写出沉钴时生成
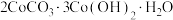 沉淀和
沉淀和 时的离子方程式:
时的离子方程式:
您最近一年使用:0次
解题方法
10 . 铁、钴、镍被称为铁系元素,应用广泛。高铁酸钾(K2FeO4)是一种环境友好型水处理剂,可先用Fe(OH)3和NaClO在碱性条件下反应生成Na2FeO4,再与KOH反应制备。铁系元素能形成多种配合物,如(NH3)2Fe(SO4)2·6H2O、[Co(NH3)6]Cl3、Ni(CO)4等,其中Ni(CO)4常温下为液态,熔点低,易溶于CCl4、苯等有机溶剂,在200℃分解Ni(CO)4可制备高纯Ni。下列化学反应表示不正确 的是
A.用FeCl3溶液与氨水制备Fe(OH)3的离子方程式: |
B.用Cl2和NaOH溶液制备NaClO的离子方程式: |
C.制备Na2FeO4的离子方程式: |
D.分解Ni(CO)4制备高纯Ni: |
您最近一年使用:0次



