名校
1 . 研究氨的制备、应用及氨氮的去除有重要意义。
(1)在固定体积的密闭容器中,进行如下化学反应: ,其平衡常数K与温度T的关系如下表。
,其平衡常数K与温度T的关系如下表。
①试判断
_______  (填写“>”“=”或“<”)
(填写“>”“=”或“<”)
②一定温度下,在 密闭容器中充入
密闭容器中充入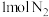 和
和 并发生反应。若容器容积恒定,
并发生反应。若容器容积恒定, 达到平衡时,气体的总物质的量为原来的
达到平衡时,气体的总物质的量为原来的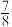 ,则
,则 的转化率
的转化率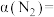
_______ ,以 表示该过程的反应速率
表示该过程的反应速率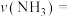
_______ 。
(2)氨的应用。以 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:
I. 和
和 生成
生成 ;
;
Ⅱ. 分解生成
分解生成 。
。
反应过程中能量变化如图所示。 和
和 合成尿素反应的热化学方程式为
合成尿素反应的热化学方程式为_______ 。
②结合反应过程中能量变化示意图,下列说法正确的是_______ (填序号)。
a.活化能:反应I<反应Ⅱ
b.I为放热反应,Ⅱ为吸热反应
c.对总反应速率影响较大的是反应I
(3)氨氮的去除。下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
有研究表明,当以碳材料为阴极, 可在阴极生成
可在阴极生成 ,并进一步生成氧化性更强的
,并进一步生成氧化性更强的 ,
, 可以将水中氨氮氧化为
可以将水中氨氮氧化为 。
。
①写出 去除氨气的化学反应方程式
去除氨气的化学反应方程式_______ 。
②阴极区加入 可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释
可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释 的作用
的作用_______ 。
用 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。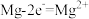 ,
, 。写出废水中生成
。写出废水中生成 沉淀的离子方程式:
沉淀的离子方程式:_______ 。
④反应1h以后,氨氮去除率随时间的延长反而下降的原因是_______ 。
(1)在固定体积的密闭容器中,进行如下化学反应:
 ,其平衡常数K与温度T的关系如下表。
,其平衡常数K与温度T的关系如下表。| T/K | 298 | 398 | 498 |
| 平衡常数K | 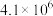 |  |  |

 (填写“>”“=”或“<”)
(填写“>”“=”或“<”)②一定温度下,在
 密闭容器中充入
密闭容器中充入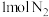 和
和 并发生反应。若容器容积恒定,
并发生反应。若容器容积恒定, 达到平衡时,气体的总物质的量为原来的
达到平衡时,气体的总物质的量为原来的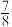 ,则
,则 的转化率
的转化率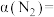
 表示该过程的反应速率
表示该过程的反应速率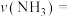
(2)氨的应用。以
 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:I.
 和
和 生成
生成 ;
;Ⅱ.
 分解生成
分解生成 。
。反应过程中能量变化如图所示。

 和
和 合成尿素反应的热化学方程式为
合成尿素反应的热化学方程式为②结合反应过程中能量变化示意图,下列说法正确的是
a.活化能:反应I<反应Ⅱ
b.I为放热反应,Ⅱ为吸热反应
c.对总反应速率影响较大的是反应I
(3)氨氮的去除。下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
有研究表明,当以碳材料为阴极,
 可在阴极生成
可在阴极生成 ,并进一步生成氧化性更强的
,并进一步生成氧化性更强的 ,
, 可以将水中氨氮氧化为
可以将水中氨氮氧化为 。
。①写出
 去除氨气的化学反应方程式
去除氨气的化学反应方程式②阴极区加入
 可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释
可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释 的作用
的作用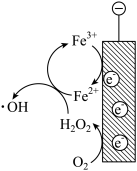
用
 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。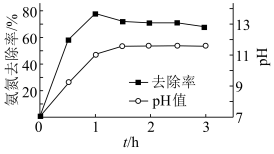
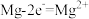 ,
, 。写出废水中生成
。写出废水中生成 沉淀的离子方程式:
沉淀的离子方程式:④反应1h以后,氨氮去除率随时间的延长反而下降的原因是
您最近半年使用:0次
解题方法
2 . 氯酸镁[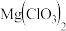 ]常用作催熟剂、除草剂等,实验室制备少量
]常用作催熟剂、除草剂等,实验室制备少量 的流程如下:
的流程如下: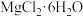 ,含有
,含有 、
、 等杂质。
等杂质。
②四种化合物的溶解度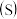 随温度
随温度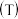 变化曲线如图2所示。
变化曲线如图2所示。
(1)加速卤块在 溶液中溶解的措施有:
溶液中溶解的措施有:_______ (任写一点)。
(2)加入 的作用是
的作用是_______ ,滤渣的成分_______ ,此时滤液中c(Fe3+) = ______ mol/L。(已知: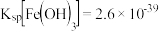 )
)
(3)加入 饱和溶液后发生反应的化学方程式为
饱和溶液后发生反应的化学方程式为________ (溶解度低的物质以沉淀形式析出),再进一步制 晶体的实验步骤依次为:
晶体的实验步骤依次为:
①加热蒸发;②_______ ;①______ ;④过滤洗涤。
产品中 含量的测定:
含量的测定:
步骤 :准确称量
:准确称量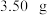 产品配成
产品配成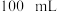 溶液。
溶液。
步骤 :取
:取 试液于锥形瓶中,加入
试液于锥形瓶中,加入 稀硫酸和
稀硫酸和 的
的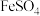 溶液,微热。
溶液,微热。
步骤 :冷却至室温,用
:冷却至室温,用 溶液滴定剩余的
溶液滴定剩余的 至终点。此过程中反应的离子方程式为:
至终点。此过程中反应的离子方程式为: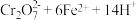 →
→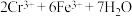 。
。
步骤 :将步骤
:将步骤 、
、 重复两次
重复两次
(4)①写出步骤 中发生反应的离子方程式:
中发生反应的离子方程式:________ 。
②步骤 中若滴定前不用标准液润洗滴定管,将会导致最终结果
中若滴定前不用标准液润洗滴定管,将会导致最终结果_____  填“偏大”、“偏小”或“不变”
填“偏大”、“偏小”或“不变” ;
;
(5)若平均消耗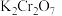 溶液
溶液 ,则产品中
,则产品中 的质量分数为
的质量分数为_______ 。(写出必要的计算过程)
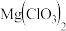 ]常用作催熟剂、除草剂等,实验室制备少量
]常用作催熟剂、除草剂等,实验室制备少量 的流程如下:
的流程如下: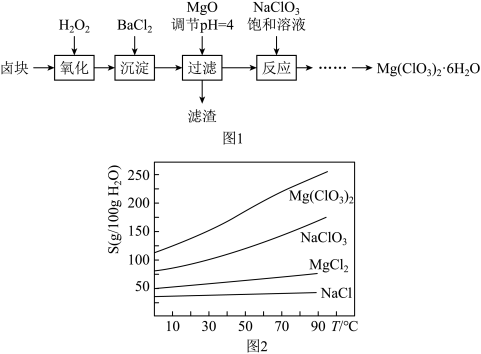
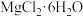 ,含有
,含有 、
、 等杂质。
等杂质。②四种化合物的溶解度
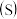 随温度
随温度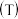 变化曲线如图2所示。
变化曲线如图2所示。(1)加速卤块在
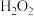 溶液中溶解的措施有:
溶液中溶解的措施有:(2)加入
 的作用是
的作用是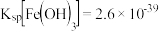 )
)(3)加入
 饱和溶液后发生反应的化学方程式为
饱和溶液后发生反应的化学方程式为 晶体的实验步骤依次为:
晶体的实验步骤依次为:①加热蒸发;②
产品中
 含量的测定:
含量的测定:步骤
 :准确称量
:准确称量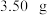 产品配成
产品配成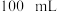 溶液。
溶液。步骤
 :取
:取 试液于锥形瓶中,加入
试液于锥形瓶中,加入 稀硫酸和
稀硫酸和 的
的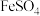 溶液,微热。
溶液,微热。步骤
 :冷却至室温,用
:冷却至室温,用 溶液滴定剩余的
溶液滴定剩余的 至终点。此过程中反应的离子方程式为:
至终点。此过程中反应的离子方程式为: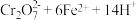 →
→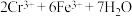 。
。步骤
 :将步骤
:将步骤 、
、 重复两次
重复两次(4)①写出步骤
 中发生反应的离子方程式:
中发生反应的离子方程式:②步骤
 中若滴定前不用标准液润洗滴定管,将会导致最终结果
中若滴定前不用标准液润洗滴定管,将会导致最终结果 填“偏大”、“偏小”或“不变”
填“偏大”、“偏小”或“不变” ;
;(5)若平均消耗
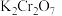 溶液
溶液 ,则产品中
,则产品中 的质量分数为
的质量分数为
您最近半年使用:0次
3 . 不同催化剂作用下NH3还原NOx的机理与效果是研究烟气(含NOx、O2、N2等)脱硝的热点。
(1)NH3还原NO的主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)。
已知:N2(g)+O2(g)=2NO(g)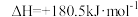 ;4NH3(g)+3O2(g)=2N2(g)+6H2O(g)
;4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 
上述主反应的
____ 。
(2)在某钒催化剂中添加一定量Cu2O可加快NO的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物种未画出)。____ 。
②烟气中若含有SO2,会生成NH4HSO4堵塞催化剂孔道。生成NH4HSO4的化学方程式为____ 。
(3)将模拟烟气(一定比例NOx、NH3、O2和N2)以一定流速通过装有Fe/Zr催化剂的反应管,测得NOx转化率随温度变化的曲线如图所示。_____ 。
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是____ 。
(1)NH3还原NO的主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)。
已知:N2(g)+O2(g)=2NO(g)
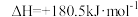 ;4NH3(g)+3O2(g)=2N2(g)+6H2O(g)
;4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 
上述主反应的

(2)在某钒催化剂中添加一定量Cu2O可加快NO的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物种未画出)。
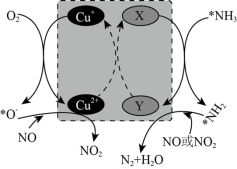
②烟气中若含有SO2,会生成NH4HSO4堵塞催化剂孔道。生成NH4HSO4的化学方程式为
(3)将模拟烟气(一定比例NOx、NH3、O2和N2)以一定流速通过装有Fe/Zr催化剂的反应管,测得NOx转化率随温度变化的曲线如图所示。
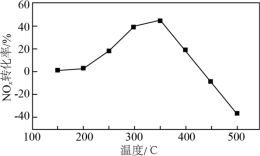
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是
您最近半年使用:0次
解题方法
4 . 以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
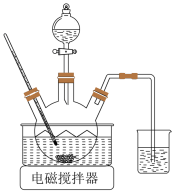
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入三颈瓶中(如图)。70℃下通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是_______ ;MnO2转化为Mn2+的离子方程式为_______ 。 =
=_____ [Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)写出基态Mn核外价层电子排布式___________ 。
(4)制备MnCO3。在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为_______ 。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入三颈瓶中(如图)。70℃下通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是
 =
=(3)写出基态Mn核外价层电子排布式
(4)制备MnCO3。在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为
您最近半年使用:0次
名校
5 . 高砷煤中含有砷硫铁(FeAsS)等物质。燃煤产生的烟气中含NO、SO2、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
(1)燃煤固硫
①燃用高砷煤时加入生石灰将大部分硫元素转化为___________ (填化学式)留在煤渣中。
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成As2O3释放到烟气中,该反应的化学方程式为___________ 。
(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将NH3、NO、O2转化为N2.烟气中含有的As2O3会使钒氧化物催化剂中毒。
①在SCR脱硝的反应中还原剂为___________ (填化学式)。
②研究发现砷中毒机理主要是As2O3分子破坏了催化剂的Lewis酸位点,使V=O数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构。___________ 。
(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量(NH3或铵盐)会影响水泥的性能。
取50.00 g粉煤灰加入NaOH蒸出NH3,用20 mL 0.100 0 mol·L-1的H2SO4溶液吸收NH3,用0.200 0 mol·L-1 NaOH溶液滴定过量的H2SO4至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以NH3计的氨含量(用mg·g-1表示,写出计算过程)。___________
(1)燃煤固硫
①燃用高砷煤时加入生石灰将大部分硫元素转化为
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成As2O3释放到烟气中,该反应的化学方程式为
(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将NH3、NO、O2转化为N2.烟气中含有的As2O3会使钒氧化物催化剂中毒。
①在SCR脱硝的反应中还原剂为
②研究发现砷中毒机理主要是As2O3分子破坏了催化剂的Lewis酸位点,使V=O数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构。
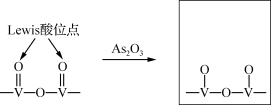
(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量(NH3或铵盐)会影响水泥的性能。
取50.00 g粉煤灰加入NaOH蒸出NH3,用20 mL 0.100 0 mol·L-1的H2SO4溶液吸收NH3,用0.200 0 mol·L-1 NaOH溶液滴定过量的H2SO4至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以NH3计的氨含量(用mg·g-1表示,写出计算过程)。
您最近半年使用:0次
名校
6 . 氮、磷及其化合物应用广泛。磷元素有白磷、红磷等单质,白磷(P4)分子结构及晶胞如下图所示,实验室常用CuSO4溶液吸收有毒气体PH3,生成H3PO4、H2SO4和Cu。P元素可形成多种含氧酸,其中次磷酸(H3PO2)为一元弱酸;磷酸可与铁反应,在金属表面生成致密且难溶于水的磷酸盐膜。

| A.用氨水和AlCl3溶液制备Al(OH)3:Al3++3OH-=Al(OH)3↓ |
| B.工业上用足量氨水吸收SO2:NH3·H2O+SO2=NH4HSO3 |
| C.用CuSO4溶液吸收PH3:PH3+4CuSO4+4H2O=4Cu↓+H3PO4+4H2SO4 |
| D.次磷酸与足量NaOH溶液反应:H3PO2+3NaOH=Na3PO2+3H2O |
您最近半年使用:0次
名校
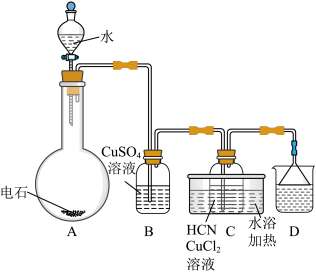
7 . 丙烯腈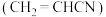 是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与
是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与 反应制得。原理如下HC≡CH+HCN
反应制得。原理如下HC≡CH+HCN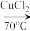 CH2=CHCN
CH2=CHCN
Ⅰ.制备催化剂
(1)通过查阅资料有两种方案可以制备
方案1:铜屑与 在浓盐酸中反应
在浓盐酸中反应
方案2:铜丝在氯气中燃烧
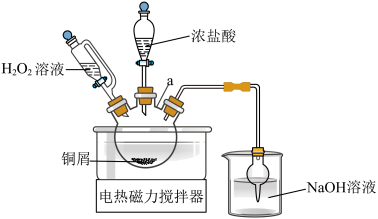
方案1的实验原理如图所示 的名称
的名称___________ 。
②请用离子方程式表达,写出方案1的反应原理___________ 。
(2)用恒压滴液漏斗分批多次滴加 ,且
,且 过量,原因是
过量,原因是___________ 。
(3)方案2燃烧后的固体溶于水,过滤后发现一些白色固体 ,为检测
,为检测 的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测
的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测 为
为___________ 。
Ⅱ.合成丙烯腈 ,还含有少量硫化钙
,还含有少量硫化钙
②易挥发,有毒,具有较强的还原性
(4) 的电子式
的电子式___________ 。
(5)纯净的乙炔是无色、无臭的气体。但用电石制取的乙炔时常伴有臭鸡蛋气味,这种物质是___________ 。
(6)从下列选择装置D中可盛放的溶液___________。
(7)工业用 含
含 质量分数
质量分数 的电石,实际生产得到丙烯腈
的电石,实际生产得到丙烯腈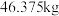 ,计算产率
,计算产率_______ 。(写出计算过程)
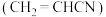 是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与
是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与 反应制得。原理如下HC≡CH+HCN
反应制得。原理如下HC≡CH+HCN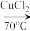 CH2=CHCN
CH2=CHCNⅠ.制备催化剂

(1)通过查阅资料有两种方案可以制备
方案1:铜屑与
 在浓盐酸中反应
在浓盐酸中反应方案2:铜丝在氯气中燃烧
方案1的实验原理如图所示
 的名称
的名称②请用离子方程式表达,写出方案1的反应原理
(2)用恒压滴液漏斗分批多次滴加
 ,且
,且 过量,原因是
过量,原因是(3)方案2燃烧后的固体溶于水,过滤后发现一些白色固体
 ,为检测
,为检测 的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测
的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测 为
为Ⅱ.合成丙烯腈
 ,还含有少量硫化钙
,还含有少量硫化钙②易挥发,有毒,具有较强的还原性
(4)
 的电子式
的电子式(5)纯净的乙炔是无色、无臭的气体。但用电石制取的乙炔时常伴有臭鸡蛋气味,这种物质是
(6)从下列选择装置D中可盛放的溶液___________。
| A.高锰酸钾溶液 | B. 溶液 溶液 | C.饱和食盐水 | D.盐酸溶液 |
(7)工业用
 含
含 质量分数
质量分数 的电石,实际生产得到丙烯腈
的电石,实际生产得到丙烯腈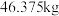 ,计算产率
,计算产率
您最近半年使用:0次
名校
解题方法
8 . 有效去除大气中的NOx和水体中的氮,并且转化为可利用的资源是重要课题。
(1)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=_______ kJ·mol-1
(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。_______ (请填“C”或“D”)极相连。
②该电解池的阳极反应式为_______ 。
③该电解池(图乙)中离子交换膜为_______ (请填“阴”或“阳”)离子交换膜。
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)_______ mol。
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的活化能。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮( 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。_______ 。
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是_______ 。
(1)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: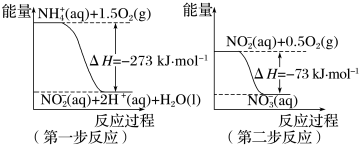
 (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。
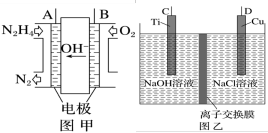
②该电解池的阳极反应式为
③该电解池(图乙)中离子交换膜为
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
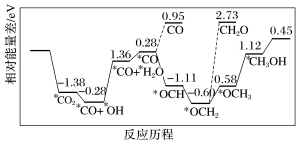
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(
 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。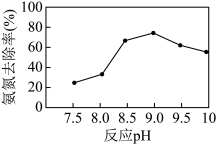
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是
您最近半年使用:0次
解题方法
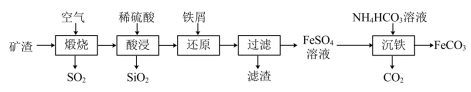
9 . 利用金属矿渣(含有FeS2、SiO2及Cu2O)制备FeCO3的实验流程如下。已知煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。 的反应外,还发生反应的
的反应外,还发生反应的离子方程式 有___________ 、___________ 。
(2)检验Fe3+是否完全被还原的实验操作是___________ 。
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度___________ 。(写出计算过程)
(4)制备 FeCO3.写出“沉铁”步骤发生反应的离子方程式 :___________ 。
 的反应外,还发生反应的
的反应外,还发生反应的(2)检验Fe3+是否完全被还原的实验操作是
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度
(4)制备 FeCO3.写出“沉铁”步骤发生反应的
您最近半年使用:0次
名校
解题方法
10 . 钼(Mo)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
(1) 元素的基态原子核外电子排布式为
元素的基态原子核外电子排布式为_______ 。
(2)“焙烧”中生成 的化学方程式为
的化学方程式为_______ 。
(3) 实验用量与理论用量的比值为1.0、1.1、1.2、1.3时,
实验用量与理论用量的比值为1.0、1.1、1.2、1.3时, 的浸出率和
的浸出率和 残留浓度的变化如图所示,则
残留浓度的变化如图所示,则 的最佳用量比为
的最佳用量比为_______ ,结合图1中信息说明理由:_______ 。 、
、 的溶解度曲线如图所示,为充分分离
的溶解度曲线如图所示,为充分分离 ,工艺流程中的“操作X”应为
,工艺流程中的“操作X”应为_______ (填标号)。
(5)锂化二硫化钼纳米片可用于高性能锂硫电池,其工作原理为: ,放电时负极的电极反应式为
,放电时负极的电极反应式为_______ 。
 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下: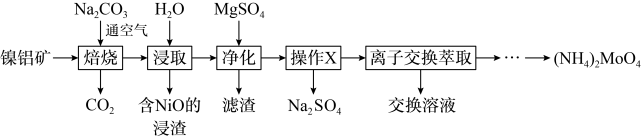
(1)
 元素的基态原子核外电子排布式为
元素的基态原子核外电子排布式为(2)“焙烧”中生成
 的化学方程式为
的化学方程式为(3)
 实验用量与理论用量的比值为1.0、1.1、1.2、1.3时,
实验用量与理论用量的比值为1.0、1.1、1.2、1.3时, 的浸出率和
的浸出率和 残留浓度的变化如图所示,则
残留浓度的变化如图所示,则 的最佳用量比为
的最佳用量比为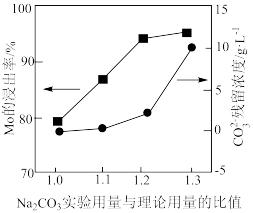
 、
、 的溶解度曲线如图所示,为充分分离
的溶解度曲线如图所示,为充分分离 ,工艺流程中的“操作X”应为
,工艺流程中的“操作X”应为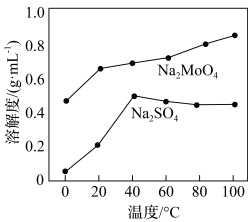
(5)锂化二硫化钼纳米片可用于高性能锂硫电池,其工作原理为:
 ,放电时负极的电极反应式为
,放电时负极的电极反应式为
您最近半年使用:0次



