1 . 实验室以 废渣(含少量Ca、Mg的氧化物)为原料制备
废渣(含少量Ca、Mg的氧化物)为原料制备 的部分实验过程如下:
的部分实验过程如下: 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为__________ 。
(2)“除 、
、 ”时,所得溶液中
”时,所得溶液中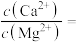
__________ 。[已知: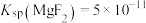 ,
,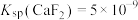 ]。
]。
(3)“沉锰”时, 溶液做“沉锰”试剂。
溶液做“沉锰”试剂。
① 的水溶液呈
的水溶液呈__________ (填“酸性”或“碱性”或“中性”)。(已知: 的
的 ,
, ,
, 的
的 )
)
②此过程需控制温度低于70℃,该过程不宜在较高温度下进行的原因是__________ 。
(4)“加热氧化”时, 发生反应生成
发生反应生成 ,该反应的化学方程式为
,该反应的化学方程式为__________ 。
(5)“焙烧”时, 生成活性
生成活性 ;实验室也可由
;实验室也可由 固体制取活性
固体制取活性 。如图为不同温度下硫酸锰焙烧2小时后残留固体中含锰产物的XRD图谱(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
。如图为不同温度下硫酸锰焙烧2小时后残留固体中含锰产物的XRD图谱(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。 固体制取活性
固体制取活性 的实验方案:将
的实验方案:将 固体置于可控制温度的反应管中,
固体置于可控制温度的反应管中,__________ ,将 冷却、研磨、密封包装。(须使用的试剂:
冷却、研磨、密封包装。(须使用的试剂: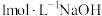 溶液)
溶液)
 废渣(含少量Ca、Mg的氧化物)为原料制备
废渣(含少量Ca、Mg的氧化物)为原料制备 的部分实验过程如下:
的部分实验过程如下:
 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为(2)“除
 、
、 ”时,所得溶液中
”时,所得溶液中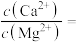
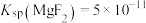 ,
,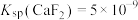 ]。
]。(3)“沉锰”时,
 溶液做“沉锰”试剂。
溶液做“沉锰”试剂。①
 的水溶液呈
的水溶液呈 的
的 ,
, ,
, 的
的 )
)②此过程需控制温度低于70℃,该过程不宜在较高温度下进行的原因是
(4)“加热氧化”时,
 发生反应生成
发生反应生成 ,该反应的化学方程式为
,该反应的化学方程式为(5)“焙烧”时,
 生成活性
生成活性 ;实验室也可由
;实验室也可由 固体制取活性
固体制取活性 。如图为不同温度下硫酸锰焙烧2小时后残留固体中含锰产物的XRD图谱(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
。如图为不同温度下硫酸锰焙烧2小时后残留固体中含锰产物的XRD图谱(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。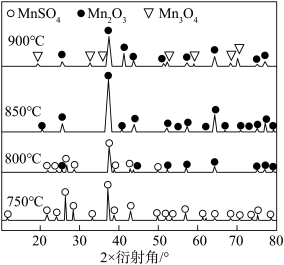
 固体制取活性
固体制取活性 的实验方案:将
的实验方案:将 固体置于可控制温度的反应管中,
固体置于可控制温度的反应管中, 冷却、研磨、密封包装。(须使用的试剂:
冷却、研磨、密封包装。(须使用的试剂: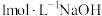 溶液)
溶液)
您最近一年使用:0次
解题方法
2 . 某研究团队利用二氧化氯液相氧化协同氨法对锅炉产生的烟气(主要成分NO、SO2、N2)进行脱硫、脱硝研究。
(1)二氧化氯制备。研究中采用盐酸还原氯酸钠制备ClO2,在生成ClO2的同时还生成Cl2;该反应的化学反应方程式为__________ 。
(2)二氧化氯液相氧化协同氨法脱除。研究中首先用制备的ClO2气体配制浓度为150mg/L的ClO2溶液,接着向浓度为0.3%的氨水吸收液中添加浓度为150mg/L的ClO2溶液,组成复合吸收液来对模拟烟气中NO和SO2同时脱除。脱除时NO发生反应: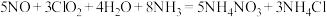 。
。
①脱除时SO2发生反应的离子方程式为__________ 。
②脱除过程中采用如图所示喷淋吸收塔装置吸收SO2和NO,采用该装置吸收的优点是__________ 。__________ 。__________ 。
②在50℃下,若烟气中SO2和NO体积比为4:5,吸收液中烟气转化生成的 、
、 、
、 的物质的量之比为
的物质的量之比为__________ 。
③列举一条用二氧化氯液相氧化协同氨法“脱硫”、“脱硝”的优点__________ 。
(1)二氧化氯制备。研究中采用盐酸还原氯酸钠制备ClO2,在生成ClO2的同时还生成Cl2;该反应的化学反应方程式为
(2)二氧化氯液相氧化协同氨法脱除。研究中首先用制备的ClO2气体配制浓度为150mg/L的ClO2溶液,接着向浓度为0.3%的氨水吸收液中添加浓度为150mg/L的ClO2溶液,组成复合吸收液来对模拟烟气中NO和SO2同时脱除。脱除时NO发生反应:
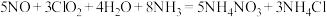 。
。①脱除时SO2发生反应的离子方程式为
②脱除过程中采用如图所示喷淋吸收塔装置吸收SO2和NO,采用该装置吸收的优点是
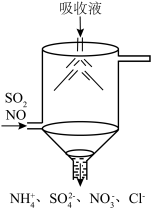
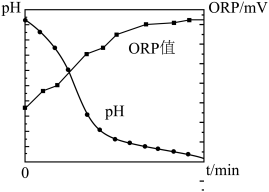
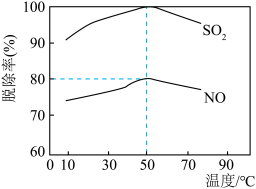
②在50℃下,若烟气中SO2和NO体积比为4:5,吸收液中烟气转化生成的
 、
、 、
、 的物质的量之比为
的物质的量之比为③列举一条用二氧化氯液相氧化协同氨法“脱硫”、“脱硝”的优点
您最近一年使用:0次
名校
解题方法
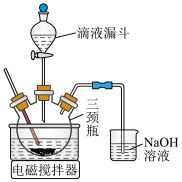
3 . 实验室以软锰矿粉(含MnO2及少量Fe、Al、Si、Mg等的氧化物)为原料制备MnSO4·H2O,其实验过程可表示为_______ ;_______ (填“a”或“b”);
a.稀硫酸 b.Na2SO3溶液
③加料完成后,以一定速率搅拌反应,提高锰元素浸出率的方法还有_______ 。
Mn2+的萃取率( )
) 。
。
①萃取时,在一定温度和pH下,Mn2+在有机层和水层中的浓度之比称为分配比(用D表示,为常数)。若25℃、PH=a时,分配比D=10,现用20mlHA萃取100ml含Mn2+溶液,按两种方法进行萃取:Ⅰ.用20mlHA萃取一次;Ⅱ.分两次萃取,每次用10mlHA,试通过计算说明哪种方法更好?_______ (写出计算过程)。
②反萃取是利用稀硫酸将有机层中的Mn2+转移到水层,需将稀硫酸和有机层共同加入到分液漏斗中进行实验操作。为使Mn2+尽可能多地发生上述转移,应选择的实验条件或采取的操作有_______ (填序号)。
A.适当提高H2SO4浓度 B.加足量蒸馏水 C.用适量稀硫酸分多次反萃取 D.充分振荡
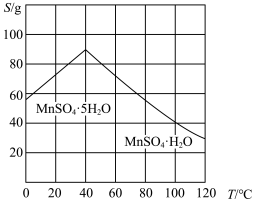
(3)制取MnSO4·H2O晶体。补充完整制取MnSO4·H2O晶体的实验方案:向含有少量Fe3+、Al3+的MnSO4溶液中,_______ ,在真空干燥箱中低温干燥,得到MnSO4·H2O。(已知:Fe3+、Al3+在 时完全转化为氢氧化物沉淀:MnSO4·H2O的溶解度曲线如右上图所示;实验中须使用的试剂有:MnCO3粉末、无水乙醇)
时完全转化为氢氧化物沉淀:MnSO4·H2O的溶解度曲线如右上图所示;实验中须使用的试剂有:MnCO3粉末、无水乙醇)
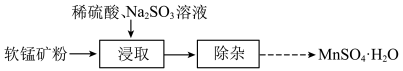
a.稀硫酸 b.Na2SO3溶液
③加料完成后,以一定速率搅拌反应,提高锰元素浸出率的方法还有
Mn2+的萃取率(
 )
) 。
。①萃取时,在一定温度和pH下,Mn2+在有机层和水层中的浓度之比称为分配比(用D表示,为常数)。若25℃、PH=a时,分配比D=10,现用20mlHA萃取100ml含Mn2+溶液,按两种方法进行萃取:Ⅰ.用20mlHA萃取一次;Ⅱ.分两次萃取,每次用10mlHA,试通过计算说明哪种方法更好?
②反萃取是利用稀硫酸将有机层中的Mn2+转移到水层,需将稀硫酸和有机层共同加入到分液漏斗中进行实验操作。为使Mn2+尽可能多地发生上述转移,应选择的实验条件或采取的操作有
A.适当提高H2SO4浓度 B.加足量蒸馏水 C.用适量稀硫酸分多次反萃取 D.充分振荡
(3)制取MnSO4·H2O晶体。补充完整制取MnSO4·H2O晶体的实验方案:向含有少量Fe3+、Al3+的MnSO4溶液中,
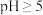 时完全转化为氢氧化物沉淀:MnSO4·H2O的溶解度曲线如右上图所示;实验中须使用的试剂有:MnCO3粉末、无水乙醇)
时完全转化为氢氧化物沉淀:MnSO4·H2O的溶解度曲线如右上图所示;实验中须使用的试剂有:MnCO3粉末、无水乙醇)
您最近一年使用:0次
名校
4 . 已知25℃时,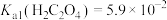 ,
,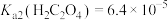 。为探究
。为探究 溶液的性质,进行如下实验:
溶液的性质,进行如下实验:
①测定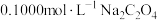 溶液pH为8.4;
溶液pH为8.4;
②向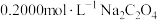 溶液中滴加等浓度等体积盐酸,无明显现象;
溶液中滴加等浓度等体积盐酸,无明显现象;
③向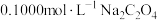 溶液中,滴加等浓度的盐酸至溶液
溶液中,滴加等浓度的盐酸至溶液 ;
;
④向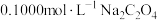 溶液中滴加几滴酸性
溶液中滴加几滴酸性 溶液,振荡,溶液仍为无色。
溶液,振荡,溶液仍为无色。
下列说法不正确的是
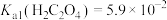 ,
,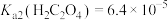 。为探究
。为探究 溶液的性质,进行如下实验:
溶液的性质,进行如下实验:①测定
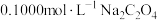 溶液pH为8.4;
溶液pH为8.4;②向
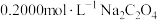 溶液中滴加等浓度等体积盐酸,无明显现象;
溶液中滴加等浓度等体积盐酸,无明显现象;③向
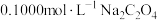 溶液中,滴加等浓度的盐酸至溶液
溶液中,滴加等浓度的盐酸至溶液 ;
;④向
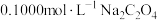 溶液中滴加几滴酸性
溶液中滴加几滴酸性 溶液,振荡,溶液仍为无色。
溶液,振荡,溶液仍为无色。下列说法不正确的是
A.实验①溶液中存在: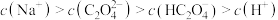 |
B.实验②所得溶液中: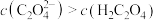 |
C.实验③所得溶液中存在: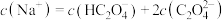 |
D.实验④中 被还原成 被还原成 ,则反应的离子方程式为 ,则反应的离子方程式为 |
您最近一年使用:0次
解题方法
5 . 碱式碳酸钴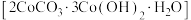 可用于制含钴催化剂。实验小组以某种钴矿(主要含
可用于制含钴催化剂。实验小组以某种钴矿(主要含 及少量
及少量 、
、 )制取碱式碳酸钴的过程如下:
)制取碱式碳酸钴的过程如下:

(1)还原时使用的装置如图所示。 溶液的作用是吸收
溶液的作用是吸收 ,装置A反应后烧瓶溶液中主要存在的阳离子是
,装置A反应后烧瓶溶液中主要存在的阳离子是 、
、 和
和 。写出装置A中
。写出装置A中 所发生反应的化学方程式:
所发生反应的化学方程式:___________ 。
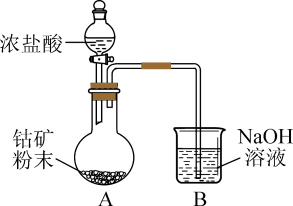
(2)为控制装置A中应加入盐酸的量,需测定钴矿中 的含量。准确称取
的含量。准确称取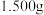 钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应(
钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应( 和
和 不与
不与 反应)。向锥形瓶中滴加2滴淀粉溶液,用
反应)。向锥形瓶中滴加2滴淀粉溶液,用 的
的 标准溶液滴定,恰好完全反应时消耗
标准溶液滴定,恰好完全反应时消耗 标准溶液
标准溶液 。滴定过程中发生的反应为
。滴定过程中发生的反应为 。
。
①滴定终点的现象是___________ ;
②计算钴矿中 的计算钴矿中
的计算钴矿中 的质量分数,并写出计算过程
的质量分数,并写出计算过程___________ 。
(3)补充完整由装置A反应后的溶液提取 的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量
的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量 固体,充分反应;
固体,充分反应;___________ ,得到 溶液。
溶液。
[已知:①在浓 溶液中会发生反应:
溶液中会发生反应: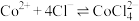 ;②
;② 易溶解于一种有机胺溶剂(密度比水小,难溶于水),
易溶解于一种有机胺溶剂(密度比水小,难溶于水), 和
和 不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水]
不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水]
(4)沉钴步骤中的试剂是 溶液和
溶液和 溶液,合理混合得到碱式碳酸钴沉淀。
溶液,合理混合得到碱式碳酸钴沉淀。
①适宜的加料方式为___________ 。
A.将 溶液加入到
溶液加入到 溶液中
溶液中
B.将 溶液加入到
溶液加入到 溶液中
溶液中
②写出沉钴时生成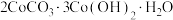 沉淀和
沉淀和 时的离子方程式:
时的离子方程式:___________ 。
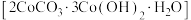 可用于制含钴催化剂。实验小组以某种钴矿(主要含
可用于制含钴催化剂。实验小组以某种钴矿(主要含 及少量
及少量 、
、 )制取碱式碳酸钴的过程如下:
)制取碱式碳酸钴的过程如下:
(1)还原时使用的装置如图所示。
 溶液的作用是吸收
溶液的作用是吸收 ,装置A反应后烧瓶溶液中主要存在的阳离子是
,装置A反应后烧瓶溶液中主要存在的阳离子是 、
、 和
和 。写出装置A中
。写出装置A中 所发生反应的化学方程式:
所发生反应的化学方程式:
(2)为控制装置A中应加入盐酸的量,需测定钴矿中
 的含量。准确称取
的含量。准确称取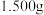 钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应(
钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应( 和
和 不与
不与 反应)。向锥形瓶中滴加2滴淀粉溶液,用
反应)。向锥形瓶中滴加2滴淀粉溶液,用 的
的 标准溶液滴定,恰好完全反应时消耗
标准溶液滴定,恰好完全反应时消耗 标准溶液
标准溶液 。滴定过程中发生的反应为
。滴定过程中发生的反应为 。
。①滴定终点的现象是
②计算钴矿中
 的计算钴矿中
的计算钴矿中 的质量分数,并写出计算过程
的质量分数,并写出计算过程(3)补充完整由装置A反应后的溶液提取
 的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量
的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量 固体,充分反应;
固体,充分反应; 溶液。
溶液。[已知:①在浓
 溶液中会发生反应:
溶液中会发生反应: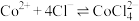 ;②
;② 易溶解于一种有机胺溶剂(密度比水小,难溶于水),
易溶解于一种有机胺溶剂(密度比水小,难溶于水), 和
和 不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水]
不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水](4)沉钴步骤中的试剂是
 溶液和
溶液和 溶液,合理混合得到碱式碳酸钴沉淀。
溶液,合理混合得到碱式碳酸钴沉淀。①适宜的加料方式为
A.将
 溶液加入到
溶液加入到 溶液中
溶液中B.将
 溶液加入到
溶液加入到 溶液中
溶液中②写出沉钴时生成
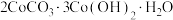 沉淀和
沉淀和 时的离子方程式:
时的离子方程式:
您最近一年使用:0次
6 . 氢化钠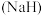 广泛应用于工业生产。
广泛应用于工业生产。
(1)氢化钠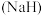 中氢元素的化合价为
中氢元素的化合价为_______ 。
(2) 能与水剧烈反应:
能与水剧烈反应: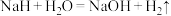 ,该反应中的氧化剂是
,该反应中的氧化剂是_______ ,氧化剂与还原剂的物质的量之比是_______ 。
(3)在高温下氢化钠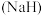 可将四氯化钛
可将四氯化钛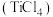 还原成金属钛,该反应的化学方程式为
还原成金属钛,该反应的化学方程式为_______ 。
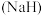 广泛应用于工业生产。
广泛应用于工业生产。(1)氢化钠
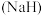 中氢元素的化合价为
中氢元素的化合价为(2)
 能与水剧烈反应:
能与水剧烈反应: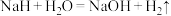 ,该反应中的氧化剂是
,该反应中的氧化剂是(3)在高温下氢化钠
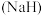 可将四氯化钛
可将四氯化钛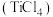 还原成金属钛,该反应的化学方程式为
还原成金属钛,该反应的化学方程式为
您最近一年使用:0次
2023-02-08更新
|
65次组卷
|
2卷引用:江苏省淮安市淮阴区2022-2023学年高二上学期11月期中化学试题
解题方法
7 . 绿矾(FeSO4﹒7H2O)是存在于自然界中的一种矿石。古籍有记载焙烧绿矾可以制备铁红(主要成分是Fe2O3,传统红色颜料的重要着色剂);同时焙烧绿矾也是一种生产硫酸的古老方法。
现利用下图所示装置对焙烧绿矾的反应进行探究。

(1)装置C的作用是__ 。
(2)向U形管中滴入石蕊试液,溶液呈红色,说明该溶液呈____ (填“酸性”或“碱性”);再向该溶液中滴加BaCl2溶液出现白色沉淀,说明其中含有___ (填离子化学式)。
(3)实验过程中,装置A玻管中发生的化学反应方程式为__ 。
现利用下图所示装置对焙烧绿矾的反应进行探究。

(1)装置C的作用是
(2)向U形管中滴入石蕊试液,溶液呈红色,说明该溶液呈
(3)实验过程中,装置A玻管中发生的化学反应方程式为
您最近一年使用:0次
名校
8 . 铁与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系如图所示,下列说法错误的是

| A.其他条件相同,铁与足量密度为1.23g/mL的硝酸反应,还原产物主要为NO |
| B.一定量的铁粉与足量密度为1.36g/mL的HNO3反应,得到气体2.24L(标准状况),则参加反应的硝酸的物质的量为0.3mol |
| C.足量铁与一定量密度为1.36g/mL的硝酸反应,反应的化学方程式始终为:2Fe+6HNO3=2Fe(NO3)2+NO↑+NO2↑+3H2O |
| D.硝酸的密度越大,其还原产物中高价态的成分所占比例越多 |
您最近一年使用:0次
2022-04-21更新
|
1114次组卷
|
7卷引用:江苏省淮安市淮海中学2022-2023学年高二上学期第一次综合测试化学试题
名校
解题方法
9 . 习近平总书记在世界领导人气候峰会上指出,中国将在2030年前实现“碳达峰”、2060年前实现“碳中和”。这是中国基于推动构建人类命运共同体的责任担当和实现可持续发展的内在要求作出的重大战略决策。因此CO2的捕集、创新利用与封存成为科学家研究的重要课题。
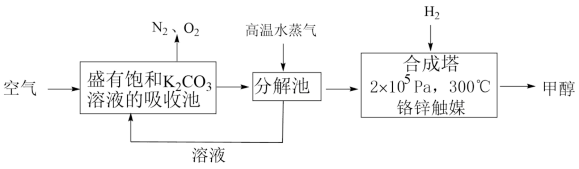
Ⅰ.最近有科学家提出“绿色自由”构想:先把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如图:
(1)上述工艺中采用气液逆流接触吸收(空气从吸收池底部进入,溶液从顶部喷淋),其目的是___ 。写出吸收池中反应的化学方程式___ 。
(2)根据表中键能写出合成塔中反应的热化学方程式 ___ 。
(3)合成塔中制备甲醇的反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___ 。
(4)下列物质能作为CO2捕获剂的是___ (填标号)。
Ⅱ.CO2和H2合成甲烷也是CO2资源化利用的重要方法。
(5)一定条件下Pd—Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图1所示,该反应的化学方程式为___ ,反应过程中碳元素的化合价为-2价的中间体是___ 。___ ,使用的合适温度为___ 。
Ⅰ.最近有科学家提出“绿色自由”构想:先把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如图:
| 化学键 | H—H | C—O | C=O | H—O | C—H |
| 键能/(kJ•mol-1) | 436 | 326 | 803 | 464 | 414 |
(2)根据表中键能写出合成塔中反应的
(3)合成塔中制备甲醇的反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
A.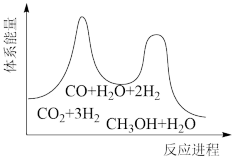 | B.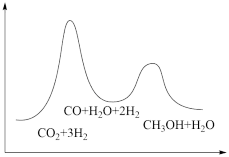 |
C.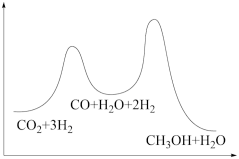 | D.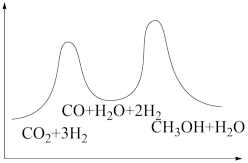 |
| A.NaOH溶液 | B.NH4Cl溶液 | C.CH3CH2OH | D.浓氨水 |
(5)一定条件下Pd—Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图1所示,该反应的化学方程式为
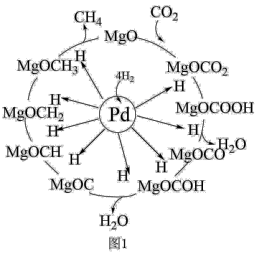
您最近一年使用:0次
2021-12-02更新
|
501次组卷
|
9卷引用:江苏省盱眙中学2021-2022学年上学期高二年级期中考试化学试题
江苏省盱眙中学2021-2022学年上学期高二年级期中考试化学试题湖北省沙市中学2022-2023学年高二上学期第一次月考化学试题山西省太原市第五中学校2022-2023学年高二上学期10月月考化学试题北京市第七中学2022-2023学年高二上学期期中化学试题江苏省苏州市工业园区三校20232024学年高二上学期10月联考化学试题广东省吴川市两校2023-2024学年高二上学期期中联考化学试卷江苏省苏州市西安交通大学苏州附属中学2024-2025学年高二上学期第一次月考化学试题云南省玉溪市第一中学2023届高三上学期11月月考化学试题江苏省苏州第一中学2024-2025学年高一上学期第一次月考化学试题
名校
解题方法
10 . 一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3,FeO及SiO2等)为原料制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如下:
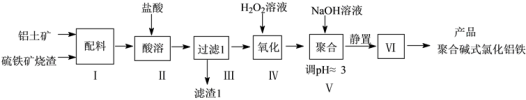
(1)步骤Ⅱ酸溶时, 滤渣1的成分为___________ (填化学式)。
(2)步骤Ⅳ发生反应的离子方程式为___________ 。
(3)步骤Ⅵ包含的操作有___________ 。
(4)测定聚合碱式氯化铝铁{可表示为[FeaAlb(OH)xCly]n}中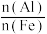 的比值的步骤如下:
的比值的步骤如下:
步骤1.准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350g固体。
步骤2.另准确称取2.855g样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.4000g。
计算产品中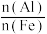 的比值(写出计算过程)。
的比值(写出计算过程)。___________
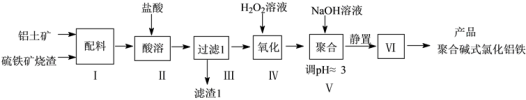
(1)步骤Ⅱ酸溶时, 滤渣1的成分为
(2)步骤Ⅳ发生反应的离子方程式为
(3)步骤Ⅵ包含的操作有
(4)测定聚合碱式氯化铝铁{可表示为[FeaAlb(OH)xCly]n}中
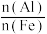 的比值的步骤如下:
的比值的步骤如下:步骤1.准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350g固体。
步骤2.另准确称取2.855g样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.4000g。
计算产品中
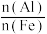 的比值(写出计算过程)。
的比值(写出计算过程)。
您最近一年使用:0次
2021-11-28更新
|
113次组卷
|
2卷引用:江苏省淮安市高中校协作体2021-2022学年高二上学期期中考试化学(必修)试题



