北京市第七中学2022-2023学年高二上学期期中化学试题
北京
高二
期中
2022-11-13
195次
整体难度:
容易
考查范围:
化学反应原理、化学实验基础、物质结构与性质、化学与STSE、认识化学科学、常见无机物及其应用
北京市第七中学2022-2023学年高二上学期期中化学试题
北京
高二
期中
2022-11-13
195次
整体难度:
容易
考查范围:
化学反应原理、化学实验基础、物质结构与性质、化学与STSE、认识化学科学、常见无机物及其应用
一、单选题 添加题型下试题
单选题
|
适中(0.65)
1. 下列装置或过程能实现化学能转化为热能的是
| A | B | C | D |
 |  |  |  |
| 风力发电 | 水果电池 | 燃料燃烧 | 手机充电 |
| A.A | B.B | C.C | D.D |
【知识点】 常见能量转化形式解读 燃烧发电的能量转化过程解读
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
3. 工业上处理含CO、SO2烟道气的一种方法是将其在催化剂作用下转化为S和CO2。已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol; S(s)+O2(g)=SO2(g) ΔH=-296 kJ/mol;则该条件下2CO(g)+SO2(g)=S(s)+2CO2(g)的ΔH等于
| A.- 270 kJ/mol | B.+26 kJ/mol | C.-582 kJ/mol | D.+270 kJ/mol |
【知识点】 盖斯定律 盖斯定律与热化学方程式解读
您最近一年使用:0次
2021-01-24更新
|
1781次组卷
|
34卷引用:北京市西城区2020-2021学年高二上学期期末考试化学试题
北京市西城区2020-2021学年高二上学期期末考试化学试题北京市八十中2020-2021学年高二下学期开学考试化学试题北京市回民学校2021-2022学年高二上学期期中考试化学试题北京市第十五中学2021-2022学年高二上学期期中考试化学试题北京市清华附中2021-2022学年高一下学期期末考试化学试题第一章化学反应的热效应北京市师范大学亚太实验学校2021-2022学年高二上学期期中考试化学试题北京市中国农业大学附属中学2021-2022学年高二上学期期中学业水平调研化学试题北京十四中2022-2023学年高二上学期期中检测化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京师范大学第二附属中学2022-2023学年高二上学期期中考试化学试题北京市顺义区顺义第一中学2022-2023学年高二上学期期中考试化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题广西百色民族高级中学2022-2023学年高二上学期10月阶段检测化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题新疆阿勒泰地区2022-2023学年高一下学期期末考试化学试题(已下线)专题02 盖斯定律、反应热的计算【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)北京市育才学校2023-2024学年高二上学期10月月考化学试题北京市东直门中学2022-2023学年高二上学期期中考试化学试题北京市北京医学院附属中学2022-2023学年高二上学期期中考试化学试题江西省抚州市临川第一中学2023-2024学年高二上学期期中考试 化学试卷北京市西城区2022-2023学年育才学校高二上学期化学期中考试北京市顺义区2023-2024学年第九中学高二上学期化学期中试题北京市中国人民大学附属中学通州校区2023-2024学年高二上学期10月月考化学试题北京市通州区2023-2024学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2023-2024学年高二上学期期中考试化学试题北京市第十一中学2022-2023学年高二上学期期中考试化学试卷四川省自贡市第二十二中学校2023-2024学年高二上学期期中考试化学试题北京师范大学附属昌平学校2023-2024学年高二上学期12月月考化学试题天津市河东区2023-2024学年高二上学期1月期末化学试题北京市顺义区第二中学2023-2024学年高二上学期10月月考化学试题广东省陆河外国语学校2023-2024学年高二上学期第二次月考化学试题山西省运城市稷山中学2023-2024学年高二上学期11月月考化学试题北京市第十一中学顺义分校2024-2025学年高二上学期10月月考 化学试题
4. 依据图示关系,下列说法不正确的是
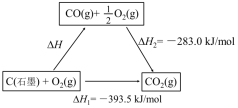
| A.石墨燃烧是放热反应 |
| B.1molC(石墨)和1molCO分别在足量O2中燃烧,全部转化为CO2,前者放热多 |
| C.C(石墨)+CO2(g)=2CO(g) ΔH=ΔH1-ΔH2 |
| D.化学反应的ΔH,只与反应体系的始态和终态有关,与反应途径无关 |
您最近一年使用:0次
2020-08-19更新
|
8339次组卷
|
59卷引用:2020年北京市高考化学试卷
2020年北京市高考化学试卷辽宁省辽阳市辽阳县集美中学2020-2021学年高二上学期第一次月考化学试题北京首都师范大学附属中学2020-2021学年高二上学期期中考试化学试题北京市一零一中学2020-2021学年高二上学期期中考试化学试题浙江省金丽衢十二校2021届高三上学期第一次联考化学试题(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)热点7 化学能与热能-2021年高考化学【热点·重点·难点】专练(新高考)新疆维吾尔自治区巴州二中2021届高三第六次月考化学试题(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)1.2 反应热的计算-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)高中化学《新教材变化解读与考法剖析》第一章 化学反应的热效应(人教版2019选择性必修1)山东省济宁曲阜市第一中学2021-2022学年高二10月月考化学试题北京市中国农业大学附属中学2020-2021学年高一下学期期中学业水平调研化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(B班)化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(A班)化学试题云南省玉溪市第二中学2021-2022学年高二上学期期中考试化学试题云南省玉溪市江川区第二中学2021-2022学年高二上学期期中考试化学试题北京师范大学附属中学2021-2022学年高二上学期期中考试化学试题福建省厦门市湖滨中学2021-2022学年高二上学期期中考试化学试题2020年北京高考化学真题变式题11-19(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)回归教材重难点05 化学反应中的能量变化-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)广东省大联考2021-2022学年高一下学期期中检测化学试题天津市静海区四校2021-2022学年高三上学期12月阶段性检测化学试题天津市南开区2021-2022学年高一下学期期末阶段性质量检测化学试题吉林省吉化第一高级中学校2021-2022学年高一下学期复课检测化学试题(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第24练 反应热-2023年高考化学一轮复习小题多维练(全国通用)北京市第四中学顺义分校2021-2022学年高二上学期期中考试化学试题北京市第七中学2022-2023学年高二上学期期中化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题(已下线)【2022】【高二上】【期中考】【高中化学】59(已下线)专题15 反应热计算的几种类型-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第六章 化学反应与能量 第34讲 反应热的计算(已下线)【2022】【高二化学】【期中考】-178(已下线)题型13 突破反应热图象(已下线)专题08 化学反应中的能量变化广东省广州真光中学2021-2022学年高二上学期期中考试化学试题广东省广州市协和中学等3校2022-2023学年高二上学期(12月)期末考试化学试题作业(三) 反应热的计算(已下线)第2讲 盖斯定律 反应热的计算第一章 化学反应的热效应 第二节 反应热的计算宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题北京市八一学校2022-2023学年高二上学期期中考试化学试题北京汇文中学2023-2024学年高二上学期期中考试化学试题北京市第十一中学2022-2023学年高二上学期期中考试化学试卷北京市第一六一中学2023-2024学年高二上学期10月月考化学试题北京师范大学附属中学2023-2024学年高二上学期期末考试化学试卷北京市清华大学附属中学2023-2024高一下学期期末考试化学试卷江西省上饶市婺源县天佑中学2023-2024学年高一下学期7月测试化学试卷山东省菏泽市郓城县实验中学2023-2024学年高一下学期5月月考化学试题北京市某校2024-2025学年高二上学期开学摸底考试化学试题邯郸市育华中学2022-2023学年第一学期高二年级第一次月考化学试卷甘肃省庆阳市宁县第一中学2024-2025学年高二上学期期中考试化学试卷
单选题
|
适中(0.65)
真题
名校
5. 下列食品添加剂中,其使用目的与反应速率有关的是( )
| A.抗氧化剂 | B.调味剂 |
| C.着色剂 | D.增稠剂 |
您最近一年使用:0次
2019-12-04更新
|
4322次组卷
|
135卷引用:2016年全国普通高等学校招生统一考试化学(北京卷精编版)
2016年全国普通高等学校招生统一考试化学(北京卷精编版)2015-2016学年吉林省松原市油田高中高一下期末化学试卷2015-2016学年吉林长春第十一中高一下期末考化学2017届广西陆川中学高三上8月月考理综化学试卷2016-2017学年山西省怀仁一中高二上第一次月考化学试卷2016-2017学年山西省太原五中高二上10月月考化学试卷山西省太原市2016-2017学年高一下学期阶段性测评(期中考试)化学试题河北省唐山市曹妃甸区第一中学2016-2017学年高一下学期期中考试化学试题广西桂林市第十八中学2016-2017学年高二下学期期中考试化学试题西藏日喀则市第一高级中学2017-2018学年高二上学期期中考试化学试题福建省南安第一中学2017-2018学年高二上学期期中考试化学试题重庆市第一中学2017-2018学年高二上学期期中考试化学试题江西省抚州市临川区第一中学2017-2018学年高二12月月考化学试题安徽省当涂一中2017-2018学年高二上学期12月月考化学试题宁夏银川一中2017-2018学年高二上学期期末考试化学试题辽宁省大连市普兰店区第二中学2017-2018学年高二上学期期末考试化学试题黑龙江省伊春中学2017-2018学年高二化学上学期期末考试试题山东省枣庄市薛城区2017-2018学年高二上学期期末化学试题(已下线)《考前20天终极攻略》-5月25日 化学反应速率与化学平衡(已下线)第17天 对化学反应速率的理解——《每日一题·2018快乐暑假》高二化学【全国区级联考】北京市东城区2017-2018学年高二下学期期末考试化学试题河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题山东省济宁市邹城市兖矿第一中学2018-2019学年高二上学期期中模拟考化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高二上学期期中考试化学试题安徽省巢湖市柘皋中学2018-2019学年高二(文)上学期期中考试化学试题河北省承德市隆化县存瑞中学2018-2019学年高二上学期第二次质检化学试题(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(教学案)【区级联考】安徽省宿州市埇桥区2018-2019学年高二(理)上学期期末考试化学试题【市级联考】广东省中山市2018-2019学年高二上学期期末水平测试化学试题2016年全国普通高等学校招生统一考试化学(北京卷参考版)【全国百强校】内蒙古自治区第一机械制造有限公司第一中学2018-2019学年高一下学期3月月考化学试题【校级联考】河南省商开九校联考2018-2019学年高二上学期期中考试化学试题河北安平中学2018-2019学年高一下学期期中考试化学(实验班)试题(已下线)第17天 对化学反应速率的理解——《2019年暑假作业总动员》高二化学浙江省宁波市北仑中学2018-2019学年高一下学期期末考试化学试题北京丰台区2018-2019学年高二下学期期末考试化学试题黑龙江省大庆市铁人中学2018-2019学年高一下学期期末化学试题广东省中山市第一中学2019-2020学年高二上学期第一次段考化学试题辽宁省六校协作体2019-2020学年高二上学期10月月考化学试题安徽省滁州市明光中学2019-2020学年高二上学期第一次月考化学试题江苏省启东中学2019-2020学年高二上学期期中考试化学试题河南省南阳市南阳一中2019-2020学年高二上期第三次月考化学试题山东省淄博市淄川中学2019-2020学年高二上学期期中考试化学试题新疆昌吉回族自治州玛纳斯县第一中学2019-2020学年高二上学期期中考试化学试题新疆维吾尔自治区昌吉玛纳斯县第一中学2018-2019学年高二上学期期中考试化学试题新疆生产建设兵团第七师高级中学2019-2020学年高二上学期第二次月考化学试题辽宁省葫芦岛市第八高级中学2019-2020学年高二上学期期中考试化学试题(已下线)第七单元单元测试(测)-《2020年高考一轮复习讲练测》1(已下线)专题7.1 化学反应速率(讲)-《2020年高考一轮复习讲练测》(已下线)专题7.1 化学反应速率(练)-《2020年高考一轮复习讲练测》山西省晋中市平遥县第二中学2019-2020学年高二12月月考化学试题福建省泉州市泉港区第一中学2019-2020学年高二上学期第二次月考化学试题宁夏银川市兴庆区长庆高级中学2019-2020学年高二上学期期末考试化学试题云南省玉溪一中2019-2020学年上学期期末考试高三化学复习卷上海市宝山区2020届高三上学期第一次模拟考试(等级考)化学试题第二章 化学反应与能量学 模拟高考——C 挑战区 夯实基础(人教版必修2)第六章 化学反应与能量 模拟高考——C挑战区 夯实基础(人教版(2019)第二册)(已下线)专题一 化学与STSE(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训广西桂林市第十八中学2019-2020学年高二下学期开学考试化学试题北京市海淀实验中学2019-2020学年高二下学期期末考试化学试题内蒙古自治区通辽市开鲁县第一中学2019-2020学年高一下学期期末考试化学试题河北省石家庄市第二中学2019-2020高一下学期期末考试模拟化学试题(一)河南省安阳市林州市第一中学2020-2021学年高二上学期开学考试(实验班)化学试题(已下线)2.2 影响化学反应速率的因素(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)必修第二册RJ第6章模拟高考新疆生产建设兵团第四师第一中学2019-2020学年高一下学期期中考试化学试题山西省怀仁市2020-2021学年高二上学期期中化学试题陕西省汉中市五校2020-2021学年高二上学期第一次月考化学试题湖北省利川市第五中学2020-2021学年高二上学期期中考试化学试题上海市青浦区2021届高三一模化学试题甘肃省张掖市2020-2021学年高二上学期期末学业水平质量检测化学试题北京市房山区2020-2021学年高二上学期期末考试化学试题河北省衡水市第十四中学2020-2021学年高二上学期期末考试化学试题新疆乌鲁木齐市第八中学2020-2021学年高二上学期第一阶段考试化学试题河南省郑州市八校2020-2021学年高一下学期期中联考化学试题广东省信宜市2020—2021学年高一下学期期中联考化学试题上海市宝山区2020-2021学年高二下学期期末统考化学试题上海市虹口区2020-2021学年高一下学期期末学生学习能力诊断测试化学试题广东省广州市2022届高三10月调研考化学试题北京市昌平区新学道临川学校2021-2022学年高二上学期第一次月考化学试题天津市红桥区2021-2022学年高三上学期期中考试化学试题辽宁省滨海实验中学2019-2020学年高二上学期期末化学试题四川省成都实验中学2020-2021学年度高2022届高二上学期开学考试化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期期中考试化学试题云南昆明师范专科学校附属中学2021-2022学年高二上学期期中考试化学试题港澳台部分学校2021-2022学年上学期高三11月月考化学试题广东省广雅中学2021-2022学年高二上学期期中考试化学试题(已下线)6.1.1 化学反应速率(第1课时 化学反应速率的概念和简单计算)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)广东省广州市花都区邝维煜纪念中学2021-2022学年高二12月适应性考试化学试题内蒙古自治区第二地质中学2020-2021学年高二下学期第二次阶段检测化学试题广东省茂名市电白区2021-2022学年高一下学期期中(合格性)考试化学试题天津市第二十一中学2021-2022学年高一下学期期中学情调研化学试题天津市东丽区2021-2022学年高一下学期期末质量监测化学试题广东省韶关市2021-2022学年高一下学期期末考试化学试题(已下线)第22练 化学品的合理使用-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第22练 化学品的合理使用-2023年高考化学一轮复习小题多维练(全国通用)浙江省湖州市三贤联盟2021-2022学年高二上学期期中考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题北京市第一五九中学2021-2022学年高二上学期期中考试化学试题吉林省长春市北师大附属学校2021-2022学年高二上学期期末考试化学试题云南省砚山县第二高级中学2021-2022学年高二下学期期中(4月)考试化学试题甘肃省白银市第九中学2020-2021学年高一下学期期中考试化学试题北京市第七中学2022-2023学年高二上学期期中化学试题天津市河东区2022-2023学年高三上学期期中检测化学试题湖南省长沙市明德中学2022-2023学年高二上学期期中考试化学试题苏教2020版选择性必修1专题2第一单元 化学反应速率课后习题北京市顺义牛栏山第一中学2022-2023学年高三上学期期中考试化学试题北京市首都师范大学附属密云中学2022-2023学年高二上学期10月阶段性练习化学试题北京市日坛中学2022-2023学年高二上学期期中考试化学试题山东省滨州高新高级中学2022-2023学年高二上学期期中考试化学试题云南省玉龙纳西族自治县田家炳民族中学2021-2022学年高二上学期期中考试化学试题黑龙江省佳木斯市第八中学2021-2022学年高二上学期期中考试化学试题广东省广州市育才中学2022-2023学年高二上学期期中考试化学试题上海市青浦高级中学 2022-2023学年高二上学期期末线上质量检测化学试题广东省茂名市电白区2021-2022学年高一下学期期中(选择性)考试化学试题吉林省辽源市等2地高中友好学校2022-2023学年高二上学期期末联考化学试题北京市第八中学2022-2023学年高一下学期期中考试(选考班)化学试题陕西省西安市蓝田县城关中学玉山中学大学区联考2022-2023学年高一下学期4月期中考试化学试题广东省广州真光中学2021-2022学年高二上学期期中考试化学试题吉林省辽源、通化等2市2022-2023学年高二上学期1月期末考试化学试题陕西省西安市蓝田县大联考2022-2023学年高一下学期4月期中化学试题北京市第五十中学2023-2024学年高二上学期期中考试化学试题广东省深圳市新安中学(集团)高中部2023-2024学年高二上学期期中考试化学试题广东省 江门市棠下中学2023-2024学年高二上学期期中考试化学试题2023-2024学年广东省江门市棠下中学、广东实验江门学校高二(上)期中化学试卷广东省广州市白云中学2023-2024学年高二上学期12月月考化学试题2023年广东省广州市高三化学冲刺训练题(二)北京市北京师范大学附属中学平谷第一分校2023-2024学年高二上学期期中考试化学试题福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题北京市第一五九中学2023-2024学年高一下学期期中考试化学试题湛江市崇文中学、海东中学、港城中学、寸金培才学校2022—2023学年高二第一学期期中联考试化学试卷北京市第三十五中学2024-2025学年高二上学期10月月考 化学试题北京市第十一中学顺义分校2024-2025学年高二上学期10月月考 化学试题北京市中关村中学2024-2025学年高二上学期10月月考 化学试题上海市上海华东师范大学附属进华中学2024-2025学年高二上学期期中考试 化学试卷
单选题
|
较易(0.85)
名校
解题方法
6. 用pH试纸测定某一溶液的pH时,规范的操作是
| A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 |
| B.将溶液倒在pH试纸上,跟标准比色卡比较 |
| C.用干燥洁净的玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 |
| D.在试管内放少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较 |
您最近一年使用:0次
2020-12-01更新
|
483次组卷
|
40卷引用:2010年陕西省宝鸡中学高一上学期期中考试化学试卷
(已下线)2010年陕西省宝鸡中学高一上学期期中考试化学试卷(已下线)2011-2012学年广东省汕头市达濠中学高二上学期期末考试化学试卷(已下线)2011-12学年福建莆田十八中高一上学期期未测试(A)化学试卷(已下线)2011-2012学年陕西省宝鸡中学高二下学期期中考试化学试题(已下线)2012-2013学年福建省厦门大学附属科技中学高二下学期期中考化学卷(已下线)2014届甘肃省天水市秦安县高三上学期期末检测化学试卷(已下线)2014-2015学年山东桓台第二中学高一上学期(10月)检测化学试卷2014-2015河南省新野县三中高二上学期第三次月考化学试卷2015-2016学年山东省桓台二中高一上学期期中测试化学试卷2015-2016学年吉林省吉林五十五中高二上学期期中(文)化学试卷2015-2016学年陕西省黄陵中学高二上学期期末考试化学试卷2015-2016学年贵州省大方一中高二上学期期末化学试卷2015-2016学年江西省南昌市八一中学等三校高二上期末联考化学试卷2016-2017学年甘肃省武威二中高二上10月月考化学试卷2017-2018学年高一人教版必修一:1 化学实验安全课时训练化学试题辽宁省实验中学2017-2018学年高二上学期期中考试化学试题2018-2019学年鲁科版高一化学必修一1.1走进化学科学练习题四川省宜宾市南溪区第二中学2018-2019学年高一上学期9月月考化学试题江西省上饶市第二中学2018-2019学年高二上学期期中考试化学试题安徽省合肥市第九中学2018-2019学年高二上学期期中考试化学试题高二人教版选修4 第三章 第二节 水的电离和溶液的酸碱性内蒙古自治区包头市第六中学2018-2019学年高二上学期期中考试化学试题江苏省吴江平望中学2018-2019学年高二下学期第二次阶段性测试化学试题黑龙江省哈尔滨市阿城区第二中学2018-2019学年高二下学期期中考试化学试题陕西省黄陵中学高新部2019-2020学年高二上学期期中考试化学试题黑龙江省安达市第七中学2019-2020学年高一上学期月考化学试题河北省承德第一中学2019-2020学年高二上学期第三次月考化学试题(已下线)【南昌新东方】2019 进贤一中 高一上第一次月考(已下线)3.2.1+水的电离和溶液的酸碱性-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)广西岑溪市2020-2021学年高一上学期期中考试化学试题贵州省安顺市大洋实验学校2020-2021学年高一上学期期中考试化学试题福建省南安市柳城中学2020-2021学年高二上学期第二次月考化学试题北京市第一五六中学2021-2022学年高二上学期期中考试化学试题云南省昆明师范专科学校附属中学2021-2022学年高二上学期期末考试化学试题湖南省长沙市长郡中学2022-2023学年高二上学期期中考试化学试题北京市第七中学2022-2023学年高二上学期期中化学试题陕西省咸阳市西北农林科技大学附属中学2022-2023学年高二下学期开学考试化学试题第2课时 水溶液的酸碱性与pH云南省昆明师范专科学校附属中学2022-2023学年高二上学期期末考试化学试题江西省宜春市宜丰中学2022-2023学年高二上学期期末考试化学试卷
单选题
|
适中(0.65)
7. 我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如下所示。
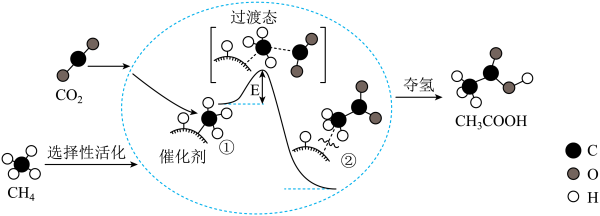
| A.生成CH3COOH总反应的原子利用率为100% |
| B.CH4→CH3COOH过程中,有C—H键发生断裂 |
| C.①→②放出能量并形成了C—C键 |
| D.该催化剂可有效提高反应物的平衡转化率 |
您最近一年使用:0次
2018-06-09更新
|
14791次组卷
|
138卷引用:2018年全国普通高等学校招生统一考试化学(北京卷)
2018年全国普通高等学校招生统一考试化学(北京卷)【全国百强校】湖南师范大学附属中学2017-2018学年高一下学期期末考试化学试题【全国校级联考】湖南省五市十校2017-2018学年高一下学期期末考试化学试题(已下线)2018年高考题及模拟题汇编 专题07 化学反应中的能量变化(已下线)高考母题题源05 化学反应与能量福建省三明市第一中学2018-2019学年高二上学期开学考化学试题安徽省宣城市郎溪县郎溪中学2018-2019学年高二上学期直升部返校考化学试题北京市师范大学附属中学2017-2018学年高一下学期期末考试化学试题安徽省合肥市一六八中学2018-2019学年高二上学期期中考试化学试题【全国百强校】重庆市西南大学附属中学校2019届高三上学期第三次月考理科综合化学试题(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(教学案)江西省丰城中学2018-2019学年高一上学期课改期末考试化学试题(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点(已下线)2019年高考总复习巅峰冲刺-专题05 化学反应中的能量变化应试策略【全国百强校】江苏省启东中学2018-2019学年高二(创新班)下学期期中考试化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二10月月考化学试题福建省泉州市泉港区第一中学2020届高三上学期第一次月考化学试题安徽省青阳县第一中学2019-2020学年高二9月月考化学试题安徽省肥东县第二中学2019-2020学年高二上学期期中考试化学试题河南省南阳市南阳一中2019-2020学年高二上期第三次月考化学试题内蒙古翁牛特旗乌丹第一中学2019-2020学年高二10月月考化学试题重庆市北碚区2019-2020学年高二11月联合性测试化学试题安徽省天长市炳辉中学2019-2020学年高二上学期第二次月考化学试题(已下线)考点08 化学反应中的能量变化——《备战2020年高考精选考点专项突破题集》黑龙江省哈尔滨市第六中学2020届高三上学期第三次调研考试化学试题广东省梅州市水寨中学2019-2020学年高二上学期期中考试化学试题江西省赣州市赣县三中2020届高三上学期补习班期末适应性考试化学试题福建省莆田第二十五中学2020届高三上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡移动及其影响因素(强化练习)山西省临汾市2020届高三上学期第二次月考化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(八)(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训河北省沧州市盐山中学2019-2020学年高二上学期期末考试(B)化学试题(已下线)专题6.1 化学能与热能(练)——2020年高考化学一轮复习讲练测江西省南昌市第二中学2019-2020学年高一下学期第二次月考化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末模拟考试化学试题河南省商丘市第一高级中学2019-2020学年高一下学期期末考试化学试题山东省日照市莒县2019-2020学年高二上学期期中考试化学试题(已下线)第13讲 原子结构和化学键-2021年高考化学一轮复习名师精讲练河南省驻马店市2018-2019学年高二上学期期末考试化学试题安徽省六安市第一中学2019-2020学年高一下学期期末考试化学试题云南省昆明市官渡区第一中学2019-2020学年高二上学期开学考试化学试题江苏省启东中学2020-2021学年高二上学期期初考试化学试题四川省成都市第七中学2021届高三上学期入学考试化学试题(已下线)1.1.2+热化学方程式-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)黑龙江省大庆中学2020-2021学年高二上学期开学考试化学试题上海市复兴高级中学2019-2020学年高三上学期10月检测化学试题湖南省长沙市雅礼中学2021届高三上学期第二次月考化学试题安徽省宣城二中2020-2021学年高二上学期第一次月考化学试题湖北省随州市曾都区第一中学2020-2021学年高二上学期十月月考化学试题内蒙古阿荣旗第一中学2020-2021学年高二上学期期中考试化学试题福建省福州市第十一中学2020-2021学年高二上学期期中质量检测化学试题湖南省衡阳市第二十六中学2021届高三上学期9月月考化学试题湖北省宜昌市长阳土家族自治县第一高级中学2020-2021学年高二上学期期中考试化学试题河南省郑州市第一〇六高级中学2020-2021学年高二上学期11月考试化学试题福建师范大学第二附属中学2019-2020学年高二上学期期中考试化学(选考)试题广东省广州市第一一三中学2020-2021学年高二上学期第二阶段考试化学(选考)试题(已下线)小题必刷21 原子结构与化学键——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)福建省连城县第一中学2021届高三上学期第二次月考化学试题广东省广州市天河中学2021届高三上学期1月月考化学试题北京市通州区2021届高三上学期摸底考试化学试题四川省凉山州2020-2021学年高二上学期期末考试化学试题高中化学苏教2019版必修第二册-专题6 第二单元综合拔高练人教版2019必修第二册 第六章 第一节综合拔高练(鲁科版2019)必修第二册 第2章 化学键 化学反应规律 学科素养提升湖北省黄石市有色第一中学2020-2021学年高二上学期期末考试化学试题新疆维吾尔自治区2021届高三下学期诊断性自测(第一次)化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练河北省沧州市第一中学2020-2021学年高二下学期第一次月考化学试题广东省广州市禺山高级中学2019-2020学年高二下学期期中考试化学试题天津市南开中学2021届高三年级第5次月考(二模)化学试题湖南省临澧县第一中学2020-2021学年高二下学期期中(高考类)化学试题江西省景德镇一中2020-2021学年高一下学期期中考试化学(2班)试题河北省沧州市肃宁一中2020-2021学年高二下学期4月月考化学试题(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)山东省临沂市平邑县第一中学实验部2021-2022学年高二上学期第二次月考化学试题浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高一9月份月考(1-4班)化学试题江苏省扬州中学2021-2022学年高三上学期10月考化学试题重庆市朝阳中学2021-2022学年高二10月月考化学试题安徽师范大学附属中学2021-2022学年高二上学期期中考查化学试题河南省南阳市2022届高三上学期期中考试化学试题河南省实验中学2021-2022学年高二上学期期中考试化学试题广东省佛山市第二中学2020-2021学年高二上学期期中考试化学试题北京师范大学附属中学2021-2022学年高二上学期期中考试化学试题上海市松江区2022届高三一模化学试题黑龙江省鸡东县第二中学2021-2022学年高二上学期期中考试化学(理)试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)福建省福州华侨中学2021-2022学年高二上学期期中考试化学试题(已下线)卷10 化学反应机理选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)广东省大联考2021-2022学年高一下学期期中检测化学试题陕西省商洛市山阳中学2021-2022学年高二下化学期中考试化学试题 浙江省舟山市2021-2022学年高二下学期期末考试化学试题(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)北京首都师范大学附属中学2021-2022学年高一下学期期末考试化学试题内蒙古乌兰察布市部分学校2021-2022学年高二上学期期中联考化学试题福建省福州市五校联考2021-2022学年高二上学期期中考试化学试题河南省南阳市第六完全学校高级中学2022-2023学年高二上学期9月考试化学试题江西省宜春市万载中学2021-2022学年高一下学期第二次月考化学试题北京市第三十一中学2021-2022学年高二上学期期中考试化学试题云南省富源县第一中学2020-2021学年高二上学期第一次统测化学试题贵州省贵阳市2022-2023学年高三上学期10月质量监测化学试题北京市北京师范大学附属实验中学2022-2023学年高二上学期期中考试化学试题海南省琼海市嘉积第二中学2021-2022学年高二下学期教学质量监测(段考)化学科试题 北京市第七中学2022-2023学年高二上学期期中化学试题福建省南平市高级中学2022-2023学年高二上学期期中考试化学(选考)试题陕西省汉中市洋县中学2022-2023学年高二上学期期中考试化学试题广东省开平市忠源纪念中学2022届高三考前热身考试化学试题浙江省2022-2023学年高三上学期选考科目适应性考试化学试题江苏省南通市海安高级中学2022-2023学年高二上学期期中考试化学试题上海市大同中学2022-2023学年高二上学期期中考试化学试题天津市静海一中20223-2023学年高三上学期期末定时测验化学试题(已下线)第七章 化学反应速率与化学平衡 热点强化12 化学反应历程、机理的分析应用重庆市万州第二高级中学2023届高三下学期第四次质量检测化学试题广东省珠海市第一中学2023届高三下学期5月月考化学试题广东省珠海市第一中学2023届高三5月模拟预测二化学试题四川省凉山州2022-2023学年高二下学期期末考试化学试题北京市第一○一中学2022-2023学年高一下学期期末考试化学试题江西省永修县第一中学2023-2024学年高二上学期开学考试化学试题广东省肇庆市封开县广信中学、四会中学2023-2024学年高二上学期第一次联考化学试题广西南宁第二十六中2023-2024学年高二上学期第一次月考化学试题福建省莆田第二十五中学2023-2024学年高二上学期期中考试化学试题北京市第一六一中学2023-2024学年高二上学期10月月考化学试题2023年广东省广州市高三化学冲刺训练题(二)江苏省淮安市洪泽中学等七校2023-2024学年高二下学期第一次联考化学试卷江苏省镇江市六校联考2023-2024学年高二下学期3月月考化学试题重庆十八中两江实验中学校2022-2023学年高二上学期第一次月考化学试题浙江省绍兴市2023-2024学年高一下学期期末调测化学试题江苏省常州高级中学2023~2024学年高一下学期阶段性检测化学试题北京第四中学2023-2024学年高一下学期期末考试试卷江西省上饶市婺源县天佑中学2023-2024学年高一下学期7月测试化学试卷北京市第五十七中学2023-2024学年高一下学期第二次月考化学试题四川省雅安市芦山中学2023-2024学年高二下学期入学考试 化学试题四川省什邡中学2024-2025学年高二上学期10月第一次月考化学试题北京市第三十五中学2024-2025学年高二上学期10月月考 化学试题
单选题
|
适中(0.65)
名校
解题方法
8. 25℃、1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g) ΔH=+109.8kJ·mol-1,该反应能自发进行的原因是
| A.该反应是吸热反应 | B.该反应是放热反应 |
| C.该反应是熵减小的反应 | D.该反应的熵增大效应大于能量效应 |
您最近一年使用:0次
2023-08-19更新
|
1295次组卷
|
142卷引用:2010年江苏省启东中学高二上学期期中考试化学卷
(已下线)2010年江苏省启东中学高二上学期期中考试化学卷(已下线)2011届河南省豫南九校高三上学期第二次联考化学试卷(已下线)2010-2011学年江苏省启东中学高二上学期期中考试化学试题(理)(已下线)2010-2011学年浙江省瑞安中学高二下学期期末联考化学试卷(已下线)2012届河南省郑州市智林学校高三上学期10月份月考化学试卷(已下线)2011-2012学年湖北省部分重点中学高二上学期期中联考化学试卷(已下线)2011-2012学年云南省蒙自县文澜高级中学高二上学期期中考试化学试卷(已下线)2011-2012学年江西省南昌市四校高二第二次联考化学试卷(已下线)2011-2012学年河北省涿州二中高二上学期期中考试化学试卷(已下线)2011-2012学年吉林省东北师大附中高二上学期期末考试化学试卷(已下线)2011-2012学年湖北省武汉市五校高二上学期期中统考化学试卷(已下线)2011-2012天津南开中学高二第一学期期中考试理科化学试卷(已下线)2012-2013学年吉林省松原市扶余县一中高二第一次月考化学试卷(已下线)2012-2013学年福建省福州八县一中高二上学期期末联考化学试卷(已下线)2013-2014学年海南省三亚市一中高二上学期期中考试理科化学试卷(已下线)2013-2014学年河北省邯郸市高二上学期期末考试化学试卷(已下线)2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(已下线)2013-2014北京四中高二上学期期中考试化学试卷(已下线)2012届吉林东北师大附中高二上学期期末考试化学试卷 (已下线)2014-2015学年湖南省衡阳市第八中学高二上学期期中考试化学试卷(已下线)2014秋湖南省浏阳市第一中学高二上学期期中化学(理)试卷2014-2015学年浙江省衢州第二中学高二上学期期中化学试卷2014-2015湖南省益阳六中高二上学期期中考试化学(理)试卷2014-2015重庆市杨家坪中学高二上学期第三次月考化学试卷2014-2015甘肃省高台县一中高二上学期期末考试化学试卷2014-2015学年重庆市杨家坪中学高二上学期第三次月考化学试卷2016届贵州省贵阳市普通高中高三8月摸底考试化学试卷2015-2016学年甘肃兰州一中高二上期中测试理科化学试卷2015-2016学年江西省铅山一中 、横峰中学高二上期中测试化学试卷2015-2016学年山东省济宁市兖州区高二上学期期中测试化学试卷2015-2016学年江西省南昌市湾里区一中高二上学期期中测试化学试卷2015-2016学年湖南常德石门第一中学高二上期中理化学卷陕西省咸阳市西藏民族学院附属中学2015-2016学年高二上期末化学卷2016届河北省冀州中学高三上学期第四次月考化学试卷2015-2016学年江西省上高二中高二上学期期末化学试卷2015-2016学年广东省肇庆市高二上学期教学质量评估统考化学试卷2015-2016学年安徽省安庆市怀宁高河中学高二上第一次月考化学试卷2014-2015学年湖南省双峰一中高二下学期期末考试化学试卷2015-2016学年陕西西藏民族学院附中高二下期末化学卷2017届内蒙古赤峰二中高三上第一次月考化学试卷2016-2017学年湖南省长沙一中高二上第一次月考化学卷2016-2017学年广西宾阳中学高二上9月月考化学试卷2016-2017学年江西省宜春市奉新一中高二上月考一化学试卷2016-2017学年山东省菏泽市高二上学期期中化学试卷2016-2017学年天津市河东区高二上学期期中质检化学试卷2016-2017学年天津市武清区等五区县高三上学期期中考试化学试卷2016-2017学年浙江省余姚中学高二上期中化学试卷2016-2017学年湖南浏阳一中等两校高二12月联考化学卷2016-2017学年新疆兵团第二师华山中学高二下学期学前考试化学试卷河南省鹤壁市淇滨高级中学2017-2018学年高二上学期第一次月考化学试题黑龙江省牡丹江市第一高级中学2017-2018学年高二10月月考(理)化学试题山东省枣庄市第八中学东校区2017-2018学年高二10月月考化学试题天津市红桥区2017-2018学年高二上学期期中考试化学试题甘肃省兰州第一中学2017-2018学年高二12月月化学试题北京师大附中2017-2018学年上学期高二年级期中考试化学试卷内蒙古鄂尔多斯市第一中学2017-2018学年高二上学期第三次月考化学试题四川省雅安市2017-2018学年高二上学期期末考试化学试题【全国市级联考】福建省福州市八县协作校2017-2018学年高二上学期期末联考化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题陕西省西安市远东第一中学2018-2019学年高二上学期期中考试化学试题【全国百强校】河北省辛集中学2019届高三上学期期中考试化学试题【市级联考】内蒙古自治区鄂尔多斯市2018-2019学年高二上学期期中考试化学试题人教版高二化学选修4 第二章 第四节 化学反应进行的方向练习题山西省忻州二中2018-2019学年高二上学期期中考试化学试题江西省铅山县第一中学2018-2019学年高二上学期期中考试化学试题浙江省余姚中学2018-2019学年高二上学期10月月考化学试题【全国百强校】贵州省贵阳市第一中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】四川省阆中中学2018-2019学年高一(仁智班)下学期期中考试化学试题吉林省白城市第一中学2018-2019学年高一6月月考化学试题安徽省六安市二中2018-2019学年高二第一学期10月月考化学试题河北省鸡泽县第一中学2019-2020学年高二10月月考化学试题福建省龙岩市连城县第一中学2019-2020学年高二上学期第一次月考化学试题1黑龙江省绥化市青冈县第一中学2019-2020学年高二上学期(A)班月考化学试题甘肃省武威市第六中学2019-2020学年高二上学期第二次段考化学试题宁夏青铜峡市高级中学2019-2020学年高二上学期期中考试化学试题甘肃省张掖市第二中学2019-2020学年高二上学期10月月考化学试题北京师范大学附中2019-2020学年高二上学期期中考试化学试题甘肃省张掖市山丹县第一中学2017—2018学年高二上学期期末质量检测化学试题山西省祁县第二中学校2019-2020学年高二上学期期中考试化学试题2020年春季人教版高中化学选修4第二章《化学反应速率和化学平衡》测试卷吉林省辉煌联盟九校2019-2020学年高三第三次联考化学试题安徽省芜湖市2019-2020学年高二上学期期末考试化学(理)试题贵州省毕节市民族中学2019-2020学年高二上学期第二次月考化学试题山东省济宁市泗水县2019-2020学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第1节 化学反应的方向(已下线)2.3 化学反应的方向(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第三节 化学反应的方向 方法帮山东省新泰市第一中学北校2020-2021学年高二上学期第一次月考化学试题吉林省通化县综合高级中学2020-2021学年高二上学期期中考试化学试题(已下线)第二章检测-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)浙江省温州新力量联盟2020-2021学年高二上学期期中联考化学试题内蒙古自治区奈曼旗第一中学2020-2021学年高二上学期期中考试化学试题海南省海口市第四中学2020-2021学年高二上学期期中考试化学试题重庆市万州纯阳中学2020-2021学年高二上学期期中考试化学试题内蒙古通辽市开鲁县第一中学2021届高三上学期第三次阶段性考试化学试题天津市第八中学2020-2021学年高二上学期第三次统练化学试题黑龙江嫩江市高级中学2020-2021学年高二上学期期末考试化学试题华中师范大学海南附属中学2019-2020学年高二上学期第三次月考化学试题广西贺州市中学2020-2021学年高二上学期第三次月考化学试题山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高二上学期期末考试化学试题河北省衡水市武邑武罗学校2020-2021学年高二上学期期中考试化学试题(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)作业05 化学反应的方向-2021年高二化学暑假作业(人教版2019)江苏省苏州实验中学2020-2021学年高二下学期3月份学情调研考试化学试题河南省内乡县第三高级中学2021-2022学年高二上学期第一次月考化学试卷河北省定州中学2018届高三(承智班)上学期期中考试化学试题北京市第十四中学2021-2022学年高二上学期期中考试化学试题江西省九校2021-2022学年高二上学期期中联考化学试题吉林省吉林市永吉县第四中学2021-2022学年高二上学期期中考试化学试题江苏省盐城市实验高级中学(新洋高级中学)2020-2021学年高二下学期期中考试化学试题(已下线)2.3 化学反应的方向(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期期中考试化学试题(已下线)2.2.1 化学反应的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)安徽省六安市新安中学2021-2022学年高二上学期12月月考化学试题辽宁省辽河油田第一高级中学2021-2022学年高二上学期月考化学试题(A部)江西省宜春市铜鼓中学2021-2022学年高二下学期开学考化学试题北京市丰台区2021-2022学年高二上学期期中练习化学(B)试题安徽省阜阳市临泉县第一中学2021-2022学年高二下学期开学考试化学试题第三节 化学反应的方向北京市第一五六中学2021-2022学年高二上学期期中考试化学试题安徽省太和县第八中学2021-2022学年高二上学期期中考试化学试题河南省确山县第二高级中学2021-2022学年高三上学期期中考试化学试题贵州省黔东南州凯里市第一中学2022-2023学年高二上学期期中考试化学试题浙江省舟山市舟山中学2022-2023学年高二上学期阶段性质量监测化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京市清华大学附属中学2022-2023学年高二上学期期中考试化学试题黑龙江省鸡西市第四中学2022-2023学年高二上学期期中考试化学试题 山东省济宁市泗水县2022-2023学年高二上学期期中考试化学试题湖北省黄石市有色第一中学2021-2022学年高二上学期期中考试化学试题(已下线)化学反应速率与化学平衡——课时6化学反应的方向(已下线)考点24 化学反应的方向(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)作业(九) 化学反应的方向陕西省渭南市白水县2020~2021学年高二上学期期末考试化学试题浙江省台州市台州八校联盟2022-2023学年高二上学期11月期中联考化学试题江西省永修县第一中学2023-2024学年高二上学期开学考试化学试题辽宁省大连市第八中学2021-2022学年高一下学期期中考试化学试题福建省宁德第一中学2023-2024学年高二上学期9月月考化学试题北京市八一学校2022-2023学年高二上学期期中考试化学试题甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题云南省中央民族大学附属中学昆明五华实验学校2023-2024学年高二上学期期中考试化学试题吉林省吉林市第四中学2023-2024学年高二上学期9月月考化学试题
单选题
|
较易(0.85)
9. 已知: △H,不同条件下反应过程能量变化如图所示,下列说法中正确的是
△H,不同条件下反应过程能量变化如图所示,下列说法中正确的是
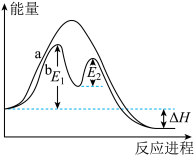
 △H,不同条件下反应过程能量变化如图所示,下列说法中正确的是
△H,不同条件下反应过程能量变化如图所示,下列说法中正确的是
| A.过程b使用了催化剂 | B.反应的△H>0 |
| C.使用催化剂可以降低反应的△H | D.过程b发生两步反应,第一步为放热反应 |
【知识点】 吸热反应和放热反应解读 催化剂对化学反应速率的影响解读
您最近一年使用:0次
2022-11-06更新
|
115次组卷
|
2卷引用:北京市第七中学2022-2023学年高二上学期期中化学试题
单选题
|
适中(0.65)
名校
10. CuCl2溶液中存在如下平衡:[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(黄色)+4H2O △H>0。下列可使黄绿色的CuCl2溶液变成蓝色的方法是
[CuCl4]2-(黄色)+4H2O △H>0。下列可使黄绿色的CuCl2溶液变成蓝色的方法是
 [CuCl4]2-(黄色)+4H2O △H>0。下列可使黄绿色的CuCl2溶液变成蓝色的方法是
[CuCl4]2-(黄色)+4H2O △H>0。下列可使黄绿色的CuCl2溶液变成蓝色的方法是| A.升温 | B.加NaCl(s) | C.加压 | D.加AgNO3(s) |
您最近一年使用:0次
2022-11-17更新
|
259次组卷
|
18卷引用:北京市西城区2020-2021学年高二上学期期末考试化学试题
北京市西城区2020-2021学年高二上学期期末考试化学试题北京市八十中2020-2021学年高二下学期开学考试化学试题北京市回民学校2021-2022学年高二上学期期中考试化学试题北京师范大学第二附属中学未来科技城学校2021-2022学年高二上学期期中考试化学试题北京市石景山区第九中学2021-2022学年高二上学期期中考试化学试题北京市师范大学亚太实验学校2021-2022学年高二上学期期中考试化学试题北京市中国农业大学附属中学2021-2022学年高二上学期期中学业水平调研化学试题黑龙江省大庆市第二中学2022-2023学年高二上学期第一次月考化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京师范大学第二附属中学2022-2023学年高二上学期期中考试化学试题天津市南开大学附属中学2022-2023学年高二上学期期中阶段检测化学试题北京市第四十三中学2021-2022学年高二上学期期中考试化学试题天津市南开区2022-2023学年高二上学期阶段性质量监测化学试题山西省阳泉市第一中学校2022-2023学年高二上学期11月期中考试化学试题北京市北京医学院附属中学2022-2023学年高二上学期期中考试化学试题北京市中国人民大学附属中学通州校区2023-2024学年高二上学期10月月考化学试题北京市第十一中学2022-2023学年高二上学期期中考试化学试卷黑龙江省哈尔滨市第四中学校2023-2024学年高二上学期11月月考化学试题
单选题
|
适中(0.65)
名校
11. 痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为:
 。下列说法
。下列说法不正确 的是

 。下列说法
。下列说法| A.饮食中摄入过多食盐,会加重痛风病病情 | B.大量饮水会增大痛风病发作的可能性 |
| C.寒冷季节更易诱发关节疼痛 | D.患痛风病的人应少吃能代谢产生更多尿酸的食物 |
【知识点】 浓度对化学平衡移动的影响解读 温度对化学平衡移动的影响解读
您最近一年使用:0次
2024-02-21更新
|
520次组卷
|
43卷引用:北京市西城区2019-2020学年度高二上学期期末考试化学试题
北京市西城区2019-2020学年度高二上学期期末考试化学试题上海市奉贤区2020届高三5月教学质量调研(二模)化学试题湖北省黄冈市麻城市实验高中2020-2021学年高二上学期10月月考化学试题江西省赣州市南康中学2020-2021学年高二上学期第二次大考化学试题内蒙古阿荣旗第一中学2020-2021学年高二上学期期中考试化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第三次月考化学试题北京市第四十三中学2020-2021学年高二上学期12月月考化学试题辽宁省葫芦岛市2020-2021学年高二上学期期末考试化学试题北京市房山区2020-2021学年高二上学期期末考试化学试题河南省焦作市县级重点中学2021-2022学年高二上学期期中考试化学试题吉林省长白山第二高级中学校2021-2022学年高三上学期第二次月考化学试题北京市第四十四中学2021-2022学年高二上学期期中考试化学试题北京市顺义区杨镇第一中学2021-2022学年高二上学期期中考试化学试题 北京市房山区2022-2023学年高二上学期期中质量检测化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题广东省信宜市第二中学2022-2023学年高二上学期11月月考化学试题广东省珠海市实验中学2022-2023学年高二上学期第一次段考化学试题北京市顺义区2023届高三第一次统练化学试题广东省汕头市聿怀中学2022-2023学年高二上学期期末线上考试化学试题安徽省宣城市2022-2023学年高二上学期期末调研考试化学试题广东省河源市龙川县第一中学2022-2023学年高二上学期期末考试化学试题(已下线)专题15 化学反应速率和化学平衡新疆乌鲁木齐市第四中学2022-2023学年高二下学期期中阶段诊断测试化学试题(已下线)第05讲 影响化学平衡的因素-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)云南省玉溪师范学院附属中学2022-2023学年高二下学期期末考试化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二上学期11月期中检测化学试题北京市清华大学附属中学2023-2024学年高二上学期期中考试化学试题北京市第六十六中学2023-2024学年高二上学期期中质量检测化学试题黑龙江省哈尔滨市第三十二中学校2023-2024学年高二上学期11月期中考试化学试题北京市大兴区兴华中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷北京市第一六六中学2022-2023学年高二上学期期中考试化学试卷北京师范大学第二附属中学2023-2024学年高二上学期期中考试化学试题浙江省宁波三锋教研联盟2023-2024学年高二上学期期中联考化学试题河南省信阳市淮滨县2022-2023学年高二上学期11月期中考试化学试题甘肃省平凉市第二中学2022-2023学年高二上学期期末考试(延考)化学试题四川省内江市2025届第三中学高二上学期化学试卷北京市北京师范大学附属中学平谷第一分校2023-2024学年高二上学期期中考试化学试题北京市顺义区2022-2023学年高三上学期第一次统练化学试卷黑龙江省哈尔滨师范大学附属中学2024-2025学年高二上学期10月阶段性考试 化学试卷北京市陈经纶中学2024-2025学年高二上学期10月月考 化学试题
单选题
|
较易(0.85)
12. 在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
下列叙述不正确的是(溶液体积变化忽略不计)
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
A.0~6min的平均反应速率:v(H2O2)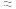 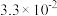 mol/(L·min) mol/(L·min) |
B.6~10min的平均反应速率:v(H2O2)<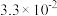 mol/(L·min) mol/(L·min) |
| C.反应至6min时,c(H2O2)=0.3mol/L |
| D.反应至6min时,H2O2分解了50% |
【知识点】 化学反应的速率的定义、计算
您最近一年使用:0次
2019-01-30更新
|
5574次组卷
|
102卷引用:2014年全国普通高等学校招生统一考试理科综合能力测试化学(北京卷)
2014年全国普通高等学校招生统一考试理科综合能力测试化学(北京卷)(已下线)2013-2014河南省南阳市春期高一期终质量评估化学试卷2014-2015北京市66中高二上学期期中考试化学(理)试卷2015届河北省衡水冀州中学高三12月月考化学试卷2015-2016学年山东省东营市一中高二第一学期开学收心考试化学试卷2015-2016学年陕西省西安一中高二上10月月考化学试卷2015-2016学年河北省衡水二中高二上期中测试化学试卷2016-2017学年山东省实验中学高二上开学测化学试卷2016-2017学年湖南省长沙明德中学高二上开学测化学试卷2016-2017学年河北省定兴三中高二上学期第一次月考化学试卷2016-2017学年江苏省泰州中学高二上月考一化学试卷2016-2017学年河北省冀州中学高二上期中化学卷广东省广州市第二中学2016-2017学年高二下学期期中考试化学试题湖北省荆州中学2016-2017学年高一下学期5月阶段测化学试题山东省泰安市第一中学2016-2017学年高一下学期学情检测化学试题浙江省2018版考前特训(2017年10月)学考70快练:化学反应速率及反应限度河北省定州中学2018届高三上学期高中毕业班第一次调研化学试题浙江省名校协作体2018届高三上学期考试化学试题河北省大名县第一中学2017-2018学年高二上学期第一次月考化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题A内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B四川省成都外国语学校2017-2018学年高二上学期期中考试化学试题浙江省温州中学2017-2018学年高二上学期期中考试化学试题山西省平遥中学2017-2018学年高二上学期期中考试化学试题北京师大附中2017-2018学年上学期高二年级期中考试化学试卷福建省莆田第一中学2017-2018学年高二下学期期初考试化学试题(已下线)第13天 化学反应速率的计算——《每日一题·2018快乐暑假》高二化学(已下线)2018年9月4日 《每日一题》人教必修4-化学反应速率的计算(已下线)2018年9月20日 《每日一题》一轮复习-化学反应速率的计算与比较【全国校级联考】山西省汾阳市第二高级中学、文水县第二高级中学2016-2017学年高二上学期第一次联考化学试题【全国百强校】河北省辛集中学2019届高三上学期期中考试化学试题人教版高二化学选修4 第二章 第一节 化学反应速率练习题【校级联考】安徽省滁州市定远县西片区2018-2019学年高二上学期期中考试化学试题(已下线)2018年12月24日 《每日一题》人教选修4-化学反应速率大小的比较安徽省定远重点中学2019届高三上学期第三次月考化学试题(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(教学案)四川省成都市实验中学2018-2019学年高二上学期期末考试模拟(二)化学试题【全国百强校】贵州省贵阳市第一中学2018-2019学年高二上学期第一次月考化学试题(已下线)第13天 化学反应速率的计算——《2019年暑假作业总动员》高二化学黑龙江省哈尔滨尚志中学2018-2019学年高一下学期期中考试化学试题北京四中2018-2019学年高一下学期期末考试化学试题(已下线)2019年9月19日 《每日一题》2020年高考一轮复习-化学反应速率的计算与比较福建省三明市第一中学2020届高三上学期第一次月考化学试题黑龙江省绥化市青冈县第一中学2019-2020学年高二上学期(A)班月考化学试题江西省宜春市宜丰县第二中学2019-2020学年高二上学期期中考试化学试题2019—2020学年高二上学期化学期末复习—选择题专题训练一(已下线)2019年12月19日 《每日一题》化学人教版(选修4)——化学反应速率大小的比较山西省运城市景胜中学2019-2020学年高二12月月考化学试题安徽省滁州市定远县育才学校2019-2020学年高二(实验班)上学期第三次月考化学试题云南省陇川县民族中学2019-2020学年高二上学期期末考试化学试题安徽省滁州市民办高中2019-2020学年高二上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 转化率与产率的相关计算(基础过关)夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 转化率与产率的相关计算(提升练)人教版高中化学必修2第二章《化学反应与能量》测试卷2(已下线)【新东方】2020-4(已下线)【南昌新东方】2019 新建一中 高一下期中云南省昆明市禄劝彝族苗族自治县第一中学2019-2020学年高二下学期期中考试化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第五次综合测试化学试题湖南省长沙市第一中学2019-2020学年高一下学期第三次月考化学试题宁夏回族自治区石嘴山市第三中学2019-2020学年高二下学期期末考试化学试题吉林省吉林市吉化第一高级中学校2019-2020学年高一下学期期末考试化学试题(已下线)第二章 化学反应速率和化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)第2章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)高一必修第二册(人教2019版)第六章 化学反应与能量 素养检测鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 第三节 化学反应的快慢和限度 高考帮安徽省定远县育才学校2020-2021学年高二上学期第一次月考化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP415(2)】【化学】(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】99北京市石景山区2020-2021学年高二上学期期末调研化学试题人教版2019必修第二册 第六章 第二节 第1课时 化学反应的速率(已下线)专题10 化学平衡(速率、影响因素、图像、标志、平衡压强及常数)-2021年高考化学必做热点专题(已下线)考向21 化学反应速率及影响因素-备战2022年高考化学一轮复习考点微专题甘肃省静宁县第一中学2021-2022学年高二上学期第一次月考(普通班)化学试题辽宁省沈阳市东北育才双语学校2021-2022学年高二上学期期中考试化学试题北京三中2021-2022学年高二上学期期中考试化学试题(已下线)专题2 综合评价(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)河北省唐山市开滦第一中学2021-2022学年高二上学期期中考试化学试题北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题北京市和平街第一中学2021-2022学年高三下学期保温化学试题山东省德州市2020-2021学年高二上学期反应原理月考(B)化学试题(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)江西省宜春市万载中学2021-2022学年高二上学期第二次月考化学试题北京市第一五六中学2021-2022学年高二上学期期中考试化学试题云南省富源县第一中学2020-2021学年高二上学期第一次统测化学试题云南省广南县第一中学2021-2022学年高三下学期3月考试理综化学试题黑龙江省佳木斯市第八中学2021-2022学年高一下学期期末考试化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京市第四十三中学2021-2022学年高二上学期期中考试化学试题浙江省绍兴蕺山外国语学校2021-2022学年高一下学期期中考试化学试题吉林省长春市东北师范大学附属中学2022-2023学年高一下学期大练习九化学试题湖南省邵阳市第二中学2022-2023学年高一下学期期末考试化学试题作业(十三) 化学反应的历程和化学反应速率河南省南阳市第一中学校2023-2024学年高二上学期开学考试化学试题(已下线)合格考汇编13化学反应速率和限度上海市吴淞中学2023-2024学年高二上学期第一学段考试化学试题重庆市璧山来凤中学2023-2024学年高二上学期12月月考化学试题山东省菏泽市单县二中2022-2023学年高一下学期6月段考化学试题安徽省芜湖市第一中学2022-2023学年高二上学期10月月考化学试卷北京市第三十五中学2023-2024学年高一下学期(选考)期中测试化学试题山东省临沂第十八中学2023-2024学年高一下学期6月份阶段性测试化学试题北京师范大学附属中学2024-2025学年高二上学期10月月考 化学试题
单选题
|
较易(0.85)
名校
解题方法
13. 如图所示为工业合成氨的流程图,下列说法错误的是
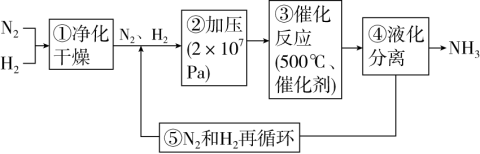

| A.步骤①中“净化”可以防止催化剂中毒 |
| B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率 |
| C.步骤③既可以加快反应速率,又有利于提高原料平衡的转化率 |
| D.步骤④、⑤可以提高原料的转化率,又可以节约原料,降低成本 |
您最近一年使用:0次
2022-09-15更新
|
182次组卷
|
4卷引用:北京市第一五六中学2021-2022学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
名校
14. 在密闭容器发生下列反应aA(g)⇌cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.a<c+d | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.A的转化率变大 |
【知识点】 压强对化学平衡移动的影响解读
您最近一年使用:0次
2021-02-23更新
|
3063次组卷
|
30卷引用:湖北省石首市第一中学2020-2021学年高二上学期10月月考化学试题
湖北省石首市第一中学2020-2021学年高二上学期10月月考化学试题北京东城区2019-2020学年高二下学期期中考试化学试题山西省太原市第五十六中学2021-2022学年高二上学期10月月考化学试题江苏省连云港市赣榆智贤中学2022-2023学年高二上学期第一次学情检测化学试题广东省佛山市南海区桂城中学2022-2023学年高二上学期第一次段考化学试题广东省三校联考2022-2023学年高二上学期期中考试化学试题北京市第七中学2022-2023学年高二上学期期中化学试题陕西省安康市2022-2023学年高二上学期11月期中化学试题湖北省沙市中学2022-2023学年高二上学期第二次月考化学试题湖北省宜城一中、枣阳一中等六校联考2022-2023学年高二上学期期中考试化学试题广西钦州市浦北中学2022-2023学年高二上学期期中考试化学试题浙江省金华市横店高中2022-2023学年高二上学期10月份检测化学试题山西省太原市第五十六中学2022-2023学年高二上学期10月联考化学试题广东省惠州市实验中学2022-2023学年高二上学期期中考试化学试题湖南省怀化市雅礼实验学校2022-2023学年高二上学期第一次月考化学试题陕西省西安市鄠邑区2022-2023学年高二上学期期末质量检测化学(理)试题广东省佛山市三水中学2022-2023学年高二上学期11月第二次统测化学试题吉林省长春市新解放学校2022-2023学年高二上学期11月月考化学试题浙江省海盐高级中学2023-2024学年高二上学期10月阶段测化学试题北京市八一学校2022-2023学年高二上学期期中考试化学试题广东省深圳市盐田高级中学2023-2024高二上学期期中考试化学试题黑龙江省牡丹江市第二高级中学2023-2024学年高二上学期10月月考化学试题广东省佛山市顺德区第一中学2023-2024学年高二上学期11月期中考试化学试题广西桂林市平乐县平乐中学2023-2024学年高二上学期10月月考化学试题安徽省安庆市怀宁县高河中学2023-2024学年高二上学期第二次月考化学试题湖北省黄冈市黄梅国际育才高级中学2023-2024学年高二上学期10月月考化学试题浙江省嘉兴市平湖市当湖高级中学2024-2025学年高二上学期9月月考化学试题浙江省温州市苍南县金乡卫城中学2023-2024学年高二上学期10月份检测化学试题牡丹江市第二高级中学2024-2025学年高二上学期10月月考 化学试题甘肃省庆阳市宁县第一中学2024-2025学年高二上学期期中考试化学试卷
单选题
|
适中(0.65)
名校
您最近一年使用:0次
2022-11-06更新
|
124次组卷
|
2卷引用:北京市第七中学2022-2023学年高二上学期期中化学试题
单选题
|
适中(0.65)
名校
解题方法
16. 下列溶液肯定显酸性的是
A.含 的溶液 的溶液 | B.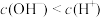 的溶液 的溶液 |
| C.pH<7的溶液 | D.加酚酞显无色的溶液 |
您最近一年使用:0次
2024-03-11更新
|
265次组卷
|
29卷引用:2014-2015福建省三明一中高二上学期第二次月考化学试卷
2014-2015福建省三明一中高二上学期第二次月考化学试卷湖南省嘉禾一中、临武一中2017-2018学年高二上学期期中联考化学试题【全国省级联考】广东省蓝精灵中学2017-2018 学年度高二上学期期末联考化学试题内蒙古自治区巴彦淖尔市临河三中2018-2019学年高二上学期第二次月考化学试题【区级联考】北京市西城区2018-2019学年高二上学期期末考试化学试题北京师范大学附中2019-2020学年高二上学期期中考试化学试题甘肃省武威第六中学2019-2020学年高二上学期第三次学段考试化学试题北京市第十二中学2020-2021学年高二上学期期末考试化学试题北京市第十四中学2021-2022学年高二上学期期中考试化学试题北京师范大学第二附属中学未来科技城学校2021-2022学年高二上学期期中考试化学试题内蒙古包头市2021-2022学年高二上学期期末考试化学试题贵州省贵阳市2021-2022学年高二上学期期末考试化学试题北京市第八中学2021-2022学年高二上学期期末考试化学试题北京市第四中学顺义分校2021-2022学年高二上学期期中考试化学试题上海市松江二中2022-2023学年高三上学期10月学情调研化学试题北京市第七中学2022-2023学年高二上学期期中化学试题浙江省诸暨市第二高级中学2021-2022学年高二上学期期中考试化学试题广东顺佛山市顺德区文德学校2021-2022学年高二上学期第二次阶段性测试化学试题北京师范大学第二附属中学2023-2024学年高二上学期10月月考化学试题北京市大兴区兴华中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷内蒙古赤峰第四中学2023-2024学年高二上学期12月期中考试化学试题北京市北京师范大学附属中学平谷第一分校2023-2024学年高二上学期期中考试化学试题河北省石家庄康福外国语学校2023-2024学年高二上学期期中考试化学试题广东省潮州市松昌中学2023-2024学年高二上学期期中考试化学试题广东省东莞市三校2023-2024学年高二下学期4月期中联考化学试题3.2.2 溶液的酸碱性与pH课堂例题湖南省邵阳市海谊中学2023-2024学年高二上学期11月期中考试化学试题新疆墨玉县第二高级中学2023-2024学年高二上学期11月月考化学试题
单选题
|
较易(0.85)
名校
17. 下列不能表明醋酸是弱电解质的是
| A.0.1mol/L的醋酸水溶液中,c(H+)约为10-3mol/L |
| B.常温下同浓度醋酸水溶液的导电性比盐酸弱 |
| C.醋酸水溶液能使紫色石蕊试液变红 |
| D.醋酸稀溶液中同时存在CH3COOH和CH3COO- |
【知识点】 弱电解质的电离平衡
您最近一年使用:0次
2022-09-15更新
|
335次组卷
|
6卷引用:北京市第一五九中学2021-2022学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
名校
18. 25°C时,下列关于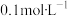 醋酸溶液的判断正确的是
醋酸溶液的判断正确的是
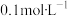 醋酸溶液的判断正确的是
醋酸溶液的判断正确的是A. | B.与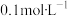 盐酸的 盐酸的 相同 相同 |
C.加入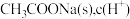 不变 不变 | D.滴入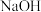 浓溶液,溶液导电性增强 浓溶液,溶液导电性增强 |
【知识点】 弱电解质的电离平衡 弱电解质电离平衡的影响因素
您最近一年使用:0次
2019-03-09更新
|
306次组卷
|
8卷引用:【区级联考】北京市西城区2018-2019学年高二上学期期末考试化学试题
单选题
|
较易(0.85)
19. 一定温度下,反应I2(g)+H2(g)⇌2HI(g)在密闭容器中达到平衡时,测得c(H2)=c(I2)=0.11mmol•L-1,c(HI)=0.78mmol•L-1。相同温度下,按下列4组初始浓度进行实验,反应逆向进行的是(注:1mmol•L-1=10-3mol•L-1)
| A | B | C | D | |
| c(I2)/mmol•L-1 | 1.00 | 0.22 | 0.44 | 0.11 |
| c(H2)/mmol•L-1 | 1.00 | 0.22 | 0.44 | 0.44 |
| c(HI)/mmol•L-1 | 1.00 | 1.56 | 4.00 | 1.56 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-08-19更新
|
4804次组卷
|
39卷引用:2020年北京市高考化学试卷
2020年北京市高考化学试卷北京市一零一中学2020-2021学年高二上学期期中考试化学试题(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)北京市第四十三中学2021届高三上学期1月月考化学试题新疆维吾尔自治区巴州二中2021届高三第六次月考化学试题(已下线)难点4 化学反应速率与化学平衡图表分析-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)2.4 化学反应的调控-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)课时37 化学平衡常数-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向22 化学平衡状态 化学平衡的移动-备战2022年高考化学一轮复习考点微专题山西省太原市2021-2022学年高二上学期期中考试化学试题北京师范大学附属中学2021-2022学年高二上学期期中考试化学试题2020年北京高考化学真题变式题1-10(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)山东省泰安市2021-2022学年高二上学期期末考试化学试题(已下线)考点23 化学平衡常数-备战2023年高考化学一轮复习考点帮(全国通用)第二章 综合拔高练北京市第四中学顺义分校2021-2022学年高二上学期期中考试化学试题北京师范大学附属中学2020-2021学年高二上学期期中考试化学试题北京市第七中学2022-2023学年高二上学期期中化学试题河南省商丘名校联盟2022-2023学年高二上学期期中考试化学试题河南省兰考县第一高级中学2022-2023学年高二上学期期中考试化学试题天津市和平区2022-2023学年高二上学期期末质量调查化学试卷天津市和平区2022-2023学年高二上学期期末质量检测化学试题 (已下线)化学反应速率与化学平衡——进阶学习(已下线)第七章 化学反应速率与化学平衡 第41讲 化学平衡状态 化学平衡常数(已下线)题型120 化学平衡常数的概念和应用(已下线)北京市第四中学2022-2023学年高三下学期零模化学试题(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)第二章 化学反应速率与化学平衡 第二节 化学平衡 第2课时 化学平衡常数北京市育才学校2023-2024学年高二上学期10月月考化学试题北京市八一学校2022-2023学年高二上学期期中考试化学试题北京市昌平区第二中学2023-2024高二上学期期中考试化学试题黑龙江省牡丹江市海林市朝鲜族中学2023-2024学年高二上学期第一次月考化学试题北京市育才学校2024-2025学年高二上学期10月月考化学试题北京市顺义牛栏山第一中学2024-2025学年高二上学期10月月考 化学试题
单选题
|
适中(0.65)
名校
20. 下列实验事实不能用平衡移动原理解释的是
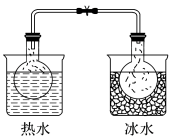 NO2球浸在冷水和热水中 |
| ||||||||
| A | B | ||||||||
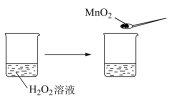 |
| ||||||||
| C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-10-15更新
|
206次组卷
|
6卷引用:上海市上海中学2021届高三上学期期中考试化学试题
单选题
|
较易(0.85)
名校
解题方法
21. 工业上可通过甲醇羰基化法制取甲酸甲酯( ):
):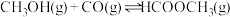 ,在容积固定的密闭容器中,投入等物质的量
,在容积固定的密闭容器中,投入等物质的量 和CO,测得相同时间内CO的转化率随温度变化如下图所示。下列说法
和CO,测得相同时间内CO的转化率随温度变化如下图所示。下列说法不正确 的是
 ):
):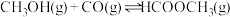 ,在容积固定的密闭容器中,投入等物质的量
,在容积固定的密闭容器中,投入等物质的量 和CO,测得相同时间内CO的转化率随温度变化如下图所示。下列说法
和CO,测得相同时间内CO的转化率随温度变化如下图所示。下列说法
| A.增大压强甲醇转化率增大 |
B.b点反应速率 |
C.平衡常数 ,反应速率 ,反应速率 |
| D.生产时反应温度控制在80~85℃为宜 |
您最近一年使用:0次
2022-05-10更新
|
1023次组卷
|
31卷引用:北京市西城区2019-2020学年度高二上学期期末考试化学试题
北京市西城区2019-2020学年度高二上学期期末考试化学试题北京市中央民族大学附属中学2019-2020学年高二下学期期末考试化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡北京市第四十三中学2020-2021学年高二上学期12月月考化学试题江苏省海安高级中学2020-2021学年度高二上学期第二次合格性考试化学(选修)试题北京市大兴区2020-2021学年高二上学期期末考试化学试题北京市八十中2020-2021学年高二下学期开学考试化学试题辽宁省营口市第二高级中学2021-2022学年高二上学期第一次月考化学试题北京市回民学校2021-2022学年高二上学期期中考试化学试题(已下线)综合复习与测试(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)福建省三明第一中学2021-2022学年高二上学期第二次月考化学试题福建省莆田第一中学2021-2022学年高二下学期期中考试化学试题北京市北京师范大学附属实验中学2021-2022学年高一下学期练习卷化学试题(已下线)第11练 以化学平衡图像突破化学平衡移动原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)北京市师范大学亚太实验学校2021-2022学年高二上学期期中考试化学试题北京市第四十四中学2021-2022学年高二上学期期中考试化学试题北京市第四中学顺义分校2021-2022学年高二上学期期中考试化学试题陕西省西安市雁塔区第二中学2021-2022学年高二上学期第一次月考化学试题河北省石家庄新乐市第一中学2022-2023学年高二上学期第一次月考化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京市第四十三中学2021-2022学年高二上学期12月月考化学试题北京师范大学附属中学2022-2023学年上学期高二化学期末试题(已下线)云南省昌宁县第一中学2022-2023学年高二下学期期末考试化学试题北京市育才学校2023-2024学年高二上学期10月月考化学试题北京市西城区2022-2023学年育才学校高二上学期化学期中考试北京市第二十二中学2023-2024学年高二上学期期中考试化学试题北京市2023-2024学年第二十二中学高二上学期化学期中试题北京市第一六六中学2022-2023学年高二上学期期中考试化学试卷北京市第十一中学2022-2023学年高二上学期期中考试化学试卷北京市育才学校2024-2025学年高二上学期10月月考化学试题北京师范大学燕化附属中学2024-2025学年高二上学期10月月考 化学试题
二、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
名校
22. 氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2mol ,放出92.2kJ热量。写出合成氨反应的热化学方程式
,放出92.2kJ热量。写出合成氨反应的热化学方程式_______ ;该可逆反应,若起始时向容器内放入2mol  和6mol
和6mol  ,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)
,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______ 184.4kJ。
(2)反应 的化学平衡常数表达式为
的化学平衡常数表达式为_______ 。请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是_______ 。
(3)在一定条件下氨的平衡含量如下表。
其他条件不变时,温度升高氨的平衡含量改变的原因是_______ (填字母序号)。
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是_______ 。
(4)如图是合成氨反应平衡混合气中 的体积分数随温度或压强变化的曲线,图中L(
的体积分数随温度或压强变化的曲线,图中L( 、
、 )、X分别代表温度或压强。其中X代表的是
)、X分别代表温度或压强。其中X代表的是_______ (填“温度”或“压强”);判断小 、
、 的大小关系并说明理由
的大小关系并说明理由_______ 。
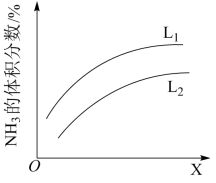
(1)合成氨工业中,合成塔中每产生2mol
 ,放出92.2kJ热量。写出合成氨反应的热化学方程式
,放出92.2kJ热量。写出合成氨反应的热化学方程式 和6mol
和6mol  ,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)
,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)(2)反应
 的化学平衡常数表达式为
的化学平衡常数表达式为| 序号 | 化学反应 | K(298K)的数值 |
| ① |  |  |
| ② |  |  |
| 温度/℃ | 压强/Mpa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是
(4)如图是合成氨反应平衡混合气中
 的体积分数随温度或压强变化的曲线,图中L(
的体积分数随温度或压强变化的曲线,图中L( 、
、 )、X分别代表温度或压强。其中X代表的是
)、X分别代表温度或压强。其中X代表的是 、
、 的大小关系并说明理由
的大小关系并说明理由
您最近一年使用:0次
2022-11-06更新
|
129次组卷
|
3卷引用:北京市第七中学2022-2023学年高二上学期期中化学试题
三、填空题 添加题型下试题
填空题
|
适中(0.65)
23. 五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g)⇌PCl5(g) ΔH = -93.0 kJ/mol。某温度下,在2.0 L密闭容器中充入1.0 mol PCl3和0.5 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
请回答
(1)0~150 s内,υ(PCl3)=_______ mol/(L·s)。
(2)升高温度,平衡向_______ (填“正”或“逆”)反应方向移动。
(3)平衡时,PCl3的转化率是_______ 。
(4)该温度下,此反应的化学平衡常数数值为_______
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.21 | 0.36 | 0.40 | 0.40 |
(1)0~150 s内,υ(PCl3)=
(2)升高温度,平衡向
(3)平衡时,PCl3的转化率是
(4)该温度下,此反应的化学平衡常数数值为
【知识点】 化学平衡的有关计算
您最近一年使用:0次
2022-09-15更新
|
167次组卷
|
2卷引用:北京市第一五九中学2021-2022学年高二上学期期中考试化学试题
填空题
|
适中(0.65)
24. 弱电解质在水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为_______ 。
②下列方法中,可以使醋酸溶液中 电离程度增大的是
电离程度增大的是_______ (填字母序号)。
a.滴加少量浓盐酸 b.加水稀释 c.加入少量醋酸钠晶体 d.升高温度
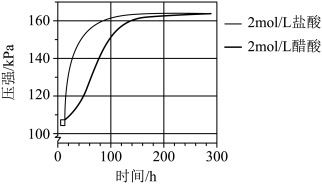
③两个密闭装置中各装入0.05g镁条,分别加入2mL2mol/L盐酸和醋酸。压强随时间变化如图所示。_______ 。原因是:_______ 。反应结束后两个容器中压强相等说明_______ 。
(2)某些弱酸在25℃时的电离常数如下:
①上述酸中酸性最强的是_______ 。
②25℃时,若次氯酸中初始HClO的物质的最浓度为0.01mol/L,达到电离平衡时溶液中
_______ mo/L。(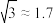 )
)
③下列反应可以发生的是_______ (填字母)。
A.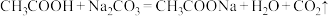
B.
C.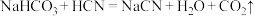
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为
②下列方法中,可以使醋酸溶液中
 电离程度增大的是
电离程度增大的是a.滴加少量浓盐酸 b.加水稀释 c.加入少量醋酸钠晶体 d.升高温度
③两个密闭装置中各装入0.05g镁条,分别加入2mL2mol/L盐酸和醋酸。压强随时间变化如图所示。
(2)某些弱酸在25℃时的电离常数如下:
| 化学式 |  | HSCN | HCN | HClO |  |
| 电离常数 |  | 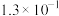 |  |  | 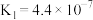 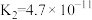 |
②25℃时,若次氯酸中初始HClO的物质的最浓度为0.01mol/L,达到电离平衡时溶液中

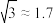 )
)③下列反应可以发生的是
A.
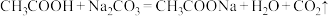
B.

C.
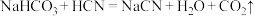
您最近一年使用:0次
2022-11-06更新
|
195次组卷
|
2卷引用:北京市第七中学2022-2023学年高二上学期期中化学试题
四、解答题 添加题型下试题
解答题-工业流程题
|
适中(0.65)
名校
解题方法
25. 习近平总书记在世界领导人气候峰会上指出,中国将在2030年前实现“碳达峰”、2060年前实现“碳中和”。这是中国基于推动构建人类命运共同体的责任担当和实现可持续发展的内在要求作出的重大战略决策。因此CO2的捕集、创新利用与封存成为科学家研究的重要课题。
Ⅰ.最近有科学家提出“绿色自由”构想:先把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如图:
(1)上述工艺中采用气液逆流接触吸收(空气从吸收池底部进入,溶液从顶部喷淋),其目的是___ 。写出吸收池中反应的化学方程式___ 。
(2)根据表中键能写出合成塔中反应的热化学方程式 ___ 。
(3)合成塔中制备甲醇的反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___ 。
(4)下列物质能作为CO2捕获剂的是___ (填标号)。
Ⅱ.CO2和H2合成甲烷也是CO2资源化利用的重要方法。
(5)一定条件下Pd—Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图1所示,该反应的化学方程式为___ ,反应过程中碳元素的化合价为-2价的中间体是___ 。___ ,使用的合适温度为___ 。
Ⅰ.最近有科学家提出“绿色自由”构想:先把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如图:
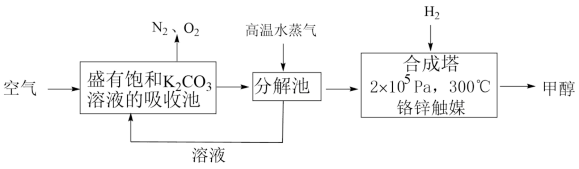
| 化学键 | H—H | C—O | C=O | H—O | C—H |
| 键能/(kJ•mol-1) | 436 | 326 | 803 | 464 | 414 |
(2)根据表中键能写出合成塔中反应的
(3)合成塔中制备甲醇的反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
A.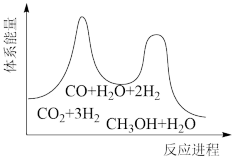 | B.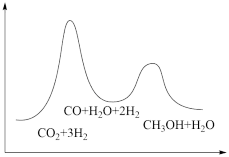 |
C.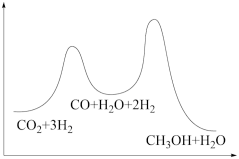 | D.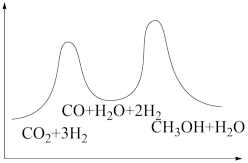 |
| A.NaOH溶液 | B.NH4Cl溶液 | C.CH3CH2OH | D.浓氨水 |
(5)一定条件下Pd—Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图1所示,该反应的化学方程式为
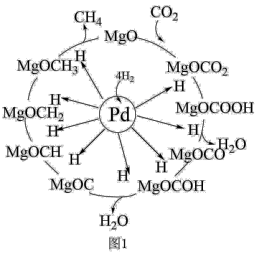
您最近一年使用:0次
2021-12-02更新
|
501次组卷
|
9卷引用:江苏省盱眙中学2021-2022学年上学期高二年级期中考试化学试题
江苏省盱眙中学2021-2022学年上学期高二年级期中考试化学试题湖北省沙市中学2022-2023学年高二上学期第一次月考化学试题山西省太原市第五中学校2022-2023学年高二上学期10月月考化学试题北京市第七中学2022-2023学年高二上学期期中化学试题云南省玉溪市第一中学2023届高三上学期11月月考化学试题江苏省苏州市工业园区三校20232024学年高二上学期10月联考化学试题广东省吴川市两校2023-2024学年高二上学期期中联考化学试卷江苏省苏州市西安交通大学苏州附属中学2024-2025学年高二上学期第一次月考化学试题江苏省苏州第一中学2024-2025学年高一上学期第一次月考化学试题
解答题-实验探究题
|
适中(0.65)
26. 亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。
I.称取样品Wg;
II.向样品中加入足量稀硫酸;
III.将I中产生的 用足量
用足量 溶液吸收;
溶液吸收;
IV.将III所得硫酸溶液用氢氧化钠标准液滴定;
V.数据处理。
(1) 是一种食品添加剂。写出
是一种食品添加剂。写出 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:_______ 。
(2)步骤III中反应的化学方程式_______ 。
(3)步骤IV中可选用的指示剂为_______ 。如图显示滴定终点时,滴定管(量程为25mL)读数为_______ 。
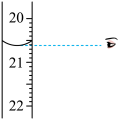
(4)步骤IV中消耗0.010mol/L NaOH溶液V mL,则1kg样品中含 的质量是
的质量是_______ g(用含W、V的代数式表示)。
(5)步骤IV中的下列操作会造成该实验亚硫酸盐含量测定结果偏低的有_______
 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。I.称取样品Wg;
II.向样品中加入足量稀硫酸;
III.将I中产生的
 用足量
用足量 溶液吸收;
溶液吸收;IV.将III所得硫酸溶液用氢氧化钠标准液滴定;
V.数据处理。
(1)
 是一种食品添加剂。写出
是一种食品添加剂。写出 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:(2)步骤III中反应的化学方程式
(3)步骤IV中可选用的指示剂为

(4)步骤IV中消耗0.010mol/L NaOH溶液V mL,则1kg样品中含
 的质量是
的质量是(5)步骤IV中的下列操作会造成该实验亚硫酸盐含量测定结果偏低的有
| A.量取一定体积待测硫酸溶液前,酸式滴定管未用待测硫酸溶液润洗 |
| B.装入氢氧化钠标准液前,碱式滴定管未用氢氧化钠标准液润洗 |
| C.锥形瓶内用水冲洗后未干燥 |
| D.在滴定过程中发现局部溶液发生色变就立即停止滴定 |
您最近一年使用:0次
解答题-工业流程题
|
较难(0.4)
名校
27. 《中国锰业》一文提出用废铁屑还原软锰矿,制取高纯硫酸锰的工艺流程如下图所示。某公司提供的软锰矿,其主要成分是二氧化锰,其中还含有少量Fe、CaO、MgO、 及重金属等。
及重金属等。
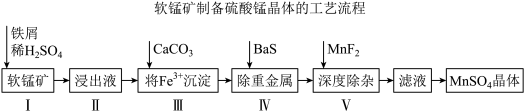
(1)I中加铁屑而不加铁块的原因是_______ 。
(2)写出I中铁屑与软锰矿发生的主要反应的离子方程式_______ 。
(3)加 之前需要加双氧水的作用
之前需要加双氧水的作用_______ ,结合下表说明,加 控制溶液pH的范围是
控制溶液pH的范围是_______ 。
可能用到的数据如下,不同金属离子沉淀的pH
已知: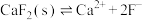 ,
,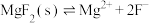
(4)深度除杂中加入 的作用是除去钙离子、镁离子,用平衡移动原理解释
的作用是除去钙离子、镁离子,用平衡移动原理解释_______ 。
(5)从滤液中获取 晶体的方法是
晶体的方法是_______ 、趁热过滤。
硫酸锰在不同温度下的溶解度表
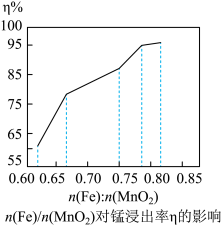
(6)为探究稀硫酸介质中湿法还原软锰矿制备硫酸锰的最佳工艺条件,研究了 对锰浸出率η的影响。如图实验条件为
对锰浸出率η的影响。如图实验条件为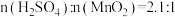 ,反应温度为50℃,反应时间为80min。请结合图像分析
,反应温度为50℃,反应时间为80min。请结合图像分析 约为
约为_______ 最合适,并说出理由_______ 。
 及重金属等。
及重金属等。
(1)I中加铁屑而不加铁块的原因是
(2)写出I中铁屑与软锰矿发生的主要反应的离子方程式
(3)加
 之前需要加双氧水的作用
之前需要加双氧水的作用 控制溶液pH的范围是
控制溶液pH的范围是可能用到的数据如下,不同金属离子沉淀的pH
| 氢氧化物 |  |  |  |
| 开始沉淀pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全pH | 3.7 | 9.7 | 9.8 |
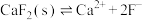 ,
,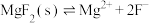
(4)深度除杂中加入
 的作用是除去钙离子、镁离子,用平衡移动原理解释
的作用是除去钙离子、镁离子,用平衡移动原理解释(5)从滤液中获取
 晶体的方法是
晶体的方法是硫酸锰在不同温度下的溶解度表
| 温度/℃ | 50 | 80 | 90 | 100 |
| 溶解度l(/100g水) | 58 | 48 | 42 | 34 |
 对锰浸出率η的影响。如图实验条件为
对锰浸出率η的影响。如图实验条件为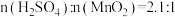 ,反应温度为50℃,反应时间为80min。请结合图像分析
,反应温度为50℃,反应时间为80min。请结合图像分析 约为
约为
您最近一年使用:0次
2022-11-06更新
|
292次组卷
|
2卷引用:北京市第七中学2022-2023学年高二上学期期中化学试题
试卷分析
导出
整体难度:适中
考查范围:化学反应原理、化学实验基础、物质结构与性质、化学与STSE、认识化学科学、常见无机物及其应用
试卷题型(共 27题)
题型
数量
单选题
21
解答题
4
填空题
2
试卷难度
知识点分析
细目表分析
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 常见能量转化形式 燃烧发电的能量转化过程 | |
| 2 | 0.94 | 盖斯定律 盖斯定律与热化学方程式 | |
| 3 | 0.85 | 盖斯定律 盖斯定律与热化学方程式 | |
| 4 | 0.65 | 吸热反应和放热反应 盖斯定律理解 盖斯定律的应用 | |
| 5 | 0.65 | ||
| 6 | 0.85 | 测定溶液pH的方法 化学实验基本操作 | |
| 7 | 0.65 | 化学反应中能量变化的原因 影响化学平衡的因素 化学键与化学反应本质联系 绿色化学与可持续发展 | |
| 8 | 0.65 | 熵判据 复合判据 反应进行方向判据的应用 | |
| 9 | 0.85 | 吸热反应和放热反应 催化剂对化学反应速率的影响 | |
| 10 | 0.65 | 化学平衡的移动及其影响因素 浓度对化学平衡移动的影响 温度对化学平衡移动的影响 压强对化学平衡移动的影响 | |
| 11 | 0.65 | 浓度对化学平衡移动的影响 温度对化学平衡移动的影响 | |
| 12 | 0.85 | 化学反应的速率的定义、计算 | |
| 13 | 0.85 | 催化剂对化学反应速率的影响 化学平衡的移动及其影响因素 勒夏特列原理的应用 | |
| 14 | 0.65 | 压强对化学平衡移动的影响 | |
| 15 | 0.65 | 强电解质与弱电解质 | |
| 16 | 0.65 | 水的离子积常数 影响水电离的因素 溶液的酸碱性与pH的关系 生活中常见物质的酸碱性 | |
| 17 | 0.85 | 弱电解质的电离平衡 | |
| 18 | 0.65 | 弱电解质的电离平衡 弱电解质电离平衡的影响因素 | |
| 19 | 0.85 | 化学平衡常数的计算 | |
| 20 | 0.65 | 浓度对化学平衡移动的影响 勒夏特列原理的应用 电离平衡常数及影响因素 | |
| 21 | 0.85 | 影响化学反应速率的因素 化学平衡图像分析 温度对化学平衡移动的影响 压强对化学平衡移动的影响 | |
| 二、解答题 | |||
| 22 | 0.65 | 温度对化学平衡移动的影响 压强对化学平衡移动的影响 化学平衡常数的概念及表达方式 | 原理综合题 |
| 25 | 0.65 | 氧化还原反应方程式的书写与配平 盖斯定律与热化学方程式 根据△H=反应物的键能之和-生成物的键能之和计算 常见有机物的制备 | 工业流程题 |
| 26 | 0.65 | 酸碱中和滴定实验基本操作及步骤 酸碱中和滴定原理的应用 酸碱中和滴定的误差分析 | 实验探究题 |
| 27 | 0.4 | 有关铁及其化合物转化的流程题型 浓度对难溶电解质溶解平衡的影响 溶度积规则及其应用 锰的重要化合物的制备 | 工业流程题 |
| 三、填空题 | |||
| 23 | 0.65 | 化学平衡的有关计算 | |
| 24 | 0.65 | 弱电解质的电离方程式 电离平衡常数及影响因素 同离子效应对电离的影响 | |

 H2(g)+
H2(g)+




