2015-2016学年江西省南昌市八一中学等三校高二上期末联考化学试卷
江西
高二
期末
2017-07-27
363次
整体难度:
适中
考查范围:
化学反应原理、化学实验基础、认识化学科学
一、单选题 添加题型下试题
| A.铝片与稀盐酸反应 | B.甲烷在氧气中的燃烧反应 |
| C.氢气还原三氧化钨 | D.Ba(OH)2•8H2O与NH4Cl反应 |
【知识点】 反应热
| A.凡是放热反应都是自发反应 |
| B.凡是熵增大的反应都是自发反应 |
| C.不自发的化学反应就不能进行 |
| D.要判断反应进行的方向,必须综合考虑体系的焓变和熵变 |
【知识点】 化学反应进行方向的判据 复合判据解读
| A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 |
| B.将溶液倒在pH试纸上,跟标准比色卡比较 |
| C.用干燥洁净的玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 |
| D.在试管内放少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较 |
| A.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++HSO4- |
B.H2SO3的电离方程式:H2SO3 2H++SO32- 2H++SO32- |
| C.CaCO3的电离方程式:CaCO3=Ca2++CO32 |
D.CO32-的水解方程式:CO32-+2H2O H2CO3+2OH-- H2CO3+2OH-- |
| A.pH=7的溶液 | B.酸与碱恰好完全反应生成正盐的溶液 |
| C.使石蕊试液呈紫色的溶液 | D.c(H+)=c(OH-)=10-6mol/L溶液 |
【知识点】 溶液的酸碱性与pH
| A.把pH=2的甲酸溶液稀释100倍后pH=3.5 |
| B.50mL l mol·L-1的甲酸溶液恰好与50mL l mol·L-1的NaOH溶液完全反应 |
| C.甲酸钠HCOONa溶液能使酚酞试液变红 |
| D.0.1 mol·L-1的甲酸溶液的pH约为2 |
【知识点】 弱电解质的电离
①电解池是将化学能转变为电能的装置②原电池是将电能转变成化学能的装置③金属和石墨导电均为物理变化,电解质溶液导电是化学变化④不能自发进行的氧化还原反应,通过电解的原理有可能实现⑤电镀过程相当于金属的“迁移”,可视为物理变化
| A.①②③④ | B.③④ | C.③④⑤ | D.④ |
【知识点】 原电池 电解原理 电解原理的应用 电解原理的理解及判断解读
| A.①=②=③=④ | B.①>③>②>④ | C.④=②>③=① | D.①=③>②=④ |
【知识点】 影响水电离的因素解读 水溶液中水的电离程度及的计算解读
| A.甲一定是强碱 | B.乙一定是弱碱 |
| C.乙一定是二元碱 | D.甲一定是一元碱 |
【知识点】 水的电离及溶液的酸碱性
 3C(g)的下列叙述中,能说明反应已经达到平衡的是
3C(g)的下列叙述中,能说明反应已经达到平衡的是| A.单位时间内消耗amolA,同时生成3amolC |
| B.容器的压强不再变化 |
| C.C的生成速率与B的生成速率的比为3:2 |
| D.混合气体的物质的量不再变化 |
【知识点】 化学平衡
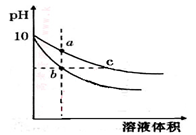
| A.b、c两点溶液的导电能力不相同 |
| B.a、b、c三点溶液中水的电离程度a>c>b |
| C.用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vb=Vc |
| D.c点溶液中C(H+) + C(CH3COOH)= C(OH-) |
【知识点】 水的电离及溶液的酸碱性 盐类的水解
| A.7.3×10-13 mol·L-1 | B.1.8×10-13 mol·L-1 |
| C.2.3 mol·L-1 | D.3.7 mol·L-1 |
【知识点】 化学计量
| A.在滴加酸碱指示剂酚酞试液后呈现红色的溶液中:Na+、Cl-、AlO2-、CO32- |
| B.在由水电离出的c(H+)=1×10-12mol/L的溶液中: HCO3-、Al3+、NH4+、ClO- |
| C.在c(H+)/c(OH-)=1×1012的溶液中:Fe2+、Mg2+、CO32-、NO3- |
| D.在AlCl3溶液中:K+、NO3-、S2-、Na+ |
【知识点】 离子共存 无附加条件的离子共存解读 物质共存解读 限定条件下的离子共存解读
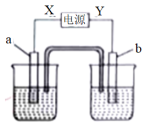
| 选项 | a | b | X | 溶液 |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
| A.A | B.B | C.C | D.D |
【知识点】 电解原理的应用 电解原理的理解及判断解读
二、填空题 添加题型下试题
(1)NH4Cl溶液显
(2)氨水显碱性的原因(用离子方程式表示)
(3)Mg(OH)2浊液中存在Mg(OH)2的溶解平衡,可表示为(用离子方程式表示)
(4)用离子方程式解释下列事实
①盛NaF溶液要用塑料瓶而不能用玻璃瓶
②盛纯碱溶液的试剂瓶用橡胶塞而不能用玻璃塞
【知识点】 水溶液中的离子反应和平衡
三、解答题 添加题型下试题
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示:所用盐酸溶液的体积为

(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
D.酸式滴定管在滴定前有气泡,滴定后气泡消失
(4)某学生根据三次实验分别记录有关数据如下表:请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三交 | 25.00 | 0.22 | 26.31 | 26.09 |
【知识点】 酸碱中和滴定实验相关仪器解读 酸碱中和滴定指示剂选择解读
四、填空题 添加题型下试题
| A.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
(1)若溶液中只溶解了一种溶质,该溶质的名称是
(2)若上述关系中D是正确的,则溶液中溶质的化学式是
(3)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)

(1)B为电源的
(2)在电解一段时间后在甲中加入适量
(3)在常温下,现用丙装置给铁镀铜,当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为
(4)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为
【知识点】 电解池
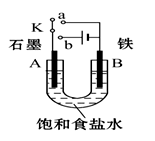
(1)若开始时开关K与a连接,则B极的电极反应式为
(2)若开始时开关K与b连接,总反应的离子方程式为
有关上述(2)实验,下列说法正确的是(填序号)
①溶液中Na+向A极移动
②若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
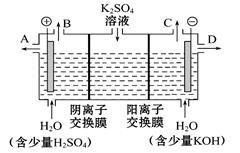
①该电解槽的阳极反应式为
②若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为
【知识点】 原电池
a、2NO(g)+Cl2(g)
 2ClNO(g) ∆H1 <0 其平衡常数为K1
2ClNO(g) ∆H1 <0 其平衡常数为K1b、2NO2(g)+NaCl(s)
 NaNO3(s)+ClNO(g)∆H2 < 0 其平衡常数为K2
NaNO3(s)+ClNO(g)∆H2 < 0 其平衡常数为K2(1)4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g) ∆H3 的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g) ∆H3 的平衡常数K=(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应a达到平衡。测得10min内V(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=
II第三代混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图:
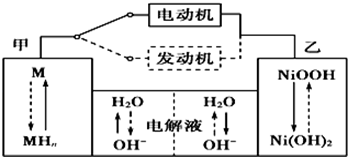
其总反应式为H2+2NiOOH
 2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时(放电),甲电极周围溶液的pH
2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时(放电),甲电极周围溶液的pH试卷分析
导出试卷题型(共 22题)
试卷难度
知识点分析
细目表分析
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 强电解质与弱电解质 | |
| 2 | 0.64 | 反应热 | |
| 3 | 0.85 | 化学反应进行方向的判据 复合判据 | |
| 4 | 0.85 | 测定溶液pH的方法 化学实验基本操作 | |
| 5 | 0.64 | 弱电解质的电离 盐类的水解 | |
| 6 | 0.65 | 溶液的酸碱性与pH | |
| 7 | 0.64 | 弱电解质的电离 | |
| 8 | 0.85 | 原电池 电解原理 电解原理的应用 电解原理的理解及判断 | |
| 9 | 0.65 | 影响水电离的因素 水溶液中水的电离程度及的计算 | |
| 10 | 0.64 | 水的电离及溶液的酸碱性 | |
| 11 | 0.64 | 化学平衡 | |
| 12 | 0.65 | 金属的电化学腐蚀与防护 | |
| 13 | 0.64 | 水的电离及溶液的酸碱性 盐类的水解 | |
| 14 | 0.94 | 化学计量 | |
| 15 | 0.4 | 离子共存 无附加条件的离子共存 物质共存 限定条件下的离子共存 | |
| 16 | 0.65 | 电解原理的应用 电解原理的理解及判断 | |
| 二、填空题 | |||
| 17 | 0.64 | 水溶液中的离子反应和平衡 | |
| 19 | 0.4 | 弱电解质的电离 盐类的水解 | |
| 20 | 0.64 | 电解池 | |
| 21 | 0.4 | 原电池 | |
| 22 | 0.15 | 化学反应热的计算 化学平衡 化学电源 | |
| 三、解答题 | |||
| 18 | 0.65 | 酸碱中和滴定实验相关仪器 酸碱中和滴定指示剂选择 | 实验探究题 |



