山西省运城市稷山中学2023-2024学年高二上学期11月月考化学试题
山西
高二
阶段练习
2024-10-10
42次
整体难度:
容易
考查范围:
认识化学科学、化学反应原理、化学实验基础、常见无机物及其应用
山西省运城市稷山中学2023-2024学年高二上学期11月月考化学试题
山西
高二
阶段练习
2024-10-10
42次
整体难度:
容易
考查范围:
认识化学科学、化学反应原理、化学实验基础、常见无机物及其应用
一、单选题 添加题型下试题
1. 中华民族的发明创造为人类文明进步做出了巨大贡献,下列过程主要是利用化学反应中能量变化的是
| A | B | C | D |
|
|
|
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-02更新
|
509次组卷
|
11卷引用:北京一零一中学2021-2022学年高二上学期期中考试化学试题
北京一零一中学2021-2022学年高二上学期期中考试化学试题北京市第五十五中学2021-2022学年高二上学期期中考试化学试题北京市第五十五中学2022-2023学年高二上学期期中考试化学试题浙江省杭州市四校2023-2024学年高二上学期10月联考化学试题北京市东直门中学2022-2023学年高二上学期期中考试化学试题广东省深圳市光明区高级中学2023-2024学年高二上学期10月月考化学试题宁夏银川市育才中学2023-2024学年高二上学期期中考试化学试题吉林省四平市第一高级中学2023-2024学年高二上学期第二次月考化学试卷四川省自贡市第二十二中学校2023-2024学年高二上学期期中考试化学试题广东省陆河外国语学校2023-2024学年高二上学期第二次月考化学试题山西省运城市稷山中学2023-2024学年高二上学期11月月考化学试题
单选题
|
较易(0.85)
名校
解题方法
2. 下列做法的目的与改变化学反应速率无关的是
| A.在糕点包装内放置小包除氧剂 |
| B.在糖果制作过程中添加着色剂 |
| C.高炉炼铁前先将铁矿石粉碎 |
| D.牛奶在冰箱里保存 |
您最近一年使用:0次
2023-09-22更新
|
149次组卷
|
6卷引用:北京市清华大学附属中学2023-2024学年高二上学期(G22级)统练二化学试题
单选题
|
适中(0.65)
名校
解题方法
3. 下列仪器、pH试纸读数时,需要精确到0.01的是
|
|
|
|
| A.滴定管 | B.量筒 | C.托盘天平 | D.广泛pH试纸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-12更新
|
68次组卷
|
3卷引用:黑龙江省海伦市第一中学2022-2023学年高二上学期11月期中考试化学试题
单选题
|
较易(0.85)
名校
解题方法
4. 可逆反应2HI(g)  H2(g)+I2(g)在体积固定的密闭容器中,下列说法
H2(g)+I2(g)在体积固定的密闭容器中,下列说法不能 说明反应达到化学平衡状态的是
 H2(g)+I2(g)在体积固定的密闭容器中,下列说法
H2(g)+I2(g)在体积固定的密闭容器中,下列说法| A.混合气体的压强不再改变 |
| B.混合气体的颜色不再改变 |
| C.H2的体积分数不再变化 |
| D.HI的转化率不再改变 |
您最近一年使用:0次
2022-01-02更新
|
450次组卷
|
6卷引用:北京一零一中学2021-2022学年高二上学期期中考试化学试题
单选题
|
较易(0.85)
名校
解题方法
5. 工业上处理含CO、SO2烟道气的一种方法是将其在催化剂作用下转化为S和CO2。已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol; S(s)+O2(g)=SO2(g) ΔH=-296 kJ/mol;则该条件下2CO(g)+SO2(g)=S(s)+2CO2(g)的ΔH等于
| A.- 270 kJ/mol | B.+26 kJ/mol | C.-582 kJ/mol | D.+270 kJ/mol |
【知识点】 盖斯定律 盖斯定律与热化学方程式解读
您最近一年使用:0次
2021-01-24更新
|
1781次组卷
|
34卷引用:北京市西城区2020-2021学年高二上学期期末考试化学试题
北京市西城区2020-2021学年高二上学期期末考试化学试题北京市八十中2020-2021学年高二下学期开学考试化学试题北京市回民学校2021-2022学年高二上学期期中考试化学试题北京市第十五中学2021-2022学年高二上学期期中考试化学试题北京市清华附中2021-2022学年高一下学期期末考试化学试题第一章化学反应的热效应北京市师范大学亚太实验学校2021-2022学年高二上学期期中考试化学试题北京市中国农业大学附属中学2021-2022学年高二上学期期中学业水平调研化学试题北京十四中2022-2023学年高二上学期期中检测化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京师范大学第二附属中学2022-2023学年高二上学期期中考试化学试题北京市顺义区顺义第一中学2022-2023学年高二上学期期中考试化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题广西百色民族高级中学2022-2023学年高二上学期10月阶段检测化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题新疆阿勒泰地区2022-2023学年高一下学期期末考试化学试题(已下线)专题02 盖斯定律、反应热的计算【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)北京市育才学校2023-2024学年高二上学期10月月考化学试题北京市东直门中学2022-2023学年高二上学期期中考试化学试题北京市北京医学院附属中学2022-2023学年高二上学期期中考试化学试题江西省抚州市临川第一中学2023-2024学年高二上学期期中考试 化学试卷北京市西城区2022-2023学年育才学校高二上学期化学期中考试北京市顺义区2023-2024学年第九中学高二上学期化学期中试题北京市中国人民大学附属中学通州校区2023-2024学年高二上学期10月月考化学试题北京市通州区2023-2024学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2023-2024学年高二上学期期中考试化学试题北京市第十一中学2022-2023学年高二上学期期中考试化学试卷四川省自贡市第二十二中学校2023-2024学年高二上学期期中考试化学试题北京师范大学附属昌平学校2023-2024学年高二上学期12月月考化学试题天津市河东区2023-2024学年高二上学期1月期末化学试题北京市顺义区第二中学2023-2024学年高二上学期10月月考化学试题广东省陆河外国语学校2023-2024学年高二上学期第二次月考化学试题山西省运城市稷山中学2023-2024学年高二上学期11月月考化学试题北京市第十一中学顺义分校2024-2025学年高二上学期10月月考 化学试题
单选题
|
适中(0.65)
名校
解题方法
6.  时,水的电离达到平衡:
时,水的电离达到平衡: ,下列叙述正确的是
,下列叙述正确的是
 时,水的电离达到平衡:
时,水的电离达到平衡: ,下列叙述正确的是
,下列叙述正确的是A.将纯水加热到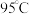 时, 时, 变大, 变大, 不变,水仍呈中性 不变,水仍呈中性 |
B.向纯水中加入稀氨水,平衡逆向移动, 增大, 增大, 变小 变小 |
C.向纯水中加入少量NaOH固体, 增大, 增大, 不变,影响水的电离平衡 不变,影响水的电离平衡 |
| D.向纯水中加入盐酸,可抑制水的电离;加入醋酸,可促进水的电离 |
您最近一年使用:0次
2023-01-02更新
|
706次组卷
|
13卷引用:海南省海南中学2019-2020学年高二上学期期末考试化学试题
海南省海南中学2019-2020学年高二上学期期末考试化学试题河北省邯郸市大名县第一中学2022-2023学年高二上学期第一次月考化学试题甘肃省张掖市高台县第一中学2022-2023学年高二上学期期中考试化学试题陕西省咸阳市武功县2022-2023学年高二上学期期中考试化学试题广西壮族自治区梧州市苍梧中学2022-2023学年高二上学期11月月考化学试题辽宁省兴城市高级中学2022-2023学年高二上学期期末线上质量检测化学试题第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 第1课时 水的电离 溶液的酸碱性与pH甘肃省张掖市高台县第一中学2023-2024学年高二上学期10月月考化学试题陕西省汉中市乡县第一中学2023-2024学年高二上学期10月月考化学试题广东省梅州市大埔县虎山中学2023-2024学年高二上学期10月期中考试化学试题吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题江西省南昌十九中2022-2023学年高二上学期期末考试化学试卷 山西省运城市稷山中学2023-2024学年高二上学期11月月考化学试题
单选题
|
适中(0.65)
名校
7. 下列事实不能用平衡移动原理解释的是
| A.氯水在光照下颜色变浅,最终变为无色 |
| B.夏天打开啤酒瓶,有很多气泡冒出 |
| C.由NO2(g)、N2O4(g)组成的平衡体系通过缩小体积加压后颜色变深 |
| D.实验室用排饱和食盐水的方法收集Cl2 |
您最近一年使用:0次
2021-12-21更新
|
520次组卷
|
11卷引用:广东省广州中学2021-2022学年高二上学期期中考试化学试题
广东省广州中学2021-2022学年高二上学期期中考试化学试题广东省揭阳市榕城区仙桥中学2021-2022学年高二下学期期中考试化学试题云南省昆明市第一中学2021-2022学年高二下学期期中考试化学试题江西省景德镇市乐平中学2021-2022学年高二下学期期末质量检测化学试题浙江省温州新力量联盟2022-2023学年高二 上学期期中联考化学试题广东省广州市从化区从化中学2022-2023学年高二上学期期中考试化学试题北京市东直门中学2022-2023学年高二上学期期中考试化学试题广东省深圳市光明区高级中学2023-2024学年高二上学期10月月考化学试题四川省内江市2025届第三中学高二上学期化学试卷四川省自贡市第二十二中学校2023-2024学年高二上学期期中考试化学试题山西省运城市稷山中学2023-2024学年高二上学期11月月考化学试题
单选题
|
适中(0.65)
名校
解题方法
8. 已知反应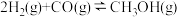 的平衡常数如下表。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列大小比较正确的是( )
的平衡常数如下表。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列大小比较正确的是( )
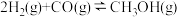 的平衡常数如下表。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列大小比较正确的是( )
的平衡常数如下表。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列大小比较正确的是( )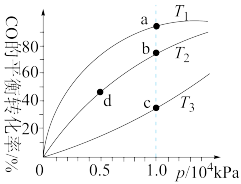
温度/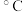 | 500 | 700 | 800 |
平衡常数 | 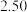 | 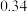 | 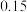 |
A.平衡常数: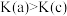 , , |
B.正反应速率: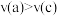 , , |
C.达到平衡所需时间: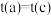 , ,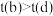 |
D.平均相对分子质量: , ,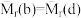 |
您最近一年使用:0次
2020-10-10更新
|
178次组卷
|
9卷引用:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷
(已下线)2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷2019年10月23日《每日一题》2019-2020学年高二化学人教选修4——化学平衡常数的应用鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时3 化学平衡图象人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时4 化学平衡图象选择性必修1 专题2 第三单元 课时2 化学平衡常数的应用2.3.2温度 催化剂对化学平衡的影响 课后福建省南平市浦城县2022-2023学年高二上学期11月期中化学试题吉林省东北师范大学连山实验高中2023-2024学年高二上学期第一次月考化学试题山西省运城市稷山中学2023-2024学年高二上学期11月月考化学试题
单选题
|
适中(0.65)
名校
解题方法
9. 浓度均为 、体积均为
、体积均为 的
的 和
和 溶液,分别加水稀释至体积
溶液,分别加水稀释至体积 ,
, 随
随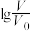 的变化如图所示。下列叙述错误的是
的变化如图所示。下列叙述错误的是
 、体积均为
、体积均为 的
的 和
和 溶液,分别加水稀释至体积
溶液,分别加水稀释至体积 ,
, 随
随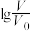 的变化如图所示。下列叙述错误的是
的变化如图所示。下列叙述错误的是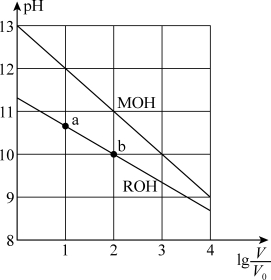
A.MOH的碱性强于 的碱性 的碱性 |
B. 的电离程度:b点大于a点 的电离程度:b点大于a点 |
C.若两溶液无限稀释,则它们的 相等 相等 |
D.当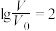 时,若两溶液同时升高温度,则 时,若两溶液同时升高温度,则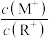 增大 增大 |
您最近一年使用:0次
2023-02-18更新
|
689次组卷
|
11卷引用:题型128 一元酸(碱)溶液加水稀释后溶液的判断图像
(已下线)题型128 一元酸(碱)溶液加水稀释后溶液的判断图像四川省成都市第七中学2023-2024学年高二上学期10月月考化学试题第1讲 弱电解质的电离平衡辽宁省沈阳市第十中学2021-2022学年高二上学期第一次月考化学试题四川省内江市2023-2024学年第一中学高二上学期化学试卷河南省信阳市第二高级中学2023-2024学年高二上学期10月阶段测试化学试题福建省福州市闽 闽侯县第一中学2023-2024学年高二上学期12月月考化学试题广东省揭阳市2022届高考化学模拟试卷 (已下线)第01讲 电离平衡(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)(已下线)考点巩固卷11 水溶液中的离子反应与平衡(一)(9大考法)-2025年高考化学一轮复习考点通关卷(新高考通用)山西省运城市稷山中学2023-2024学年高二上学期11月月考化学试题
二、多选题 添加题型下试题
多选题-2个答案
|
适中(0.65)
10. 已知反应式:mX(g)+nY(?) pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的
pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的 ,c(X)=0.5mol/L,下列说法正确的是
,c(X)=0.5mol/L,下列说法正确的是
 pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的
pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的 ,c(X)=0.5mol/L,下列说法正确的是
,c(X)=0.5mol/L,下列说法正确的是| A.反应向正方向移动 | B.Y可能是固体或液体 |
| C.化学计量数n>m | D.Z的体积分数减小 |
【知识点】 影响化学平衡的因素
您最近一年使用:0次
三、单选题 添加题型下试题
单选题
|
适中(0.65)
真题
名校
11. 常温下,关于pH相等的盐酸和醋酸溶液(两溶液的OH-浓度也相等),下列说法正确的是( )
| A.c(HCl)>c(CH3COOH) |
| B.c(Cl-)=c(CH3COO-) |
| C.等体积的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多 |
| D.用相同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多 |
您最近一年使用:0次
2017-11-04更新
|
1761次组卷
|
17卷引用:2016年4月浙江省普通高校招生选考科目考试化学试题
2016年4月浙江省普通高校招生选考科目考试化学试题江西省樟树中学2017-2018学年高二下学期第三次月考化学试题浙江省宁波诺丁汉大学附属中学2017-2018学年高一下学期期末考试化学试题浙江省宁波市余姚中学2018-2019学年高二上学期期中考试化学试题云南省腾冲市第八中学2018-2019学年高二下学期期中考试化学试题(已下线)【新东方】高中化学101黑龙江省绥化市青冈县第一中学2019-2020学年高二上学期期中考试(B班)化学试题四川省广安市北京师范大学广安实验学校2019-2020学年高二下学期第三次月考化学试题河北省石家庄市辛集市第一中学2019-2020学年高二上学期第三次月考化学试题浙江省嘉兴市第五高级中学2018-2019学年高二下学期期中考试化学(学考)试题上海市嘉定区2020届高三上学期一模化学试题(已下线)专题14.水溶液中的离子平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)浙江省诸暨市2018-2019学年高一下学期期末考试化学试题 浙江省宁波市余姚中学2020-2021学年高二上学期期中考试化学试题上海市青浦高级中学 2022-2023学年高二上学期期末线上质量检测化学试题浙江省宁波三锋教研联盟2023-2024学年高二上学期期中联考化学试题山西省运城市稷山中学2023-2024学年高二上学期11月月考化学试题
单选题
|
适中(0.65)
名校
解题方法
12. 25℃时,向20.00mL 盐酸中滴加
盐酸中滴加 的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7.下列说法错误的是
的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7.下列说法错误的是
 盐酸中滴加
盐酸中滴加 的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7.下列说法错误的是
的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7.下列说法错误的是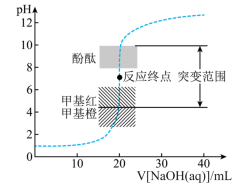
| A.NaOH与盐酸恰好完全反应时,pH=7 |
| B.当接近终点时,需加快滴定速度便于观察颜色突变 |
| C.选择甲基红指示反应终点,误差比甲基橙的小 |
| D.V[NaOH(aq)]=30.00mL时,pH≈12.3 |
【知识点】 酸碱中和滴定原理的应用解读 酸碱中和滴定的综合考查解读
您最近一年使用:0次
2021-12-04更新
|
98次组卷
|
4卷引用:河南省部分名校2021-2022学年高二上学期期中联考化学试题
单选题
|
适中(0.65)
名校
13. 血浆中存在H2CO3/ “缓冲”体系:H+(aq)+
“缓冲”体系:H+(aq)+ (aq)⇌H2CO3(aq)⇌CO2(aq)+H2O(aq)。该体系可使人体血液pH保持在7.35~7.45。下列说法正确的是
(aq)⇌H2CO3(aq)⇌CO2(aq)+H2O(aq)。该体系可使人体血液pH保持在7.35~7.45。下列说法正确的是
 “缓冲”体系:H+(aq)+
“缓冲”体系:H+(aq)+ (aq)⇌H2CO3(aq)⇌CO2(aq)+H2O(aq)。该体系可使人体血液pH保持在7.35~7.45。下列说法正确的是
(aq)⇌H2CO3(aq)⇌CO2(aq)+H2O(aq)。该体系可使人体血液pH保持在7.35~7.45。下列说法正确的是| A.“缓冲”作用,是指体系中增加少量强酸或强碱时,pH不会出现较大幅度变化 |
| B.血液中CO2浓度增大,会使上述平衡向正反应方向移动 |
| C.人体血液碱中毒时,可注射NaHCO3溶液缓解 |
D.该体系中一定不存在 |
【知识点】 弱电解质的电离平衡 影响盐类水解程度的主要因素
您最近一年使用:0次
2021-02-03更新
|
355次组卷
|
6卷引用:北京市东城区2020-2021学年高二上学期期末考试化学试题
四、填空题 添加题型下试题
填空题
|
适中(0.65)
解题方法
14. 已知水在常温和1000C的电离平衡曲线如图所示:___________ (填“A”、“B”),理由___________ 。
(2)常温下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为___________ 。
(3)1000C时,纯水的pH=___________ 。
(4)1000C,将pH=12的NaOH溶液与pH=3的H2SO4溶液混合,若所得混合溶液的pH=6,则NaOH溶液与H2SO4溶液的体积比为___________ 。

(2)常温下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(3)1000C时,纯水的pH=
(4)1000C,将pH=12的NaOH溶液与pH=3的H2SO4溶液混合,若所得混合溶液的pH=6,则NaOH溶液与H2SO4溶液的体积比为
您最近一年使用:0次
五、解答题 添加题型下试题
解答题-实验探究题
|
较易(0.85)
解题方法
15. 已知NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称取1.000g样品溶于水,配成250ml溶液;
②准确量取25.00ml所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.1000mol/L的盐酸滴定三次,每次消耗盐酸的体积记录如下:
(1)用___________ (填“酸式”或“碱式”)滴定管盛装0.1000mol/L的盐酸。
(2)判断滴定终点时的现象为___________ 。
(3)若出现下列情况,使测定结果偏高的是___________ (填字母)
A.滴定前用蒸馏水冲洗锥形瓶 B.酸式滴定管使用前,未用盐酸润洗
C.在振荡锥形瓶时不慎将瓶内溶液溅出 D.在滴定过程中不慎将数滴酸液滴在锥形瓶外
E.滴定终点读数时,俯视读数
(4)通过计算可知该烧碱样品的纯度为___________ 。(结果保留一位小数)
①称取1.000g样品溶于水,配成250ml溶液;
②准确量取25.00ml所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.1000mol/L的盐酸滴定三次,每次消耗盐酸的体积记录如下:
| 滴定序号 | 待测体积/ml | 所消耗盐酸的体积/ml | |
| 滴定前读数 | 滴定后读数 | ||
| I | 25.00 | 0.50 | 20.60 |
| Ⅱ | 25.00 | 6.00 | 26.00 |
| Ⅲ | 25.00 | 1.10 | 21.00 |
(1)用
(2)判断滴定终点时的现象为
(3)若出现下列情况,使测定结果偏高的是
A.滴定前用蒸馏水冲洗锥形瓶 B.酸式滴定管使用前,未用盐酸润洗
C.在振荡锥形瓶时不慎将瓶内溶液溅出 D.在滴定过程中不慎将数滴酸液滴在锥形瓶外
E.滴定终点读数时,俯视读数
(4)通过计算可知该烧碱样品的纯度为
您最近一年使用:0次
六、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
16. 一定温度下,在容积固定的V L密闭容器中加入n mol A.2n mol B,发生反应:A(g)+2B(g)  2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
A.物质A.B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)该反应的逆反应速率与时间的关系如图所示。

②t2时平衡向
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线
您最近一年使用:0次
2018-10-28更新
|
460次组卷
|
9卷引用:山西省朔州市第一中学2017-2018学年高二8月月考化学试题
山西省朔州市第一中学2017-2018学年高二8月月考化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二上学期10月月考化学试题新疆乌鲁木齐市二十三中学2018-2019学年高二10月月考化学试题福建省建瓯市芝华中学2019-2020学年高二上学期期中考试化学(1-2班)试题陕西省渭南韩城市2019-2020学年高二上学期期中考试化学试题湖北省黄冈麻城市第二中学2021届高三上学期第一次质量检测化学试题重庆育才中学2021-2022学年高二上学期第三次定时练习化学试题吉林省东北师范大学连山实验高中2023-2024学年高二上学期第一次月考化学试题山西省运城市稷山中学2023-2024学年高二上学期11月月考化学试题
填空题
|
较易(0.85)
名校
17. Ⅰ.已知下列热化学方程式:①H2(g)+ O2(g)=H2O(l) ∆H=-285kJ·mol-1,
O2(g)=H2O(l) ∆H=-285kJ·mol-1,
②H2(g)+ O2(g)=H2O(g) ∆H=-241.8kJ·mol-1,
O2(g)=H2O(g) ∆H=-241.8kJ·mol-1,
③C(s)+ O2(g)=CO(g) ∆H=-110.5kJ·mol-1,
O2(g)=CO(g) ∆H=-110.5kJ·mol-1,
④C(s)+O2(g)=CO2(g)ΔH=-393.5kJ·mol-1,回答下列问题:
(1)C燃烧热的热化学方程式为___________ ;(填序号)
(2)燃烧1gH2生成气态水,放出的热量为___________ 。
Ⅱ.中和热是一类重要的反应热,也是化学研究的重要课题。已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) ∆H1=-57.3kJ•mol-1。
(1)下列各组试剂混合发生反应的离子方程式为H++OH-=H2O的是___________ (填序号)。
A.盐酸与氢氧化钠溶液
B.稀硫酸与氢氧化钡溶液
C.醋酸与氢氧化钠固体
D.硫酸氢钠溶液与氢氧化钠溶液
E.氢氧化镁溶于稀盐酸
(2)若稀硫酸与氢氧化钠固体反应生成1molH2O(l),则反应放出的热量___________ (填“大于”“等于”或“小于”)57.3kJ,原因是___________ 。
Ⅲ.如图所示,某反应在不同条件下的反应历程分别为a、b。___________ (填“>”“<”或“=”,下同)生成物的总键能,则该反应的反应热∆H ___________ 0。
 O2(g)=H2O(l) ∆H=-285kJ·mol-1,
O2(g)=H2O(l) ∆H=-285kJ·mol-1,②H2(g)+
 O2(g)=H2O(g) ∆H=-241.8kJ·mol-1,
O2(g)=H2O(g) ∆H=-241.8kJ·mol-1,③C(s)+
 O2(g)=CO(g) ∆H=-110.5kJ·mol-1,
O2(g)=CO(g) ∆H=-110.5kJ·mol-1,④C(s)+O2(g)=CO2(g)ΔH=-393.5kJ·mol-1,回答下列问题:
(1)C燃烧热的热化学方程式为
(2)燃烧1gH2生成气态水,放出的热量为
Ⅱ.中和热是一类重要的反应热,也是化学研究的重要课题。已知强酸稀溶液与强碱稀溶液发生反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) ∆H1=-57.3kJ•mol-1。
(1)下列各组试剂混合发生反应的离子方程式为H++OH-=H2O的是
A.盐酸与氢氧化钠溶液
B.稀硫酸与氢氧化钡溶液
C.醋酸与氢氧化钠固体
D.硫酸氢钠溶液与氢氧化钠溶液
E.氢氧化镁溶于稀盐酸
(2)若稀硫酸与氢氧化钠固体反应生成1molH2O(l),则反应放出的热量
Ⅲ.如图所示,某反应在不同条件下的反应历程分别为a、b。

【知识点】 化学反应热的计算 中和热概念解读 表示燃烧热的热化学方程式书写解读
您最近一年使用:0次
2021-04-22更新
|
2327次组卷
|
8卷引用:吉林省长春市第二实验中学2020-2021学年高一下学期4月月考化学试题
吉林省长春市第二实验中学2020-2021学年高一下学期4月月考化学试题(已下线)作业01 反应热-2021年高二化学暑假作业(人教版2019)湖北省黄石市有色一中2020-2021学年高一下学期期末考试化学试题(已下线)1.2 燃烧热 能源-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第1章 化学反应的热效应(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)广西钦州市第四中学2023-2024学年高二上学期9月考试化学试卷广东省普宁市勤建学校2023-2024学年高二上学期10月月考化学试题山西省运城市稷山中学2023-2024学年高二上学期11月月考化学试题
试卷分析
导出
整体难度:适中
考查范围:认识化学科学、化学反应原理、化学实验基础、常见无机物及其应用
试卷题型(共 17题)
题型
数量
单选题
12
多选题
1
填空题
3
解答题
1
试卷难度
知识点分析
细目表分析
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 物理变化与化学变化 能量的相互转化 常见能量转化形式 | |
| 2 | 0.85 | 影响化学反应速率的因素 浓度对化学反应速率的影响 温度对化学反应速率的影响 | |
| 3 | 0.65 | 测定溶液pH的方法 酸碱中和滴定实验相关仪器 仪器使用与实验安全 常用仪器及使用方法 | |
| 4 | 0.85 | 化学平衡状态 化学平衡建立的过程 化学平衡状态本质及特征 化学平衡状态的判断方法 | |
| 5 | 0.85 | 盖斯定律 盖斯定律与热化学方程式 | |
| 6 | 0.65 | 水的离子积常数 影响水电离的因素 溶液中水的电离程度及计算 | |
| 7 | 0.65 | 次氯酸及其性质和用途 氯气与水的反应 化学平衡的移动 勒夏特列原理的应用 | |
| 8 | 0.65 | 化学平衡常数的影响因素及应用 化学平衡题中基于图表数据的相关计算 与转化率变化有关图像的分析 | |
| 9 | 0.65 | 一元强酸与一元弱酸的比较 弱电解质在水溶液中的电离平衡 | |
| 11 | 0.65 | 一元强酸与一元弱酸的比较 弱电解质在水溶液中的电离平衡 | |
| 12 | 0.65 | 酸碱中和滴定原理的应用 酸碱中和滴定的综合考查 | |
| 13 | 0.65 | 弱电解质的电离平衡 影响盐类水解程度的主要因素 | |
| 二、多选题 | |||
| 10 | 0.65 | 影响化学平衡的因素 | 2个答案 |
| 三、填空题 | |||
| 14 | 0.65 | 水的离子积常数 影响水电离的因素 酸碱混合时的定性判断及计算 | |
| 16 | 0.65 | 影响化学平衡的因素 化学平衡常数的计算 化学反应速率与化学平衡的综合应用 | |
| 17 | 0.85 | 化学反应热的计算 中和热概念 表示燃烧热的热化学方程式书写 | |
| 四、解答题 | |||
| 15 | 0.85 | 化学方程式中物质的量的运用 酸碱中和滴定原理的应用 酸碱中和滴定的误差分析 物质含量的测定 | 实验探究题 |