《中国锰业》一文提出用废铁屑还原软锰矿,制取高纯硫酸锰的工艺流程如下图所示。某公司提供的软锰矿,其主要成分是二氧化锰,其中还含有少量Fe、CaO、MgO、 及重金属等。
及重金属等。
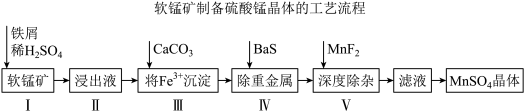
(1)I中加铁屑而不加铁块的原因是_______ 。
(2)写出I中铁屑与软锰矿发生的主要反应的离子方程式_______ 。
(3)加 之前需要加双氧水的作用
之前需要加双氧水的作用_______ ,结合下表说明,加 控制溶液pH的范围是
控制溶液pH的范围是_______ 。
可能用到的数据如下,不同金属离子沉淀的pH
已知: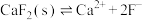 ,
,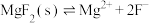
(4)深度除杂中加入 的作用是除去钙离子、镁离子,用平衡移动原理解释
的作用是除去钙离子、镁离子,用平衡移动原理解释_______ 。
(5)从滤液中获取 晶体的方法是
晶体的方法是_______ 、趁热过滤。
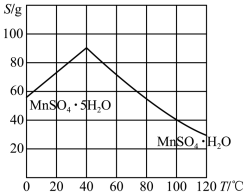
硫酸锰在不同温度下的溶解度表
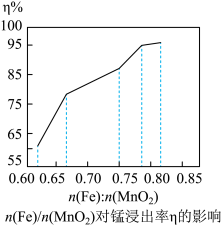
(6)为探究稀硫酸介质中湿法还原软锰矿制备硫酸锰的最佳工艺条件,研究了 对锰浸出率η的影响。如图实验条件为
对锰浸出率η的影响。如图实验条件为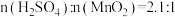 ,反应温度为50℃,反应时间为80min。请结合图像分析
,反应温度为50℃,反应时间为80min。请结合图像分析 约为
约为_______ 最合适,并说出理由_______ 。
 及重金属等。
及重金属等。
(1)I中加铁屑而不加铁块的原因是
(2)写出I中铁屑与软锰矿发生的主要反应的离子方程式
(3)加
 之前需要加双氧水的作用
之前需要加双氧水的作用 控制溶液pH的范围是
控制溶液pH的范围是可能用到的数据如下,不同金属离子沉淀的pH
| 氢氧化物 |  |  |  |
| 开始沉淀pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全pH | 3.7 | 9.7 | 9.8 |
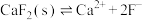 ,
,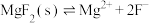
(4)深度除杂中加入
 的作用是除去钙离子、镁离子,用平衡移动原理解释
的作用是除去钙离子、镁离子,用平衡移动原理解释(5)从滤液中获取
 晶体的方法是
晶体的方法是硫酸锰在不同温度下的溶解度表
| 温度/℃ | 50 | 80 | 90 | 100 |
| 溶解度l(/100g水) | 58 | 48 | 42 | 34 |
 对锰浸出率η的影响。如图实验条件为
对锰浸出率η的影响。如图实验条件为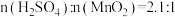 ,反应温度为50℃,反应时间为80min。请结合图像分析
,反应温度为50℃,反应时间为80min。请结合图像分析 约为
约为
更新时间:2022-11-06 16:03:29
|
相似题推荐
【推荐1】利用钛矿的酸性废液(含TiO2+、Fe2+、Fe3+、 等),可回收获得FeS2纳米材料、Fe2O3和TiO2·nH2O等产品,流程如下:
等),可回收获得FeS2纳米材料、Fe2O3和TiO2·nH2O等产品,流程如下:
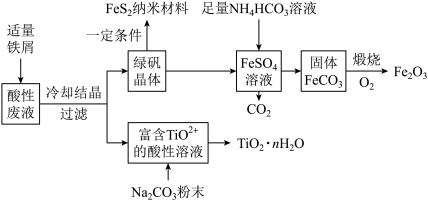
(1)TiO2+中钛元素的化合价为_____ 价。TiO2+只能存在于强酸性溶液中,因为TiO2+易水解生成TiO2·nH2O,写出水解的离子方程式:_____ 。
(2)向富含TiO2+的酸性溶液中加入Na2CO3粉末能得到固体TiO2·nH2O。请用化学反应原理解释:_____ 。
(3)NHHCO3溶液与FeSO4溶液反应的离子方程式为_____ ,该反应需温度在308K以下,其目的是_____ 。
(4)Fe2+的外层电子排布式为_____ 。
(5)实验室常用KSCN溶液来检验Fe3+的存在,与SCN互为等电子体的分子有_____ (写一个物质即可)
 等),可回收获得FeS2纳米材料、Fe2O3和TiO2·nH2O等产品,流程如下:
等),可回收获得FeS2纳米材料、Fe2O3和TiO2·nH2O等产品,流程如下:
(1)TiO2+中钛元素的化合价为
(2)向富含TiO2+的酸性溶液中加入Na2CO3粉末能得到固体TiO2·nH2O。请用化学反应原理解释:
(3)NHHCO3溶液与FeSO4溶液反应的离子方程式为
(4)Fe2+的外层电子排布式为
(5)实验室常用KSCN溶液来检验Fe3+的存在,与SCN互为等电子体的分子有
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
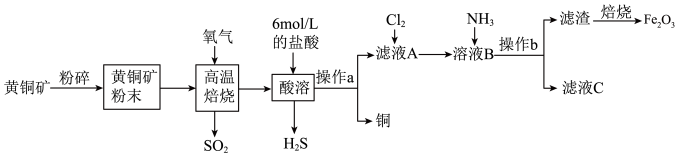
【推荐2】Cu和Fe2O3在工农业生产中用途广泛,用黄铜矿(主要成分为CuFeS2,其中Cu为+2价,Fe为+2价)制取Cu和Fe2O3的工艺流程如图所示:__________ 。
(2)CuFeS2中S元素的化合价是______ ,高温焙烧时生成FeS及另外两种产物,则发生的化学反应方程式为____________ 。
(3)操作a为____________ 。
(4)向滤液A中通入Cl2的目的是__________ 。
(5)向溶液B中通入NH3发生反应的离子方程式为___________ 。
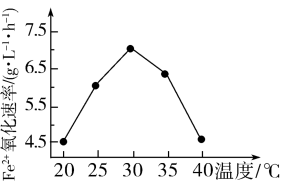
(6)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
由下图可知,使用硫杆菌的最佳温度为______ ℃,若反应温度过高,反应速率下降,其原因是_______________ 。
(2)CuFeS2中S元素的化合价是
(3)操作a为
(4)向滤液A中通入Cl2的目的是
(5)向溶液B中通入NH3发生反应的离子方程式为
(6)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4
 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O由下图可知,使用硫杆菌的最佳温度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】稀有金属钒和钛在钢铁、化工、航空航天等领域应用广泛。从钒钛磁铁矿中提取钒、钛的工艺流程图如下: 、
、 、
、 和
和 等。
等。
②“高温氯化”后的产物中含少量的 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:
回答下列问题:
(1)钛在周期表中的位置为___________ ,上述获得钛单质的“还原”工序中需要通入氩气的目的是___________ 。
(2)滤液X中含有的主要金属离子有___________ 。
(3)“高温氯化”工序生成 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为___________ ; 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是___________ 。
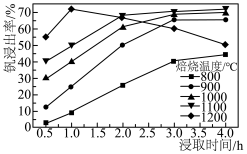
(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为___________ 。 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为___________ 。
(6)采用USTB工艺电解制备高纯钛,过程以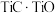 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:___________ 。
 、
、 、
、 和
和 等。
等。②“高温氯化”后的产物中含少量的
 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:| 化合物 |  |  |  |  |  |
| 沸点/℃ | 136 | 310 | 56.5 | 180 | 127 |
(1)钛在周期表中的位置为
(2)滤液X中含有的主要金属离子有
(3)“高温氯化”工序生成
 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为
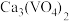 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为(6)采用USTB工艺电解制备高纯钛,过程以
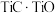 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】砷的化合物可用于半导体领域。一种从酸性高浓度含砷废水[砷主要以亚砷酸 形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下: ;
;
П.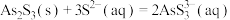 ;
;
III.砷酸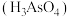 在酸性条件下有强氧化性,能被
在酸性条件下有强氧化性,能被 等还原;
等还原;
IV.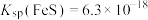 ,
,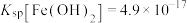 。
。
回答下列问题:
(1)“沉砷”时,亚砷酸转化为 的化学方程式为
的化学方程式为___________ 。
(2)“沉砷”时产生的废气可用___________ 溶液吸收处理(填化学式)。
(3)“NaOH溶液浸取”后,所得“滤渣”的主要成分是___________ (填化学式),“滤渣”中___________  (填“含有”或“不含有”)。
(填“含有”或“不含有”)。
(4)向滤液II中通入氧气进行“氧化脱硫”,反应的离子方程式为___________ 。
(5)“沉砷”过程中FeS不可用过量的 替换,原因是
替换,原因是___________ (从平衡移动的角度解释)。
(6)该流程最后一步用 “还原”砷酸,发生反应的化学方程式为
“还原”砷酸,发生反应的化学方程式为___________ 。
 形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下: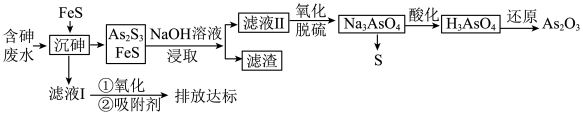
 ;
;П.
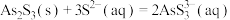 ;
;III.砷酸
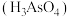 在酸性条件下有强氧化性,能被
在酸性条件下有强氧化性,能被 等还原;
等还原;IV.
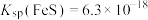 ,
,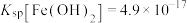 。
。回答下列问题:
(1)“沉砷”时,亚砷酸转化为
 的化学方程式为
的化学方程式为(2)“沉砷”时产生的废气可用
(3)“NaOH溶液浸取”后,所得“滤渣”的主要成分是
 (填“含有”或“不含有”)。
(填“含有”或“不含有”)。(4)向滤液II中通入氧气进行“氧化脱硫”,反应的离子方程式为
(5)“沉砷”过程中FeS不可用过量的
 替换,原因是
替换,原因是(6)该流程最后一步用
 “还原”砷酸,发生反应的化学方程式为
“还原”砷酸,发生反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸,其K1=5.4×10-2,K2=5.4×10-5,已知碳酸的K1=4.4×10-7,K2=4.7×10-11,
草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9,试回答下列问题:
(1)0.1mol/LNa2CO3溶液的pH_________ 0.1mol/LNa2C2O4溶液的pH(选填“大于”、“小于”或“等于”)。
(2)下列化学方程式正确的是_______ (填选项序号)
A. H2C2O4+CO32-=HCO3-+HC2O4- B.HC2O4-+CO32-=HCO3-+C2O42-
C.H2O+CO2+C2O42-=HC2O4-+HCO3- D.C2O42-+CO2+H2O=H2C2O4+CO32-
(3)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应)。 实验步骤:准确以1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL.
(已知:5H2C2O4+2KMnO4+3H2SO4===10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在_________ 滴定管中。(填“酸式”或“碱式”)
②滴定至终点时的实验现象是:__________________________ 。
③计算样品中Na2C2O4的纯度是_______________________ 。
(4)草酸钙结石是五种肾结石里最为常见的一种.患草酸钙结石的病人多饮白开水有利于结石的消融.请用化学用语和简要的文字说明其原因:______ .
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为______ .
草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9,试回答下列问题:
(1)0.1mol/LNa2CO3溶液的pH
(2)下列化学方程式正确的是
A. H2C2O4+CO32-=HCO3-+HC2O4- B.HC2O4-+CO32-=HCO3-+C2O42-
C.H2O+CO2+C2O42-=HC2O4-+HCO3- D.C2O42-+CO2+H2O=H2C2O4+CO32-
(3)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应)。 实验步骤:准确以1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL.
(已知:5H2C2O4+2KMnO4+3H2SO4===10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在
②滴定至终点时的实验现象是:
③计算样品中Na2C2O4的纯度是
(4)草酸钙结石是五种肾结石里最为常见的一种.患草酸钙结石的病人多饮白开水有利于结石的消融.请用化学用语和简要的文字说明其原因:
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】废旧锂电池的有效回收,可以减少环境污染,也能缓解贵金属资源危机。一种高效处理三元锂电池正极活性物质(其中金属元素的质量分数为 、
、 、
、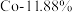 、
、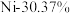 ),回收贵金属元素的工艺如下。
),回收贵金属元素的工艺如下。
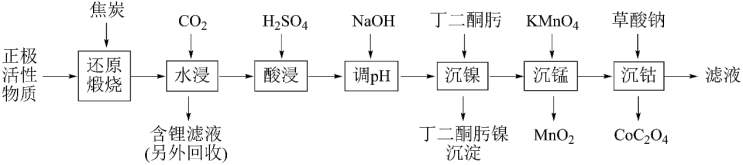
已知:金属离子开始沉淀和完全沉淀的pH值如下表所示:
回答下列问题:
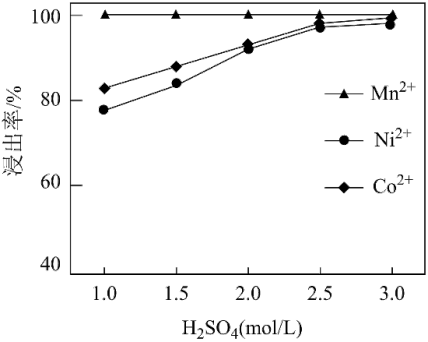
(1)在一定条件下“酸浸”时,金属离子的浸出率与硫酸浓度的关系如下图所示,此条件下,硫酸最合适的浓度为___________ mol/L。为提高金属离子的浸出率,除硫酸浓度外,还可以研究___________ 、___________ 等条件与金属离子的浸出率的关系。
(2)“调pH”的最佳pH为5,原因是:①pH过低,丁二酮肟不易与 络合生成丁二酮肟镍沉淀,不利于
络合生成丁二酮肟镍沉淀,不利于 的除去;②pH值过高
的除去;②pH值过高___________ 。
(3)“沉锰”的离子方程式为___________ 。
(4)“还原煅烧”时,生成的 溶解度较小。“水浸”时,通入过量
溶解度较小。“水浸”时,通入过量 有利于
有利于 溶解为
溶解为 ,从而与其他金属元素分离,从平衡移动的角度分析其原理:
,从而与其他金属元素分离,从平衡移动的角度分析其原理:___________ 。
(5)金属离子的电化学沉积法清洁环保且成本较低。其原理是通过电解装置将金属离子从溶液中逐一还原析出,生成的金属单质应附着在___________ 极。
电解时,各金属离子还原为单质的电压如下表:
若要改进工艺,更好分离金属离子,应在___________ (填字母)流程后开始使用电化学沉积法。最后析出的金属单质为___________ 。
A.“酸浸” B.“调pH” C.“沉镍” D.“沉锰”
 、
、 、
、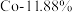 、
、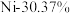 ),回收贵金属元素的工艺如下。
),回收贵金属元素的工艺如下。
已知:金属离子开始沉淀和完全沉淀的pH值如下表所示:
| 金属离子 |  |  |  |
| 开始沉淀的pH | 6.6 | 7.8 | 6.7 |
| 完全沉淀的pH | 9.2 | 10.4 | 9.5 |
(1)在一定条件下“酸浸”时,金属离子的浸出率与硫酸浓度的关系如下图所示,此条件下,硫酸最合适的浓度为

(2)“调pH”的最佳pH为5,原因是:①pH过低,丁二酮肟不易与
 络合生成丁二酮肟镍沉淀,不利于
络合生成丁二酮肟镍沉淀,不利于 的除去;②pH值过高
的除去;②pH值过高(3)“沉锰”的离子方程式为
(4)“还原煅烧”时,生成的
 溶解度较小。“水浸”时,通入过量
溶解度较小。“水浸”时,通入过量 有利于
有利于 溶解为
溶解为 ,从而与其他金属元素分离,从平衡移动的角度分析其原理:
,从而与其他金属元素分离,从平衡移动的角度分析其原理:(5)金属离子的电化学沉积法清洁环保且成本较低。其原理是通过电解装置将金属离子从溶液中逐一还原析出,生成的金属单质应附着在
电解时,各金属离子还原为单质的电压如下表:
| 金属离子 |  |  |  |
| 还原为单质的电压/V | 0.280 | 1.185 | 0.257 |
A.“酸浸” B.“调pH” C.“沉镍” D.“沉锰”
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】钇是稀土元素之一。我国蕴藏着丰富的钇矿石(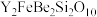 ,其中Y为+3价),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
,其中Y为+3价),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
ii. 、
、 形成氢氧化物沉淀时的pH如下表:
形成氢氧化物沉淀时的pH如下表:
(1)钇矿石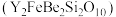 用氧化物的形式可表示为
用氧化物的形式可表示为________ 。
(2)将钇矿石与NaOH共熔的化学方程式补充完整:_____
________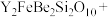 ________
________ ________
________ ________
________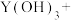 ________
________ ________
________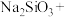 ________
________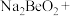 ________
________
(3)试剂1应加入过量的________ (填名称),滤渣1的主要成分是________ (填化学式)。
(4)“系列操作1”为除去BeCl,溶液中的杂质 ,请选择合理步骤并排序;
,请选择合理步骤并排序;________ (填序号)。
a.加入适量的盐酸 b.通入过量的 c.过滤 d.加入过量的NaOH溶液
c.过滤 d.加入过量的NaOH溶液
e.加入过量的氨水 f.洗涤
(5)为使 沉淀完全,用氨水调节
沉淀完全,用氨水调节 时,a应控制在
时,a应控制在________ 范围内;继续加氨水调节 发生反应的离子方程式为
发生反应的离子方程式为________ ;检验 是否沉淀完全的操作是
是否沉淀完全的操作是________ 。
(6)常见的由 固体生产Be的工业方法有两种:①电解法:电解
固体生产Be的工业方法有两种:①电解法:电解 混合熔融盐制备Be;②热还原法:熔融条件下,钾还原
混合熔融盐制备Be;②热还原法:熔融条件下,钾还原 制备Be。以上两种方法你认为哪种更好并说明理由:
制备Be。以上两种方法你认为哪种更好并说明理由:________ (合理即可)。
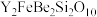 ,其中Y为+3价),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
,其中Y为+3价),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。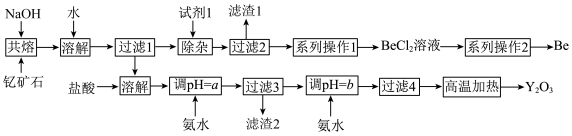
ii.
 、
、 形成氢氧化物沉淀时的pH如下表:
形成氢氧化物沉淀时的pH如下表:离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| 2.1 | 3.1 |
| 6.0 | 8.3 |
(1)钇矿石
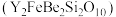 用氧化物的形式可表示为
用氧化物的形式可表示为(2)将钇矿石与NaOH共熔的化学方程式补充完整:
________
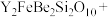 ________
________ ________
________ ________
________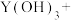 ________
________ ________
________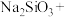 ________
________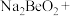 ________
________
(3)试剂1应加入过量的
(4)“系列操作1”为除去BeCl,溶液中的杂质
 ,请选择合理步骤并排序;
,请选择合理步骤并排序;a.加入适量的盐酸 b.通入过量的
 c.过滤 d.加入过量的NaOH溶液
c.过滤 d.加入过量的NaOH溶液e.加入过量的氨水 f.洗涤
(5)为使
 沉淀完全,用氨水调节
沉淀完全,用氨水调节 时,a应控制在
时,a应控制在 发生反应的离子方程式为
发生反应的离子方程式为 是否沉淀完全的操作是
是否沉淀完全的操作是(6)常见的由
 固体生产Be的工业方法有两种:①电解法:电解
固体生产Be的工业方法有两种:①电解法:电解 混合熔融盐制备Be;②热还原法:熔融条件下,钾还原
混合熔融盐制备Be;②热还原法:熔融条件下,钾还原 制备Be。以上两种方法你认为哪种更好并说明理由:
制备Be。以上两种方法你认为哪种更好并说明理由:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】利用某工厂废水(主要成分含有 、
、 、
、 ,及少量
,及少量 、
、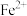 、
、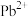 )制备
)制备 溶液的实验流程如下:
溶液的实验流程如下:

已知:①溶液中金属离子的浓度小于 时,可视为沉淀完全。
时,可视为沉淀完全。
②室温下 。
。
(1)①“氧化”步骤的离子方程式为___________ 。
②调节 的目的是
的目的是___________ 。
(2)流程中分两步除杂而不采用直接加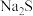 溶液除杂,除了减少
溶液除杂,除了减少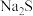 的使用量之外,还可能的原因是:
的使用量之外,还可能的原因是:___________ 。
(3)以 溶液为原料制备的
溶液为原料制备的 脱硫剂,可用于脱除煤气中的
脱硫剂,可用于脱除煤气中的 。
。
①400℃时,将一定比例 、
、 、
、 和
和 的混合气体以一定流速通过装有
的混合气体以一定流速通过装有 脱硫剂的硫化反应器。硫化过程中
脱硫剂的硫化反应器。硫化过程中 与
与 、
、 反应生成
反应生成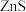 和
和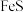 ,其化学方程式为
,其化学方程式为___________ 。
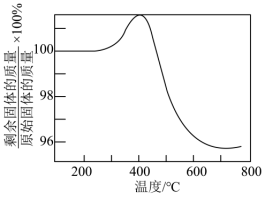
②将硫化后的固体在 (体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是
(体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是___________ 。
 、
、 、
、 ,及少量
,及少量 、
、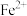 、
、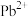 )制备
)制备 溶液的实验流程如下:
溶液的实验流程如下:
已知:①溶液中金属离子的浓度小于
 时,可视为沉淀完全。
时,可视为沉淀完全。②室温下
 。
。(1)①“氧化”步骤的离子方程式为
②调节
 的目的是
的目的是(2)流程中分两步除杂而不采用直接加
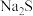 溶液除杂,除了减少
溶液除杂,除了减少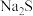 的使用量之外,还可能的原因是:
的使用量之外,还可能的原因是:(3)以
 溶液为原料制备的
溶液为原料制备的 脱硫剂,可用于脱除煤气中的
脱硫剂,可用于脱除煤气中的 。
。①400℃时,将一定比例
 、
、 、
、 和
和 的混合气体以一定流速通过装有
的混合气体以一定流速通过装有 脱硫剂的硫化反应器。硫化过程中
脱硫剂的硫化反应器。硫化过程中 与
与 、
、 反应生成
反应生成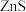 和
和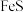 ,其化学方程式为
,其化学方程式为②将硫化后的固体在
 (体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是
(体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是
您最近一年使用:0次
【推荐3】氧缺位体(CuFe2O4-δ)是热化学循环分解水制氢的催化剂。一种以黄铜矿主要成分是(CuFeS2,含Al2O3、SiO2等杂质)、为原料制备CuFe2O4-δ的流程如图:

已知:①酸浸后溶液中的金属离子有Cu2+、Fe2+、Al3+和Fe3+。
②25℃时已知几种金属离子沉淀的pH如表所示:
请回答下列问题:
(1)Cu位于元素周期表第四周期第______ 族,______ 区。
(2)CuFeS2“焙烧”时生成三种氧化物,其化学方程式为______ 。
(3)加Cu“还原”的目的是_______ 。
(4)滤渣2的主要成分为_______ 。
(5)已知Cu(NH3)2Cl2有两种同分异构体,则“沉铁”过程中生成的[Cu(NH3)4]2+的空间构型是______ 。
(6)充分“煅烧”CuFe2O4得到的氧缺位体(CuFe2O4-δ)的质量为原质量的98%,则δ=______ 。
氧缺位体分解水制氢分两步:
第一步________ (完成方程式);
第二步:2CuFe2O4=2CuFe2O4-δ+δO2↑。
(7)四方晶系CuFeS2晶胞结构如图所示,已知(CuFeS2晶体的密度是ρg•cm-3,则a=______ (设NA为阿伏加德罗常数的值)。


已知:①酸浸后溶液中的金属离子有Cu2+、Fe2+、Al3+和Fe3+。
②25℃时已知几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Fe(OH)2 |
| 开始沉淀的pH | 1.9 | 3.4 | 6.4 | 7.0 |
| 完全沉淀的pH | 3.2 | 4.7 | 7.6 | 9.0 |
(1)Cu位于元素周期表第四周期第
(2)CuFeS2“焙烧”时生成三种氧化物,其化学方程式为
(3)加Cu“还原”的目的是
(4)滤渣2的主要成分为
(5)已知Cu(NH3)2Cl2有两种同分异构体,则“沉铁”过程中生成的[Cu(NH3)4]2+的空间构型是
(6)充分“煅烧”CuFe2O4得到的氧缺位体(CuFe2O4-δ)的质量为原质量的98%,则δ=
氧缺位体分解水制氢分两步:
第一步
第二步:2CuFe2O4=2CuFe2O4-δ+δO2↑。
(7)四方晶系CuFeS2晶胞结构如图所示,已知(CuFeS2晶体的密度是ρg•cm-3,则a=

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
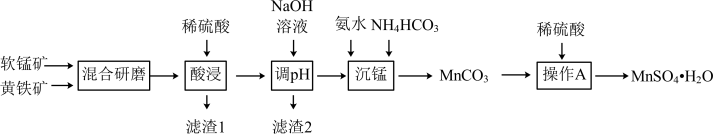
【推荐1】以黄铁矿(主要成分是 ,含少量
,含少量 )和软锰矿(主要成分是
)和软锰矿(主要成分是 ,含少量
,含少量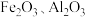 )为原料制备
)为原料制备 的工艺流程如下:
的工艺流程如下:
已知: 时,
时,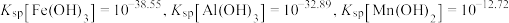 。
。
(1)研磨黄铁矿、软锰矿的目的是_______ 。
(2)酸浸过程得到的滤液中含有的金属阳离子有 和
和_______ ,滤渣1的成分为 和
和_______ 写出酸浸过程中主要反应的离子方程式_______ 。
(3)调 时,若溶液中
时,若溶液中 ,为得到尽可能多且纯净的产品,应控制
,为得到尽可能多且纯净的产品,应控制 的范围是
的范围是_______ 。
(4)沉锰过程需控制温度为 的原因是
的原因是_______ 。
(5)写出沉锰过程中生成 的离子方程式
的离子方程式_______ 。
(6)下图为 的溶解度曲线,操作A是加入足量稀硫酸充分反应后,
的溶解度曲线,操作A是加入足量稀硫酸充分反应后,_______ 洗涤干燥。
 ,含少量
,含少量 )和软锰矿(主要成分是
)和软锰矿(主要成分是 ,含少量
,含少量 )为原料制备
)为原料制备 的工艺流程如下:
的工艺流程如下:
已知:
 时,
时,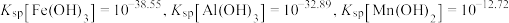 。
。(1)研磨黄铁矿、软锰矿的目的是
(2)酸浸过程得到的滤液中含有的金属阳离子有
 和
和 和
和(3)调
 时,若溶液中
时,若溶液中 ,为得到尽可能多且纯净的产品,应控制
,为得到尽可能多且纯净的产品,应控制 的范围是
的范围是(4)沉锰过程需控制温度为
 的原因是
的原因是(5)写出沉锰过程中生成
 的离子方程式
的离子方程式(6)下图为
 的溶解度曲线,操作A是加入足量稀硫酸充分反应后,
的溶解度曲线,操作A是加入足量稀硫酸充分反应后,
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】实验室以菱锰矿(含 及少量
及少量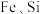 的氧化物等)为原料制备高纯
的氧化物等)为原料制备高纯 和
和 的流程如下图所示。已知:室温下
的流程如下图所示。已知:室温下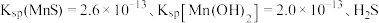 电离常数
电离常数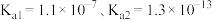 。
。
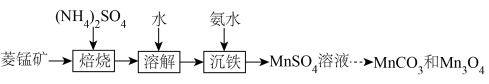
(1)该流程中可循环使用的物质有___________ 。
(2)“沉铁”过程需加氨水调节溶液 ,使溶液中
,使溶液中 转化为
转化为 沉淀同时得到
沉淀同时得到 溶液。检验
溶液。检验 溶液中是否含有
溶液中是否含有 的实验方法是
的实验方法是___________ 。
(3)沉铁过程中也会产生少量 沉淀。
沉淀。 在工业上可用于去除溶液中
在工业上可用于去除溶液中 ,反应为:
,反应为: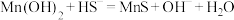 ,其平衡常数
,其平衡常数
___________ 。
(4)制取 。在题图1所示的实验装置中,搅拌下使一定量的
。在题图1所示的实验装置中,搅拌下使一定量的 溶液与氨水
溶液与氨水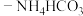 混合溶液充分反应。
混合溶液充分反应。
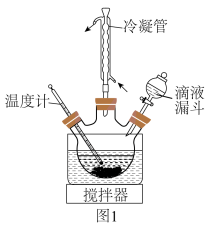
①滴液漏斗中添加的药品是___________ 。
②混合溶液中氨水的作用是___________ 。
(5)制取 。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对
。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对 溶液制取
溶液制取 纯度的影响如题图2、题图3、题图4所示。
纯度的影响如题图2、题图3、题图4所示。
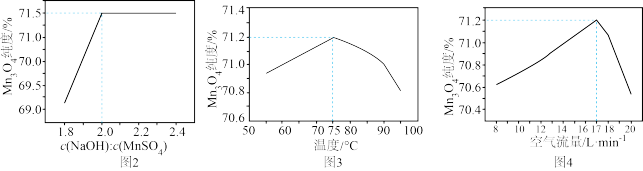
补充完整制取纯净 的实验方案:取
的实验方案:取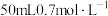 的
的 溶液,
溶液,___________ ,控制搅拌速率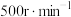 反应
反应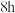 ,
,___________ , 干燥
干燥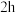 ,得到纯净的
,得到纯净的 (须使用的试剂:
(须使用的试剂: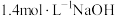 溶液、
溶液、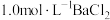 溶液)。
溶液)。
 及少量
及少量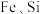 的氧化物等)为原料制备高纯
的氧化物等)为原料制备高纯 和
和 的流程如下图所示。已知:室温下
的流程如下图所示。已知:室温下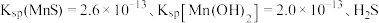 电离常数
电离常数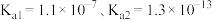 。
。
(1)该流程中可循环使用的物质有
(2)“沉铁”过程需加氨水调节溶液
 ,使溶液中
,使溶液中 转化为
转化为 沉淀同时得到
沉淀同时得到 溶液。检验
溶液。检验 溶液中是否含有
溶液中是否含有 的实验方法是
的实验方法是(3)沉铁过程中也会产生少量
 沉淀。
沉淀。 在工业上可用于去除溶液中
在工业上可用于去除溶液中 ,反应为:
,反应为: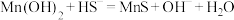 ,其平衡常数
,其平衡常数
(4)制取
 。在题图1所示的实验装置中,搅拌下使一定量的
。在题图1所示的实验装置中,搅拌下使一定量的 溶液与氨水
溶液与氨水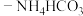 混合溶液充分反应。
混合溶液充分反应。
①滴液漏斗中添加的药品是
②混合溶液中氨水的作用是
(5)制取
 。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对
。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对 溶液制取
溶液制取 纯度的影响如题图2、题图3、题图4所示。
纯度的影响如题图2、题图3、题图4所示。
补充完整制取纯净
 的实验方案:取
的实验方案:取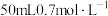 的
的 溶液,
溶液,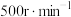 反应
反应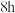 ,
, 干燥
干燥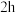 ,得到纯净的
,得到纯净的 (须使用的试剂:
(须使用的试剂: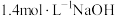 溶液、
溶液、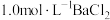 溶液)。
溶液)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品:
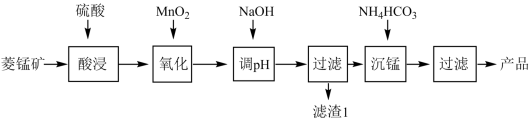
(1)“酸浸”时加快反应速率的方法除了增加硫酸的浓度和加热外,还有___________________ 。(写出一种)
(2)在加NaOH调节溶液的pH时约为5,如果pH过大,可能导致滤渣1中___________________ (填化学式)的含量减少。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8(过二硫酸氨)溶液,加热,Mn2+被氧化为MnO4-,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,平均消耗(NH4)2Fe(SO4)2标准溶液的体积为V mL。
①Mn2+与(NH4)2S2O8反应的离子方程式为___________________________________________ 。
②用含a、b、V的代数式表示“沉锰”前溶液中c(Mn2+)=_______________ 。
(4)①写出“沉锰”时的离子方程式:___________________________________________ 。
②在其他条件相同时,NH4HCO3的初始浓度越大,锰元素回收率越高,请从沉淀溶解平衡的角度解释其原因___________________________________________ 。

(1)“酸浸”时加快反应速率的方法除了增加硫酸的浓度和加热外,还有
(2)在加NaOH调节溶液的pH时约为5,如果pH过大,可能导致滤渣1中
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8(过二硫酸氨)溶液,加热,Mn2+被氧化为MnO4-,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,平均消耗(NH4)2Fe(SO4)2标准溶液的体积为V mL。
①Mn2+与(NH4)2S2O8反应的离子方程式为
②用含a、b、V的代数式表示“沉锰”前溶液中c(Mn2+)=
(4)①写出“沉锰”时的离子方程式:
②在其他条件相同时,NH4HCO3的初始浓度越大,锰元素回收率越高,请从沉淀溶解平衡的角度解释其原因
您最近一年使用:0次



