实验室以菱锰矿(含 及少量
及少量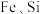 的氧化物等)为原料制备高纯
的氧化物等)为原料制备高纯 和
和 的流程如下图所示。已知:室温下
的流程如下图所示。已知:室温下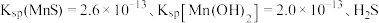 电离常数
电离常数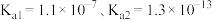 。
。
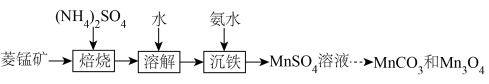
(1)该流程中可循环使用的物质有___________ 。
(2)“沉铁”过程需加氨水调节溶液 ,使溶液中
,使溶液中 转化为
转化为 沉淀同时得到
沉淀同时得到 溶液。检验
溶液。检验 溶液中是否含有
溶液中是否含有 的实验方法是
的实验方法是___________ 。
(3)沉铁过程中也会产生少量 沉淀。
沉淀。 在工业上可用于去除溶液中
在工业上可用于去除溶液中 ,反应为:
,反应为: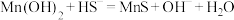 ,其平衡常数
,其平衡常数
___________ 。
(4)制取 。在题图1所示的实验装置中,搅拌下使一定量的
。在题图1所示的实验装置中,搅拌下使一定量的 溶液与氨水
溶液与氨水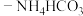 混合溶液充分反应。
混合溶液充分反应。
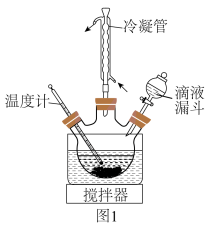
①滴液漏斗中添加的药品是___________ 。
②混合溶液中氨水的作用是___________ 。
(5)制取 。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对
。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对 溶液制取
溶液制取 纯度的影响如题图2、题图3、题图4所示。
纯度的影响如题图2、题图3、题图4所示。
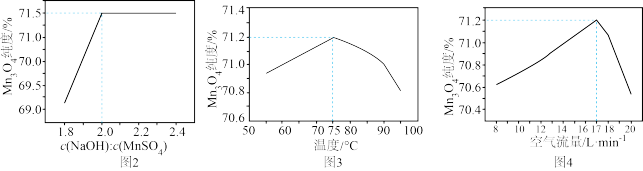
补充完整制取纯净 的实验方案:取
的实验方案:取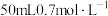 的
的 溶液,
溶液,___________ ,控制搅拌速率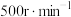 反应
反应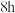 ,
,___________ , 干燥
干燥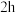 ,得到纯净的
,得到纯净的 (须使用的试剂:
(须使用的试剂: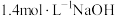 溶液、
溶液、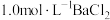 溶液)。
溶液)。
 及少量
及少量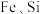 的氧化物等)为原料制备高纯
的氧化物等)为原料制备高纯 和
和 的流程如下图所示。已知:室温下
的流程如下图所示。已知:室温下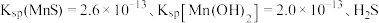 电离常数
电离常数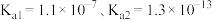 。
。
(1)该流程中可循环使用的物质有
(2)“沉铁”过程需加氨水调节溶液
 ,使溶液中
,使溶液中 转化为
转化为 沉淀同时得到
沉淀同时得到 溶液。检验
溶液。检验 溶液中是否含有
溶液中是否含有 的实验方法是
的实验方法是(3)沉铁过程中也会产生少量
 沉淀。
沉淀。 在工业上可用于去除溶液中
在工业上可用于去除溶液中 ,反应为:
,反应为: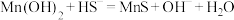 ,其平衡常数
,其平衡常数
(4)制取
 。在题图1所示的实验装置中,搅拌下使一定量的
。在题图1所示的实验装置中,搅拌下使一定量的 溶液与氨水
溶液与氨水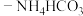 混合溶液充分反应。
混合溶液充分反应。
①滴液漏斗中添加的药品是
②混合溶液中氨水的作用是
(5)制取
 。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对
。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对 溶液制取
溶液制取 纯度的影响如题图2、题图3、题图4所示。
纯度的影响如题图2、题图3、题图4所示。
补充完整制取纯净
 的实验方案:取
的实验方案:取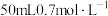 的
的 溶液,
溶液,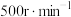 反应
反应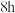 ,
, 干燥
干燥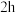 ,得到纯净的
,得到纯净的 (须使用的试剂:
(须使用的试剂: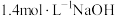 溶液、
溶液、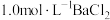 溶液)。
溶液)。
更新时间:2024-01-20 09:08:54
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
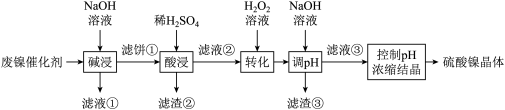
【推荐1】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式_______ 。
(2)“滤液②”中含有的金属离子是_______ 。
(3)“转化”中可替代H2O2的物质是_______ ,如果“转化”后的溶液中 浓度为
浓度为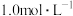 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是_______ 。
(4)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式_______ 。
(5)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是_______ 。
(6)第Ⅷ族元素单质及其化合物在工业生产和科研领域有重要的用途。
① 常用作制备高纯镍粉,其熔点为-19.3℃,沸点为43℃。
常用作制备高纯镍粉,其熔点为-19.3℃,沸点为43℃。 中
中 键和
键和 键的数目之比为
键的数目之比为_______ 。
②氧化镍和氯化钠的晶体结构相同,可看成镍离子替换钠离子,氧离子替换氯离子。若阿伏加德罗常数的值为 ,晶体密度为
,晶体密度为 ,则该晶胞中最近的
,则该晶胞中最近的 之间的距离为
之间的距离为_______ pm(列出表达式)。

 ):
):
溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 |  |  |  |  |
开始沉淀时(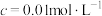 )的pH )的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时(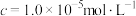 )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式
(2)“滤液②”中含有的金属离子是
(3)“转化”中可替代H2O2的物质是
 浓度为
浓度为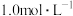 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是(4)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
(5)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
(6)第Ⅷ族元素单质及其化合物在工业生产和科研领域有重要的用途。
①
 常用作制备高纯镍粉,其熔点为-19.3℃,沸点为43℃。
常用作制备高纯镍粉,其熔点为-19.3℃,沸点为43℃。 中
中 键和
键和 键的数目之比为
键的数目之比为②氧化镍和氯化钠的晶体结构相同,可看成镍离子替换钠离子,氧离子替换氯离子。若阿伏加德罗常数的值为
 ,晶体密度为
,晶体密度为 ,则该晶胞中最近的
,则该晶胞中最近的 之间的距离为
之间的距离为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】金属钼在工业和国防建设中有重要的作用,其化合物钼酸钠晶体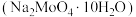 可制造金属缓释剂。由钼精矿(主要成分为
可制造金属缓释剂。由钼精矿(主要成分为 ,含有少量不反应的杂质)制备钼及钼酸钠晶体的工艺流程如图所示,回答下列问题:
,含有少量不反应的杂质)制备钼及钼酸钠晶体的工艺流程如图所示,回答下列问题:____________ 。
(2)焙烧过程中采用“多层逆流(空气从炉底进入,钼精矿经粉碎后从炉顶进入)焙烧”,下图为焙烧时各炉层固体物料的物质的量百分数 。
。____________ ;“多层逆流焙烧”的优点是_______________ ;
②某些生产工艺在焙烧时加入碳酸钙会更环保,其原因是________ (用化学方程式表示);
(3)碱浸时发生反应的离子方程式为_____________________ ;
(4)已知钼酸钠的溶解度曲线如图所示,要获得钼酸钠晶体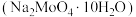 的操作2为
的操作2为________ 、_________ 、过滤、洗涤、干燥; 生成,用固体
生成,用固体 除去.在除
除去.在除 前测定碱浸液中
前测定碱浸液中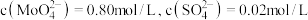 ,当
,当 开始沉淀时,
开始沉淀时, 的去除率为
的去除率为_____ %(保留整数)[已知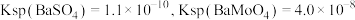 ,溶液体积变化忽略不计]。
,溶液体积变化忽略不计]。
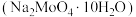 可制造金属缓释剂。由钼精矿(主要成分为
可制造金属缓释剂。由钼精矿(主要成分为 ,含有少量不反应的杂质)制备钼及钼酸钠晶体的工艺流程如图所示,回答下列问题:
,含有少量不反应的杂质)制备钼及钼酸钠晶体的工艺流程如图所示,回答下列问题: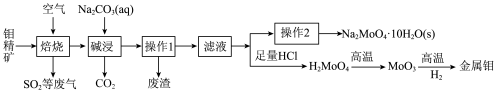
(2)焙烧过程中采用“多层逆流(空气从炉底进入,钼精矿经粉碎后从炉顶进入)焙烧”,下图为焙烧时各炉层固体物料的物质的量百分数
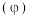 。
。
②某些生产工艺在焙烧时加入碳酸钙会更环保,其原因是
(3)碱浸时发生反应的离子方程式为
(4)已知钼酸钠的溶解度曲线如图所示,要获得钼酸钠晶体
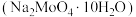 的操作2为
的操作2为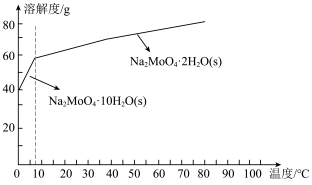
 生成,用固体
生成,用固体 除去.在除
除去.在除 前测定碱浸液中
前测定碱浸液中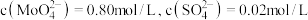 ,当
,当 开始沉淀时,
开始沉淀时, 的去除率为
的去除率为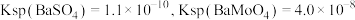 ,溶液体积变化忽略不计]。
,溶液体积变化忽略不计]。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】以某菱锰矿(含 、
、 、
、 和少量
和少量 等)为原料通过以下方法可获得碳酸锰粗产品。
等)为原料通过以下方法可获得碳酸锰粗产品。 ,
,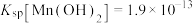 ,
,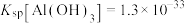
(1)Mn元素在周期表中的位置___________ 。
(2)滤渣中,含铁元素的物质主要是___________ (填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣中___________ 含量减少。
(3)滤液中,+1价阳离子除了 外还有
外还有___________ (填离子符号)。
(4)取“沉锰”前溶液a mL于锥形瓶中,加入少量 溶液(作催化剂)和过量的1.5%
溶液(作催化剂)和过量的1.5%  溶液,加热,
溶液,加热, 被氧化为
被氧化为 ,反应一段时间后再煮沸5min[除去过量的
,反应一段时间后再煮沸5min[除去过量的 ],冷却至室温。选用适宜的指示剂,用b
],冷却至室温。选用适宜的指示剂,用b  的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液V mL。
标准溶液V mL。
① 与
与 反应的还原产物为
反应的还原产物为___________ 。
②“沉锰”前溶液中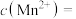
___________  。(列出表达式)
。(列出表达式)
(5)其他条件不变,“沉锰”过程中锰元素回收率与 ,初始浓度(
,初始浓度( )、反应时间的关系如图所示。
)、反应时间的关系如图所示。 初始浓度越大,锰元素回收率越
初始浓度越大,锰元素回收率越___________ (填“高”或“低”)。
②若溶液中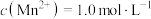 ,加入等体积1.8
,加入等体积1.8
 溶液进行反应,计算20~40min内速率
溶液进行反应,计算20~40min内速率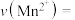
___________ 。
 、
、 、
、 和少量
和少量 等)为原料通过以下方法可获得碳酸锰粗产品。
等)为原料通过以下方法可获得碳酸锰粗产品。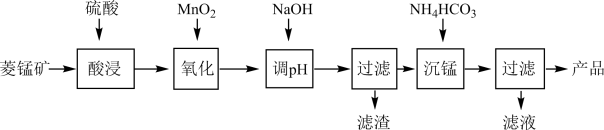
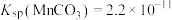 ,
,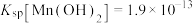 ,
,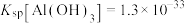
(1)Mn元素在周期表中的位置
(2)滤渣中,含铁元素的物质主要是
(3)滤液中,+1价阳离子除了
 外还有
外还有(4)取“沉锰”前溶液a mL于锥形瓶中,加入少量
 溶液(作催化剂)和过量的1.5%
溶液(作催化剂)和过量的1.5%  溶液,加热,
溶液,加热, 被氧化为
被氧化为 ,反应一段时间后再煮沸5min[除去过量的
,反应一段时间后再煮沸5min[除去过量的 ],冷却至室温。选用适宜的指示剂,用b
],冷却至室温。选用适宜的指示剂,用b  的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液V mL。
标准溶液V mL。①
 与
与 反应的还原产物为
反应的还原产物为②“沉锰”前溶液中
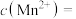
 。(列出表达式)
。(列出表达式)(5)其他条件不变,“沉锰”过程中锰元素回收率与
 ,初始浓度(
,初始浓度( )、反应时间的关系如图所示。
)、反应时间的关系如图所示。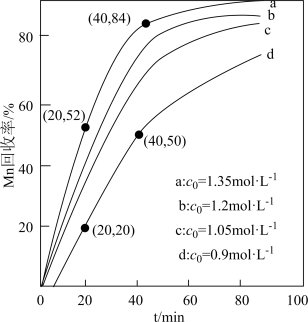
 初始浓度越大,锰元素回收率越
初始浓度越大,锰元素回收率越②若溶液中
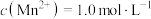 ,加入等体积1.8
,加入等体积1.8
 溶液进行反应,计算20~40min内速率
溶液进行反应,计算20~40min内速率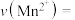
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】莫尔盐[(NH4)2Fe(SO4)2・6H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。
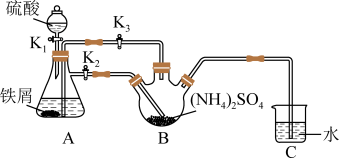
回答下列问题:
Ⅰ制取莫尔盐
(1)连接装置,检查装置气密性。将0.1mol(NH4)2SO4,晶体置于玻璃仪器中______ (填仪器名称),将6.0g洁净铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。A装置中反应的离子方程式为____
②待大部分铁粉溶解后,打开K3、关闭K2,此时可以看到的现象为_______ ,原因是_______
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、____ 、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH在1~2之间,其目的为____
④装置C的作用为____ ,装置C存在的缺点是____
Ⅱ.测定莫尔盐样品的纯度
(3)称取所得莫尔盐样品10.0g,用煮沸后冷却的蒸馏水配成100mL溶液,取20.00mL溶液加入稀硫酸,用0.1mol・L-1的KMnO4溶液滴定,达到滴定终点时消耗10.00mlKMnO4溶液。滴定反应的离子方程式为____ ,该样品的纯度为____

回答下列问题:
Ⅰ制取莫尔盐
(1)连接装置,检查装置气密性。将0.1mol(NH4)2SO4,晶体置于玻璃仪器中
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。A装置中反应的离子方程式为
②待大部分铁粉溶解后,打开K3、关闭K2,此时可以看到的现象为
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、
④装置C的作用为
Ⅱ.测定莫尔盐样品的纯度
(3)称取所得莫尔盐样品10.0g,用煮沸后冷却的蒸馏水配成100mL溶液,取20.00mL溶液加入稀硫酸,用0.1mol・L-1的KMnO4溶液滴定,达到滴定终点时消耗10.00mlKMnO4溶液。滴定反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。
Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是_______________________ ;
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是__________________ ;
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是___________________ ;
(4)实验时需强力搅拌45min,其目的是_______________ ;结束后需调节溶液的pH 7~8,其目的是_______________ .最后经结晶分离、干燥得产品.
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合右图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
请补充完整由碳酸钙制备甲酸钙的实验步骤
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2._____________________________
步骤3._____________________________
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、___________ 、洗涤、60℃时干燥得甲酸钙晶体。
Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是
(4)实验时需强力搅拌45min,其目的是
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合右图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
请补充完整由碳酸钙制备甲酸钙的实验步骤
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤2.
步骤3.
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】实验室以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)为原料制取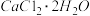 和CaO2的主要流程如下:
和CaO2的主要流程如下:
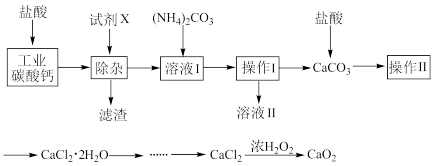
(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,滤渣的主要成分是___________ 。试剂X可以选择下列的________ (填编号)。
A.CaO B.CaCO3 C.NH3·H2O D.Ba(OH)2
(2)操作II中进行蒸发浓缩时,除三角架、酒精灯外,还需要的仪器有_______________ 。
(3)由CaCl2制取CaO2的反应中,温度不宜太高的原因是_____________________________ 。
(4)用下列装置测定工业碳酸钙的质量分数

①按A—B—C—D顺序连接,然后从A装置通入空气,目的是_______________ 。
②装置D的作用为______________________ 。
③实验时,准确称取10.00g工业碳酸钙3份,进行3次测定,测得BaCO3沉淀的平均质量为17.73g,则样品中CaCO3的质量分数为_____ 。若无D装置,测量结果则_________ 。(填“偏大”、“偏小”、“无影响”)
④上述实验装置中,是否存在不合理之处?________ (填“是”或“否”);若有不合理之处,需改进的是____________________________________________ 。
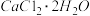 和CaO2的主要流程如下:
和CaO2的主要流程如下:
(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,滤渣的主要成分是
A.CaO B.CaCO3 C.NH3·H2O D.Ba(OH)2
(2)操作II中进行蒸发浓缩时,除三角架、酒精灯外,还需要的仪器有
(3)由CaCl2制取CaO2的反应中,温度不宜太高的原因是
(4)用下列装置测定工业碳酸钙的质量分数

①按A—B—C—D顺序连接,然后从A装置通入空气,目的是
②装置D的作用为
③实验时,准确称取10.00g工业碳酸钙3份,进行3次测定,测得BaCO3沉淀的平均质量为17.73g,则样品中CaCO3的质量分数为
④上述实验装置中,是否存在不合理之处?
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】《中国锰业》一文提出用废铁屑还原软锰矿,制取高纯硫酸锰的工艺流程如下图所示。某公司提供的软锰矿,其主要成分是二氧化锰,其中还含有少量Fe、CaO、MgO、 及重金属等。
及重金属等。
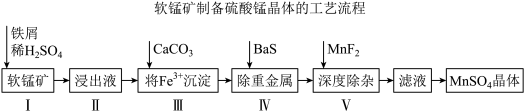
(1)I中加铁屑而不加铁块的原因是_______ 。
(2)写出I中铁屑与软锰矿发生的主要反应的离子方程式_______ 。
(3)加 之前需要加双氧水的作用
之前需要加双氧水的作用_______ ,结合下表说明,加 控制溶液pH的范围是
控制溶液pH的范围是_______ 。
可能用到的数据如下,不同金属离子沉淀的pH
已知: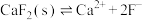 ,
,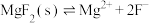
(4)深度除杂中加入 的作用是除去钙离子、镁离子,用平衡移动原理解释
的作用是除去钙离子、镁离子,用平衡移动原理解释_______ 。
(5)从滤液中获取 晶体的方法是
晶体的方法是_______ 、趁热过滤。
硫酸锰在不同温度下的溶解度表
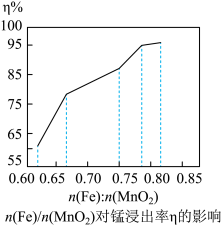
(6)为探究稀硫酸介质中湿法还原软锰矿制备硫酸锰的最佳工艺条件,研究了 对锰浸出率η的影响。如图实验条件为
对锰浸出率η的影响。如图实验条件为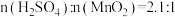 ,反应温度为50℃,反应时间为80min。请结合图像分析
,反应温度为50℃,反应时间为80min。请结合图像分析 约为
约为_______ 最合适,并说出理由_______ 。
 及重金属等。
及重金属等。
(1)I中加铁屑而不加铁块的原因是
(2)写出I中铁屑与软锰矿发生的主要反应的离子方程式
(3)加
 之前需要加双氧水的作用
之前需要加双氧水的作用 控制溶液pH的范围是
控制溶液pH的范围是可能用到的数据如下,不同金属离子沉淀的pH
| 氢氧化物 |  |  |  |
| 开始沉淀pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全pH | 3.7 | 9.7 | 9.8 |
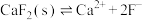 ,
,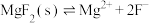
(4)深度除杂中加入
 的作用是除去钙离子、镁离子,用平衡移动原理解释
的作用是除去钙离子、镁离子,用平衡移动原理解释(5)从滤液中获取
 晶体的方法是
晶体的方法是硫酸锰在不同温度下的溶解度表
| 温度/℃ | 50 | 80 | 90 | 100 |
| 溶解度l(/100g水) | 58 | 48 | 42 | 34 |
 对锰浸出率η的影响。如图实验条件为
对锰浸出率η的影响。如图实验条件为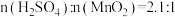 ,反应温度为50℃,反应时间为80min。请结合图像分析
,反应温度为50℃,反应时间为80min。请结合图像分析 约为
约为
您最近一年使用:0次
【推荐2】锰酸锂离子电池是第二代锂离子动力电池,性能优良。工业上以软锰矿浆(主要成分为 ,还含有少量铁,铝及硅等的氧化物)为原料制备锰酸锂
,还含有少量铁,铝及硅等的氧化物)为原料制备锰酸锂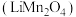 ,工艺流程如图所示。
,工艺流程如图所示。
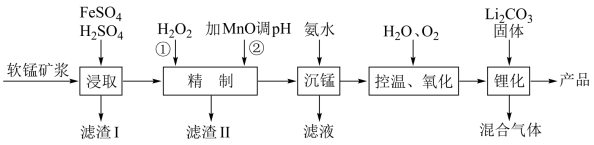
回答下列问题:
(1)“浸取”过程得到的浸取液中阳离子主要是 ,生成
,生成 的离子方程式为
的离子方程式为_______ 。
(2)滤渣II的主要成分是_______ ;“精制”过程中实际加入 的量比理论值大很多,其主要原因是
的量比理论值大很多,其主要原因是_______ 。
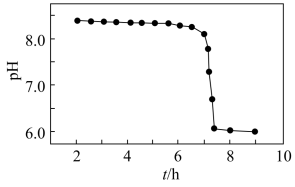
(3)“沉锰”过程得到的是 和
和 ,二者均可被氧化为
,二者均可被氧化为 ,若“控温、氧化”过程中溶液的
,若“控温、氧化”过程中溶液的 随时间的变化关系如图所示,其中溶液的
随时间的变化关系如图所示,其中溶液的 明显下降的原因是
明显下降的原因是_______ 。(用化学方程式表示)。
(4)工业上也可以向“精制”过程得到的滤液中加入 溶液制备
溶液制备 。
。 中S的化合价为
中S的化合价为 ,则1个
,则1个 中过氧键的数目为
中过氧键的数目为_______ ,加入 溶液制备
溶液制备 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(5)“锂化”过程是将 和
和 按
按 的物质的量之比配料,反应3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得到产品。该过程所得混合气体的成分是
的物质的量之比配料,反应3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得到产品。该过程所得混合气体的成分是_______ 。
 ,还含有少量铁,铝及硅等的氧化物)为原料制备锰酸锂
,还含有少量铁,铝及硅等的氧化物)为原料制备锰酸锂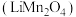 ,工艺流程如图所示。
,工艺流程如图所示。
回答下列问题:
(1)“浸取”过程得到的浸取液中阳离子主要是
 ,生成
,生成 的离子方程式为
的离子方程式为(2)滤渣II的主要成分是
 的量比理论值大很多,其主要原因是
的量比理论值大很多,其主要原因是(3)“沉锰”过程得到的是
 和
和 ,二者均可被氧化为
,二者均可被氧化为 ,若“控温、氧化”过程中溶液的
,若“控温、氧化”过程中溶液的 随时间的变化关系如图所示,其中溶液的
随时间的变化关系如图所示,其中溶液的 明显下降的原因是
明显下降的原因是
(4)工业上也可以向“精制”过程得到的滤液中加入
 溶液制备
溶液制备 。
。 中S的化合价为
中S的化合价为 ,则1个
,则1个 中过氧键的数目为
中过氧键的数目为 溶液制备
溶液制备 发生反应的离子方程式为
发生反应的离子方程式为(5)“锂化”过程是将
 和
和 按
按 的物质的量之比配料,反应3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得到产品。该过程所得混合气体的成分是
的物质的量之比配料,反应3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得到产品。该过程所得混合气体的成分是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
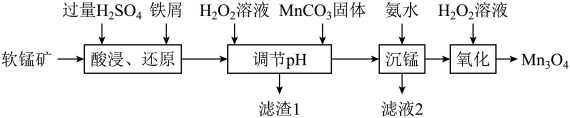
【推荐3】 可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的(
,还含有少量的( 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
25℃时,相关金属离子[ ]形成氢氧化物沉淀的pH范围如下:
]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)“酸浸、还原”时,为了加快化学反应速率,可以采取的措施有_______ (任写一种即可)。“酸浸、还原”后溶液中含有的金属阳离子主要有_______ (填离子符号),铁屑与 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2)“调节pH”时,加入 溶液的目的是
溶液的目的是_______ ,“调节pH”的范围为_______ 。
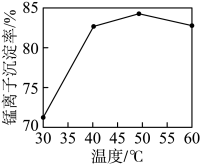
(3)“沉锰”时,其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。50℃后,溶液温度越高,锰离子的沉淀率越低,原因是_______ 。
(4)25℃时,pH=2.8 沉淀完全,则
沉淀完全,则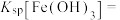
_______ 。
(5)滤渣1中的 可制备还原铁粉,还原铁粉的纯度可通过下列方法测定:称取0.2800g样品,溶于过量稀硫酸,用标准
可制备还原铁粉,还原铁粉的纯度可通过下列方法测定:称取0.2800g样品,溶于过量稀硫酸,用标准 溶液滴定所得溶液中的
溶液滴定所得溶液中的 ,测得三次消耗0.03000mol/L的
,测得三次消耗0.03000mol/L的 溶液25.10mL、26.50mL、24.90mL(测定过程中杂质不参与反应)。
溶液25.10mL、26.50mL、24.90mL(测定过程中杂质不参与反应)。
①写出滴定反应的离子方程式_______ 。
②计算还原铁粉的纯度_______ 。
 可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的(
,还含有少量的( 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
25℃时,相关金属离子[
 ]形成氢氧化物沉淀的pH范围如下:
]形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.5 | 6.3 | 3.4 | 8.1 |
| 沉淀完全的pH | 2.8 | 8.3 | 4.7 | 10.1 |
(1)“酸浸、还原”时,为了加快化学反应速率,可以采取的措施有
 发生反应的离子方程式为
发生反应的离子方程式为(2)“调节pH”时,加入
 溶液的目的是
溶液的目的是(3)“沉锰”时,其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。50℃后,溶液温度越高,锰离子的沉淀率越低,原因是

(4)25℃时,pH=2.8
 沉淀完全,则
沉淀完全,则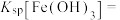
(5)滤渣1中的
 可制备还原铁粉,还原铁粉的纯度可通过下列方法测定:称取0.2800g样品,溶于过量稀硫酸,用标准
可制备还原铁粉,还原铁粉的纯度可通过下列方法测定:称取0.2800g样品,溶于过量稀硫酸,用标准 溶液滴定所得溶液中的
溶液滴定所得溶液中的 ,测得三次消耗0.03000mol/L的
,测得三次消耗0.03000mol/L的 溶液25.10mL、26.50mL、24.90mL(测定过程中杂质不参与反应)。
溶液25.10mL、26.50mL、24.90mL(测定过程中杂质不参与反应)。①写出滴定反应的离子方程式
②计算还原铁粉的纯度
您最近一年使用:0次



