1 . 含硼化合物硼酸( )、硼氢化钠(
)、硼氢化钠( )、硼酸甲酯
)、硼酸甲酯 在工业上有重要用途。回答下列问题:
在工业上有重要用途。回答下列问题:
(1) 在水溶液中会发生如下反应:
在水溶液中会发生如下反应: (反应实质为水电离出的
(反应实质为水电离出的 被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因
被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因_______ 。
(2)利用硼砂(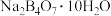 )制备硼酸(
)制备硼酸( )的流程如下图所示:
)的流程如下图所示:
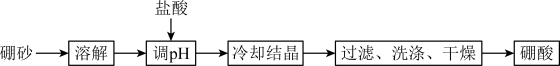
①“调 ”时需要控制溶液
”时需要控制溶液 ,写出用
,写出用 试纸检测溶液
试纸检测溶液 的操作方法:
的操作方法:_______ 。
②“调 ”后溶液中有硼酸生成,写出反应的离子方程式:
”后溶液中有硼酸生成,写出反应的离子方程式:_______ 。
③ 在水中电离方程式为:
在水中电离方程式为: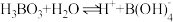 ,
,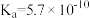 ,据此可判断
,据此可判断 属于
属于_______ 元弱酸,常温下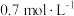 的硼酸溶液中
的硼酸溶液中 的浓度约为
的浓度约为_______ (计算结果保留小数点后一位)。
(3)利用硼酸和甲醇制备硼酸甲酯,发生的反应为: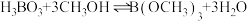 ,不同温度下,硼酸的转化率(
,不同温度下,硼酸的转化率( )随时间变化如图所示:
)随时间变化如图所示:

①该反应的
_______ (填“<”“=”或“>”)0。
②达到平衡时,升高温度,_______ [填“ ”或“
”或“ ”]增大的程度更大。
”]增大的程度更大。
 )、硼氢化钠(
)、硼氢化钠( )、硼酸甲酯
)、硼酸甲酯 在工业上有重要用途。回答下列问题:
在工业上有重要用途。回答下列问题:(1)
 在水溶液中会发生如下反应:
在水溶液中会发生如下反应: (反应实质为水电离出的
(反应实质为水电离出的 被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因
被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因(2)利用硼砂(
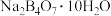 )制备硼酸(
)制备硼酸( )的流程如下图所示:
)的流程如下图所示:
①“调
 ”时需要控制溶液
”时需要控制溶液 ,写出用
,写出用 试纸检测溶液
试纸检测溶液 的操作方法:
的操作方法:②“调
 ”后溶液中有硼酸生成,写出反应的离子方程式:
”后溶液中有硼酸生成,写出反应的离子方程式:③
 在水中电离方程式为:
在水中电离方程式为: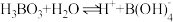 ,
,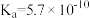 ,据此可判断
,据此可判断 属于
属于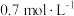 的硼酸溶液中
的硼酸溶液中 的浓度约为
的浓度约为(3)利用硼酸和甲醇制备硼酸甲酯,发生的反应为:
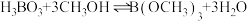 ,不同温度下,硼酸的转化率(
,不同温度下,硼酸的转化率( )随时间变化如图所示:
)随时间变化如图所示:
①该反应的

②达到平衡时,升高温度,
 ”或“
”或“ ”]增大的程度更大。
”]增大的程度更大。
您最近半年使用:0次
2023-02-20更新
|
55次组卷
|
2卷引用:青海省西宁市大通回族土族自治县2022-2023学年高二上学期期末考试化学试题
名校
解题方法
2 . 某含锰废料中主要含MnCO3及少量的FeCO3、SiO2、Cu2(OH)2CO3,以此为原料制备MnO2的流程如下:
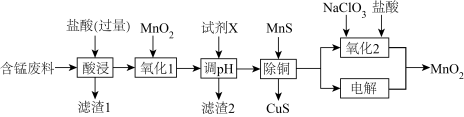
Ⅰ.氢氧化物开始沉淀和完全沉淀的pH如下表:
Ⅱ.常温下Ksp(MnS)=2.0×10-10、Ksp(CuS)=6.0×10-36。
回答下列问题:
(1)滤渣1的主要成分是_________ (填化学式)。
(2)“氧化1”的目的是_________ (用离子方程式表示)。
(3)“调pH”时,试剂X为_________ (任写一种),pH的调节范围为_________ 。
(4)“除铜”时,当溶液中c(Mn2+)=12mol·L-1,溶液中c(Cu2+)=_________  。
。
(5)“氧化2”制备MnO2 (恰好完全反应)时,n(Mn2+):n(ClO )=
)=_________ ( ClO →Cl-);“电解”制备MnO2的阳极电极反应式为
→Cl-);“电解”制备MnO2的阳极电极反应式为_________ 。

Ⅰ.氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时pH | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时pH | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)滤渣1的主要成分是
(2)“氧化1”的目的是
(3)“调pH”时,试剂X为
(4)“除铜”时,当溶液中c(Mn2+)=12mol·L-1,溶液中c(Cu2+)=
 。
。(5)“氧化2”制备MnO2 (恰好完全反应)时,n(Mn2+):n(ClO
 )=
)= →Cl-);“电解”制备MnO2的阳极电极反应式为
→Cl-);“电解”制备MnO2的阳极电极反应式为
您最近半年使用:0次
2022-11-25更新
|
126次组卷
|
4卷引用:青海省西宁市大通县2023-2024学年高二上学期期末考试化学试题
名校
3 . 还原沉淀法是处理含铬(Cr2O 和CrO
和CrO )废水常用方法,过程如下:CrO
)废水常用方法,过程如下:CrO
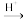 Cr2O
Cr2O
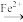 Cr3+
Cr3+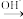 Cr(OH)3,已知废水中Cr的含量为26.0g/L,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全,常温下,Ksp[Cr(OH)3]=1×10-32, Ksp(FeS)=6.3×10-18;Ksp(CuS)=1.3×10-36;Ksp(ZnS)=1.6×10-24,有关叙述中不正确的是( )
Cr(OH)3,已知废水中Cr的含量为26.0g/L,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全,常温下,Ksp[Cr(OH)3]=1×10-32, Ksp(FeS)=6.3×10-18;Ksp(CuS)=1.3×10-36;Ksp(ZnS)=1.6×10-24,有关叙述中不正确的是( )
 和CrO
和CrO )废水常用方法,过程如下:CrO
)废水常用方法,过程如下:CrO
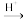 Cr2O
Cr2O
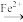 Cr3+
Cr3+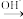 Cr(OH)3,已知废水中Cr的含量为26.0g/L,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全,常温下,Ksp[Cr(OH)3]=1×10-32, Ksp(FeS)=6.3×10-18;Ksp(CuS)=1.3×10-36;Ksp(ZnS)=1.6×10-24,有关叙述中不正确的是( )
Cr(OH)3,已知废水中Cr的含量为26.0g/L,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全,常温下,Ksp[Cr(OH)3]=1×10-32, Ksp(FeS)=6.3×10-18;Ksp(CuS)=1.3×10-36;Ksp(ZnS)=1.6×10-24,有关叙述中不正确的是( )| A.上述三个转化中只有一个涉及氧化还原反应 |
B.第二步离子方程式为Cr2O +4H++6Fe2+=2Cr3++7H2O+6Fe3+ +4H++6Fe2+=2Cr3++7H2O+6Fe3+ |
| C.足量CuSO4溶解在0.1mol/L的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol/L |
| D.在ZnS的饱和溶液中加入FeCl2溶液,一定不产生FeS沉淀 |
您最近半年使用:0次
名校
解题方法
4 . 工业上制备氯化铜时,是将浓盐酸用水蒸气加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:CuO+2HCl=CuCl2+H2O,FeO+2HCl=FeCl2+H2O.
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3∼4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中Fe2+,可采用的方法是__ 。
(2)工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,可能发生反应的离子方程式为__ ;溶液的pH变化是__ 。
(3)已知25℃时,Ksp[Cu(OH)2]=2×10-20。
①某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于__ 。
②要使0.2mol•L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为__ 。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3∼4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中Fe2+,可采用的方法是
(2)工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,可能发生反应的离子方程式为
(3)已知25℃时,Ksp[Cu(OH)2]=2×10-20。
①某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于
②要使0.2mol•L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为
您最近半年使用:0次
5 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______ 离子通过,氯气的逸出口是_______ (填标号)。

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为______ 。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______ 。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____ mol;产生“气泡”的化学方程式为____________ 。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____ kg(保留整数)。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=
 ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近半年使用:0次
2020-07-08更新
|
12618次组卷
|
13卷引用:青海省湟川中学2020-2021学年高二下学期第一次月考化学试题
青海省湟川中学2020-2021学年高二下学期第一次月考化学试题(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)2020年全国统一考试化学试题(新课标Ⅱ)(已下线)专题13 元素及其化合物知识的综合应用-2020年高考真题和模拟题化学分项汇编四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)山东省枣庄市第三中学2022届高三第一次月考化学试题2020年全国卷Ⅱ化学真题变式题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)题型43 次氯酸、氯的含氧酸盐的性质和应用(已下线)专题17 原理综合题
名校
6 . 铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为_______________ 。
(2)配制的FeCl3溶液应保持____________ (填“酸性”“碱性”或“中性”),原因是_____________ 。
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为
(2)配制的FeCl3溶液应保持
您最近半年使用:0次
10-11高二上·青海·期中
7 . 实验室制取氯气时,若没有MnO2则用KMnO4代替,据此回答下列问题:
(1)该反应__ KMnO4+___ HCl=____ KCl+____ MnCl2+____ Cl2+___ H2O;
(2)被氧化的HCl与未被氧化的HCl的物质的量之比为_______________
(1)该反应
(2)被氧化的HCl与未被氧化的HCl的物质的量之比为
您最近半年使用:0次



