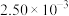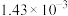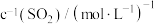解题方法
1 . 金属钛( )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
(1) 元素在周期表中的分区是位于
元素在周期表中的分区是位于___________ 区。基态 原子中含有的未成对电子数是
原子中含有的未成对电子数是___________ 。
(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为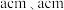 和
和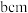 ,结构如下图所示。
,结构如下图所示。___________ , 位于距离最近的
位于距离最近的 构成的
构成的___________ 中心(填字母序号,下同)。
a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为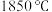 ,其晶体类型
,其晶体类型最不可 能是___________ 。
a.共价晶体 b.离子晶体 c.分子晶体
③若已知 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________  。
。
(3)以钓铁矿 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下: 元素在元素周期表中的位置是
元素在元素周期表中的位置是___________ 。
②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:___________ 。
③结合流程及下表数据,“分离”时所需控制的最低温度应为___________  。
。
④已知 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:___________ 。
 )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。(1)
 元素在周期表中的分区是位于
元素在周期表中的分区是位于 原子中含有的未成对电子数是
原子中含有的未成对电子数是(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为
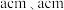 和
和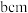 ,结构如下图所示。
,结构如下图所示。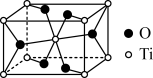
 位于距离最近的
位于距离最近的 构成的
构成的a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为
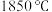 ,其晶体类型
,其晶体类型a.共价晶体 b.离子晶体 c.分子晶体
③若已知
 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为 。
。(3)以钓铁矿
 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下:
 元素在元素周期表中的位置是
元素在元素周期表中的位置是②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:
③结合流程及下表数据,“分离”时所需控制的最低温度应为
 。
。 |  |  | |
熔点/ | 1668 | 651 | 714 |
沸点/ | 3287 | 1107 | 1412 |
 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:
您最近半年使用:0次
2 . 合成氨的发展体现了化学科学与技术的不断进步。
(1)1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:
ⅰ.碳化钙和氮气在1000℃的高温下产生氰氨化钙(CaCN2);
ⅱ.氰氨化钙与水蒸气反应生成氨气。
写出反应ⅱ的化学方程式:_____________ 。
(2)20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:N2(g)+3H2(g)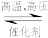 2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。
2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。___ p2(填“>”或“<”),简述理由:__________________ 。
ⅱ.在p1、x(NH3)=0.20时,氮气的转化率为_________ 。
ⅲ.合成氨原料气中存在不参与反应的Ar时会影响NH3的平衡含量。在p1时,以物质的量分数x(H2)=0.675、x(N2)=0.225、x(Ar)=0.10进料(组成2)。反应达平衡时:x(NH3)与温度的计算结果与组成1相比有一定变化,在图中用虚线画出相应曲线______ 。
(3)我国科学家研制出Fe-TiO2-xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而TiO2-xHy的温度为415℃),解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。__________ 。
(1)1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:
ⅰ.碳化钙和氮气在1000℃的高温下产生氰氨化钙(CaCN2);
ⅱ.氰氨化钙与水蒸气反应生成氨气。
写出反应ⅱ的化学方程式:
(2)20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:N2(g)+3H2(g)
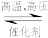 2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。
2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。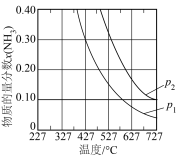
ⅱ.在p1、x(NH3)=0.20时,氮气的转化率为
ⅲ.合成氨原料气中存在不参与反应的Ar时会影响NH3的平衡含量。在p1时,以物质的量分数x(H2)=0.675、x(N2)=0.225、x(Ar)=0.10进料(组成2)。反应达平衡时:x(NH3)与温度的计算结果与组成1相比有一定变化,在图中用虚线画出相应曲线
(3)我国科学家研制出Fe-TiO2-xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而TiO2-xHy的温度为415℃),解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。
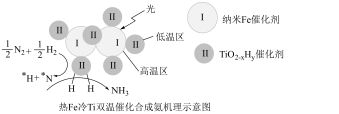
您最近半年使用:0次
名校
解题方法
3 . 分析含有少量NaOH的NaClO溶液与FeSO4溶液的反应。
已知:①图1表示将FeSO4溶液逐滴滴加到含少量NaOH的NaClO溶液中的pH变化;②图2表示NaClO溶液中含氯微粒的物质的量分数与pH的关系[注:饱和NaClO溶液的pH约为11; Ksp[Fe(OH)3]=2.8×10−39]。
已知:①图1表示将FeSO4溶液逐滴滴加到含少量NaOH的NaClO溶液中的pH变化;②图2表示NaClO溶液中含氯微粒的物质的量分数与pH的关系[注:饱和NaClO溶液的pH约为11; Ksp[Fe(OH)3]=2.8×10−39]。
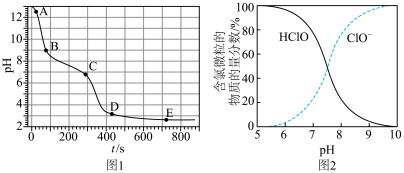
A.A点溶液的pH约为13,主要原因是ClO− + H2O HClO + OH− HClO + OH− |
| B.AB段pH显著下降的原因是5ClO-+2Fe2+ + 5H2O=Cl−+ 2Fe(OH)3↓+ 4HClO |
| C.CD段较BC段pH下降快的主要原因是HClO+2Fe2+ +5H2O=2Fe(OH)3↓+Cl-+ 5H+ |
| D.反应进行至400s时溶液中产生Cl2的原因是:ClO-+ Cl-+2H+=Cl2↑+ H2O |
您最近半年使用:0次
2024-03-19更新
|
339次组卷
|
4卷引用:北京市顺义牛栏山第一中学2023-2024学年高二下学期4月月考化学试题
北京市顺义牛栏山第一中学2023-2024学年高二下学期4月月考化学试题(已下线)2023-2024学年度第二学期高三化学零模试卷北京市师范大学附属实验中学2024届高三零模化学试题2024届河南省信阳高级中学高三下学期模拟考试(十六)理科综合试题-高中化学
名校
4 . 煤中硫的存在形态分为有机硫和无机硫( 、硫化物及微量单质硫等).库仑滴定法是常用的快捷检测煤中全硫含量的方法.其主要过程如下图所示.
、硫化物及微量单质硫等).库仑滴定法是常用的快捷检测煤中全硫含量的方法.其主要过程如下图所示.
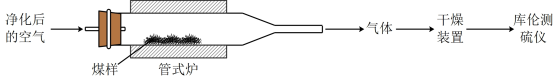
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含 、
、 、
、 、
、 、
、 .
.
(1)煤样需研磨成细小粉末,其目的是____________ .
(2)高温下,煤中 完全转化为
完全转化为 ,该反应的化学方程式为
,该反应的化学方程式为____________ .
(3)通过干燥装置后,待测气体进入库仑测硫仪进行测定.
已知:库仑测硫仪中电解原理示意图如下.检测前,电解质溶液中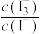 保持定值时,电解池不工作.待测气体进入电解池后,
保持定值时,电解池不工作.待测气体进入电解池后, 溶解并将
溶解并将 还原,测硫仪便立即自动进行电解到
还原,测硫仪便立即自动进行电解到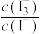 又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量.
又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量.
① 在电解池中发生反应的离子方程式为
在电解池中发生反应的离子方程式为____________ .
②测硫仪工作时电解池的阳极反应式为__________________ .
(4)条件控制和误差分析.
①测定过程中,需控制电解质溶液pH,当pH<1时,非电解生成的 使得测得的全硫含量偏小,生成
使得测得的全硫含量偏小,生成 的离子方程式为
的离子方程式为__________________ .
②测定过程中,管式炉内壁上有 残留,测得全硫量结果为
残留,测得全硫量结果为____________ .(填“偏大”或“偏小”)
 、硫化物及微量单质硫等).库仑滴定法是常用的快捷检测煤中全硫含量的方法.其主要过程如下图所示.
、硫化物及微量单质硫等).库仑滴定法是常用的快捷检测煤中全硫含量的方法.其主要过程如下图所示.
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含
 、
、 、
、 、
、 、
、 .
.(1)煤样需研磨成细小粉末,其目的是
(2)高温下,煤中
 完全转化为
完全转化为 ,该反应的化学方程式为
,该反应的化学方程式为(3)通过干燥装置后,待测气体进入库仑测硫仪进行测定.
已知:库仑测硫仪中电解原理示意图如下.检测前,电解质溶液中
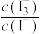 保持定值时,电解池不工作.待测气体进入电解池后,
保持定值时,电解池不工作.待测气体进入电解池后, 溶解并将
溶解并将 还原,测硫仪便立即自动进行电解到
还原,测硫仪便立即自动进行电解到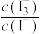 又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量.
又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量.
①
 在电解池中发生反应的离子方程式为
在电解池中发生反应的离子方程式为②测硫仪工作时电解池的阳极反应式为
(4)条件控制和误差分析.
①测定过程中,需控制电解质溶液pH,当pH<1时,非电解生成的
 使得测得的全硫含量偏小,生成
使得测得的全硫含量偏小,生成 的离子方程式为
的离子方程式为②测定过程中,管式炉内壁上有
 残留,测得全硫量结果为
残留,测得全硫量结果为
您最近半年使用:0次
名校
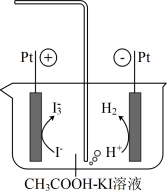
5 . 白葡萄酒含有糖、醇、有机酸、维生素等营养物质, 作为必要的添加剂,具有减缓氧化、防腐、调酸等作用。某学习小组用“直接碘量法”对灌装后存放不同时间的白葡萄酒样品中
作为必要的添加剂,具有减缓氧化、防腐、调酸等作用。某学习小组用“直接碘量法”对灌装后存放不同时间的白葡萄酒样品中 浓度的变化规律进行探究。
浓度的变化规律进行探究。
(1)滴定前准备 各取存放了2个月、6个月、10个月的白葡萄酒样品5.00mL,分别放入三个盛有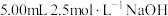 溶液的碘量瓶中。将碘量瓶在冰水浴中冷却,继续加入
溶液的碘量瓶中。将碘量瓶在冰水浴中冷却,继续加入 硫酸及1mL淀粉溶液,充分超声震荡3min。
硫酸及1mL淀粉溶液,充分超声震荡3min。
①样品中 和NaOH溶液反应的离子方程式为
和NaOH溶液反应的离子方程式为________ 。
②下列说法正确的是________ (填字母序号)。
a.如果样品颜色较深,应对样品脱色后再进行滴定
b.因 在碱性条件下会发生歧化,故需要充分酸化后再滴定
在碱性条件下会发生歧化,故需要充分酸化后再滴定
c.超声震荡过程中温度显著升高,用冰水浴降温有利于 的测定
的测定
(2)滴定过程 待碘量瓶温度稳定后,用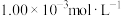 碘的标准溶液滴定。
碘的标准溶液滴定。
①滴定过程中,碘量瓶中发生反应的离子方程式为________ 。
②达到滴定终点时,碘量瓶中的现象是________ 。
(3)数据处理及应用 每个样品进行三次平行滴定实验,记录消耗碘的标准溶液体积的平均值,并进行相关计算,结果如下表。
已知: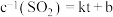 (k、b为常数),该函数对应的图像如下图所示。
(k、b为常数),该函数对应的图像如下图所示。
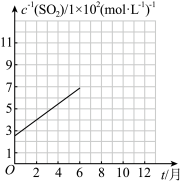
①表中
________ 。
②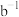 表达的实际含义是
表达的实际含义是________ 。
(4)实验改进及反思 小组同学先将白葡萄酒中二氧化硫充分蒸出,并用足量碱性溶液完全吸收,再将溶液酸化后用碘的标准溶液滴定。发现测定结果比“直接碘量法”更低。分析“直接碘量法”测定数据偏高的可能原因________ 。
 作为必要的添加剂,具有减缓氧化、防腐、调酸等作用。某学习小组用“直接碘量法”对灌装后存放不同时间的白葡萄酒样品中
作为必要的添加剂,具有减缓氧化、防腐、调酸等作用。某学习小组用“直接碘量法”对灌装后存放不同时间的白葡萄酒样品中 浓度的变化规律进行探究。
浓度的变化规律进行探究。(1)滴定前准备 各取存放了2个月、6个月、10个月的白葡萄酒样品5.00mL,分别放入三个盛有
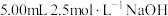 溶液的碘量瓶中。将碘量瓶在冰水浴中冷却,继续加入
溶液的碘量瓶中。将碘量瓶在冰水浴中冷却,继续加入 硫酸及1mL淀粉溶液,充分超声震荡3min。
硫酸及1mL淀粉溶液,充分超声震荡3min。①样品中
 和NaOH溶液反应的离子方程式为
和NaOH溶液反应的离子方程式为②下列说法正确的是
a.如果样品颜色较深,应对样品脱色后再进行滴定
b.因
 在碱性条件下会发生歧化,故需要充分酸化后再滴定
在碱性条件下会发生歧化,故需要充分酸化后再滴定c.超声震荡过程中温度显著升高,用冰水浴降温有利于
 的测定
的测定(2)滴定过程 待碘量瓶温度稳定后,用
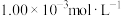 碘的标准溶液滴定。
碘的标准溶液滴定。①滴定过程中,碘量瓶中发生反应的离子方程式为
②达到滴定终点时,碘量瓶中的现象是
(3)数据处理及应用 每个样品进行三次平行滴定实验,记录消耗碘的标准溶液体积的平均值,并进行相关计算,结果如下表。
存放时间t/月 | 2 | 6 | 10 |
V(碘的标准溶液)/mL | 12.50 | 7.14 | 5.00 |
|
|
| m |
| n | 700 | p |
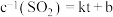 (k、b为常数),该函数对应的图像如下图所示。
(k、b为常数),该函数对应的图像如下图所示。
①表中

②
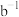 表达的实际含义是
表达的实际含义是(4)实验改进及反思 小组同学先将白葡萄酒中二氧化硫充分蒸出,并用足量碱性溶液完全吸收,再将溶液酸化后用碘的标准溶液滴定。发现测定结果比“直接碘量法”更低。分析“直接碘量法”测定数据偏高的可能原因
您最近半年使用:0次
6 . 工业上,常用以下方法处理硫化氢废气。
Ⅰ.高温热分解法,即在恒温、恒压条件下,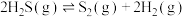
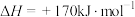
(1)下列不能 作为该反应达到平衡状态的标志的是_____。(填字母)
(2)达到平衡状态后,通入氩气,分析 平衡转化率的变化及原因
平衡转化率的变化及原因_____ 。
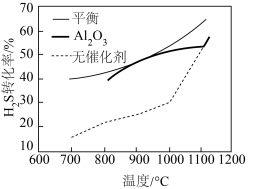
(3)为提高 转化率,常用
转化率,常用 作催化剂,经过相同时间测定
作催化剂,经过相同时间测定 的转化率与温度的关系如图,在
的转化率与温度的关系如图,在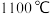 以后,有无催化剂
以后,有无催化剂 的转化率几乎相等,其原因是
的转化率几乎相等,其原因是_____ 。
II. 溶液脱除法,即将含有
溶液脱除法,即将含有 的废气通入
的废气通入 溶液中
溶液中
(4)脱除并再生的原理如图,写出总反应的化学方程式_____ 。
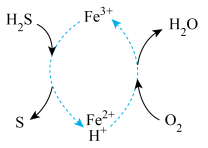
(5)如图所示,反应相同时间时,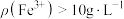 时
时 脱除率下降,推测可能的原因为
脱除率下降,推测可能的原因为_____ 。

(6)当废气中硫化氢浓度较低时,常用纯碱溶液吸收,结合表中数据计算该反应的平衡常数_____ 。
Ⅰ.高温热分解法,即在恒温、恒压条件下,
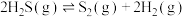
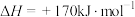
(1)下列
A. 在体系中质量分数保持不变 在体系中质量分数保持不变 |
| B.气体的平均相对分子质量不再变化 |
| C.气体密度不再变化 |
D. 的消耗速率与 的消耗速率与 的消耗速率之比为 的消耗速率之比为 |
(2)达到平衡状态后,通入氩气,分析
 平衡转化率的变化及原因
平衡转化率的变化及原因(3)为提高
 转化率,常用
转化率,常用 作催化剂,经过相同时间测定
作催化剂,经过相同时间测定 的转化率与温度的关系如图,在
的转化率与温度的关系如图,在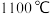 以后,有无催化剂
以后,有无催化剂 的转化率几乎相等,其原因是
的转化率几乎相等,其原因是
II.
 溶液脱除法,即将含有
溶液脱除法,即将含有 的废气通入
的废气通入 溶液中
溶液中(4)脱除并再生的原理如图,写出总反应的化学方程式

(5)如图所示,反应相同时间时,
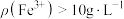 时
时 脱除率下降,推测可能的原因为
脱除率下降,推测可能的原因为
(6)当废气中硫化氢浓度较低时,常用纯碱溶液吸收,结合表中数据计算该反应的平衡常数
| 酸(常温下) |  |  |
 |  | 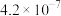 |
 | 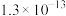 |  |
您最近半年使用:0次
名校
解题方法
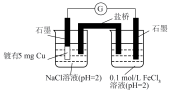
7 . 某小组探究Cu与 的反应,进行如下实验。
的反应,进行如下实验。
已知: (无色)
(无色) (白色)
(白色)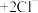
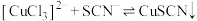 (白色)
(白色)
(1)Ⅰ、Ⅱ中,反应后的溶液均变为蓝色,推测有 生成。分别取少量反应后的溶液,滴加
生成。分别取少量反应后的溶液,滴加 溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是
溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是_______ 。
(2) 内,Cu被氧化的反应速率:Ⅰ
内,Cu被氧化的反应速率:Ⅰ_______ Ⅱ(填“>”“<”或“=”)。
(3)研究Ⅱ的反应过程,设计如下装置进行实验。不同时间取左侧烧杯中的溶液,滴加 溶液,取样时间与实验现象如下(不考虑
溶液,取样时间与实验现象如下(不考虑 的作用)。
的作用)。
经检验,白色沉淀为 。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加
。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加 溶液,溶液红色依次变浅。
溶液,溶液红色依次变浅。
① 溶液的浓度是
溶液的浓度是_______  。
。
②根据ⅰ、ⅱ中“产生白色沉淀”“溶液红色变浅”,推测Cu转化为 ,Cu与
,Cu与 溶液反应的离子方程式是
溶液反应的离子方程式是_______ 。
③由ⅲ、ⅳ可知, 后主要反应的离子方程式是
后主要反应的离子方程式是_______ 。
(4)对比Ⅰ和Ⅱ,结合ⅰ~ⅳ, 在Cu与
在Cu与 反应中的作用是
反应中的作用是_______ 。
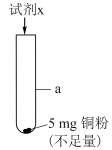
(5)研究 的浓度对铜粉溶解的影响,进行如下实验。
的浓度对铜粉溶解的影响,进行如下实验。
a中加入的试剂x为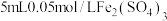 和
和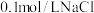 的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是
的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是 。则铜粉未完全溶解的原因是
。则铜粉未完全溶解的原因是_______ 。
 的反应,进行如下实验。
的反应,进行如下实验。已知:
 (无色)
(无色) (白色)
(白色)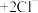
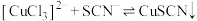 (白色)
(白色)
| 序号 | 试剂x | 实验现象 |
| Ⅰ | 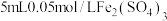 溶液 溶液 | 溶液变为浅蓝色, 时,铜粉有较多剩余 时,铜粉有较多剩余 | |
| Ⅱ | 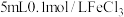 溶液 溶液 | 溶液变为蓝色, 时,铜粉完全溶解 时,铜粉完全溶解 |
(1)Ⅰ、Ⅱ中,反应后的溶液均变为蓝色,推测有
 生成。分别取少量反应后的溶液,滴加
生成。分别取少量反应后的溶液,滴加 溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是
溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是(2)
 内,Cu被氧化的反应速率:Ⅰ
内,Cu被氧化的反应速率:Ⅰ(3)研究Ⅱ的反应过程,设计如下装置进行实验。不同时间取左侧烧杯中的溶液,滴加
 溶液,取样时间与实验现象如下(不考虑
溶液,取样时间与实验现象如下(不考虑 的作用)。
的作用)。
| 序号 | 取样时间/min | 现象 |
| ⅰ | 1 | 产生白色沉淀 | |
| ⅱ | 10 | 产生白色沉淀,较 时量多 时量多 | |
| ⅲ | 30 | 产生白色沉淀,较 时量少 时量少 | |
| ⅳ | 40 | 无白色沉淀产生 |
 。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加
。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加 溶液,溶液红色依次变浅。
溶液,溶液红色依次变浅。①
 溶液的浓度是
溶液的浓度是 。
。②根据ⅰ、ⅱ中“产生白色沉淀”“溶液红色变浅”,推测Cu转化为
 ,Cu与
,Cu与 溶液反应的离子方程式是
溶液反应的离子方程式是③由ⅲ、ⅳ可知,
 后主要反应的离子方程式是
后主要反应的离子方程式是(4)对比Ⅰ和Ⅱ,结合ⅰ~ⅳ,
 在Cu与
在Cu与 反应中的作用是
反应中的作用是(5)研究
 的浓度对铜粉溶解的影响,进行如下实验。
的浓度对铜粉溶解的影响,进行如下实验。a中加入的试剂x为
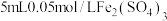 和
和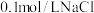 的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是
的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是 。则铜粉未完全溶解的原因是
。则铜粉未完全溶解的原因是
您最近半年使用:0次
2024-01-20更新
|
143次组卷
|
2卷引用:北京市第一七一中学2023-2024学年高二下学期3月月考化学试题
解题方法
8 . 某化学小组同学对FeCl3溶液与Na2SO3溶液的反应进行探究
(1)请用离子方程式表示Na2SO3溶液显碱性的原因___________ 。
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为___________ ,取反应后的溶液中加入K3[Fe(CN)6]溶液,观察到___________ (填现象),证实了此结论。
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因___________ 。
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入___________ ,观察到___________ (填实验现象),证实此浓度下的FeCl3溶液与Na2SO3溶液可以发生氧化还原反应。

(5)查阅资料已知:Fe3+、OH-、SO 可形成难电离的红色配合物:
可形成难电离的红色配合物: 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因___________ 。
(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受___________ 因素影响(至少写出两项)。
| 实验操作 | 现象 | |
| ① |  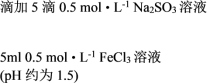 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,溶液变为淡黄色,始终无沉淀生成。 |
② |  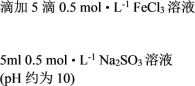 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,生成红褐色沉淀,上层清液为无色。 |
(1)请用离子方程式表示Na2SO3溶液显碱性的原因
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入

(5)查阅资料已知:Fe3+、OH-、SO
 可形成难电离的红色配合物:
可形成难电离的红色配合物: 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受
您最近半年使用:0次
9 . 工业上利用软锰矿和菱锰矿联合进行锅炉燃煤烟气脱硫,同时制备重要化工产品MnSO4,工艺流程如下:
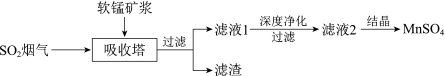
资料:i.软锰矿的主要成分是 MnO2,含少量SiO2、Fe3O4、FeO。
ⅱ.锅炉燃煤过程中空气过量。
ⅲ.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH。
(1)吸收烟气前,软锰矿需研磨后填入吸收塔。研磨的目的是___________ 。
(2)将SO2烟气通入吸收塔中,发生的主要反应的化学方程式是___________ 。
(3)软锰矿浆脱硫过程中,控制流量,每隔3 h监测一次:测定软锰矿浆的pH;同时测定吸收塔入口和出口的SO2含量,计算SO2的吸收率,结果如图所示:
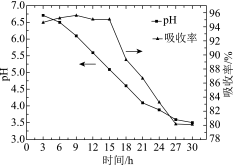
①吸收塔中矿浆pH逐渐下降的原因是________ (用化学用语表示)。
②当SO2吸收率低于95%时,无法实现SO2烟气的达标排放,此时需向吸收塔中加入一定量菱锰矿(主要成分MnCO3)。下列说法中,正确的是_________ (填字母)。
a.吸收塔中吸收率下降的可能原因是pH减小抑制了SO2的溶解
b.菱锰矿调节pH升至5.0以上后,吸收率又可以恢复至95%左右
c.加入菱锰矿能增加矿浆中Mn2+的浓度
(4)经检测发现滤液1中仍含有少量Fe2+,可加入MnO2进行“深度净化”,该过程中反应的离子方程式是___________ 。
(5)产品含量测定方法如下:
I.称取a g晶体,加足量硫酸溶解,将溶液定容于100 mL容量瓶中。
Ⅱ.取25.00 mL 溶液于锥形瓶中,加入少量催化剂和过量 (NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
Ⅲ.加入指示剂,用b mol/L (NH4)2Fe(SO4)2溶液滴定,滴定至终点时消耗c mL, 重新变成Mn2+。
重新变成Mn2+。
① 补全步骤Ⅱ中反应的离子方程式:_____ ,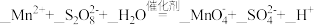 。
。
②产品中MnSO4的质量分数为________ (MnSO4的摩尔质量为151 g/mol)。

资料:i.软锰矿的主要成分是 MnO2,含少量SiO2、Fe3O4、FeO。
ⅱ.锅炉燃煤过程中空气过量。
ⅲ.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH。
| 金属离子 | Fe3+ | Fe2+ | Mn2+ |
| 开始沉淀 | 1.5 | 6.3 | 7.6 |
| 完全沉淀 | 2.8 | 8.3 | 10.2 |
(1)吸收烟气前,软锰矿需研磨后填入吸收塔。研磨的目的是
(2)将SO2烟气通入吸收塔中,发生的主要反应的化学方程式是
(3)软锰矿浆脱硫过程中,控制流量,每隔3 h监测一次:测定软锰矿浆的pH;同时测定吸收塔入口和出口的SO2含量,计算SO2的吸收率,结果如图所示:

①吸收塔中矿浆pH逐渐下降的原因是
②当SO2吸收率低于95%时,无法实现SO2烟气的达标排放,此时需向吸收塔中加入一定量菱锰矿(主要成分MnCO3)。下列说法中,正确的是
a.吸收塔中吸收率下降的可能原因是pH减小抑制了SO2的溶解
b.菱锰矿调节pH升至5.0以上后,吸收率又可以恢复至95%左右
c.加入菱锰矿能增加矿浆中Mn2+的浓度
(4)经检测发现滤液1中仍含有少量Fe2+,可加入MnO2进行“深度净化”,该过程中反应的离子方程式是
(5)产品含量测定方法如下:
I.称取a g晶体,加足量硫酸溶解,将溶液定容于100 mL容量瓶中。
Ⅱ.取25.00 mL 溶液于锥形瓶中,加入少量催化剂和过量 (NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
Ⅲ.加入指示剂,用b mol/L (NH4)2Fe(SO4)2溶液滴定,滴定至终点时消耗c mL,
 重新变成Mn2+。
重新变成Mn2+。① 补全步骤Ⅱ中反应的离子方程式:
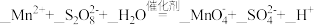 。
。②产品中MnSO4的质量分数为
您最近半年使用:0次
2024-01-19更新
|
212次组卷
|
3卷引用:北京市西城区2023-2024学年高二上学期期末考试化学试题
10 . NH3经一系列反应可以得到HNO3,如下图所示。
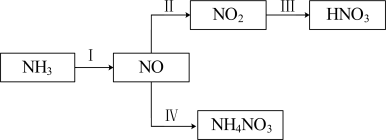
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是________ 。
(2)Ⅱ中,2NO(g)+O2 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
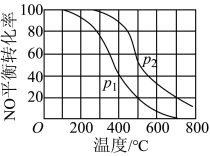
①比较P1、P2的大小关系:______ 。
②随温度升高,该反应平衡常数变化的趋势是______ 。(填“增大”、“减小”或“不变”)
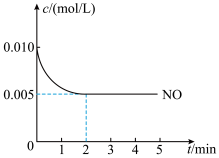
③2NO(g)+O2 2NO2(g)是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
a.2min内,v(O2)=________ mol/(L·min)。
b.800℃时,该反应的化学平衡常数为_______ 。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2 (g) N2O4(g) △H1;2NO2 (g)
N2O4(g) △H1;2NO2 (g) N2O2 (l) △H2;下列能量变化示意图中,正确的是(选填字母)
N2O2 (l) △H2;下列能量变化示意图中,正确的是(选填字母) ____ 。
A. B.
B.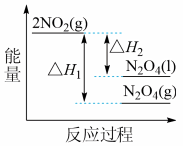 C.
C.
②N2O4与O2、H2O化合的化学方程式是____ 。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示:
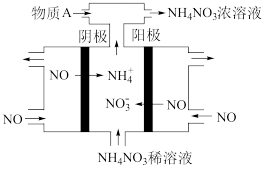
①阳极反应方程式为:___________
②为使电解产物全部转化为NH4NO3,需补充物质A,A是____ 。

(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是
(2)Ⅱ中,2NO(g)+O2
 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
①比较P1、P2的大小关系:
②随温度升高,该反应平衡常数变化的趋势是
③2NO(g)+O2
 2NO2(g)是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。a.2min内,v(O2)=
b.800℃时,该反应的化学平衡常数为

(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2 (g)
 N2O4(g) △H1;2NO2 (g)
N2O4(g) △H1;2NO2 (g) N2O2 (l) △H2;下列能量变化示意图中,正确的是(选填字母)
N2O2 (l) △H2;下列能量变化示意图中,正确的是(选填字母) A.
 B.
B. C.
C.
②N2O4与O2、H2O化合的化学方程式是
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示:

①阳极反应方程式为:
②为使电解产物全部转化为NH4NO3,需补充物质A,A是
您最近半年使用:0次